T-DXd plus pertuzumab en première ligne? Passage au camizestrant en cas de mutations du gène ESR1
Compte-rendu:
Dre rer. nat. Ine Schmale
L’association trastuzumab déruxtécan (T-DXd) plus pertuzumab en première ligne permet de prolonger la survie sans progression (PFS) des patient·es atteint·es d’un cancer du sein avancé depuis plus d’un an en moyenne, comme l’a montré la première analyse intermédiaire de l’étude DESTINY-Breast09. L’étude SERENA-6 a évalué le traitement par camizestrant plus inhibiteur de CDK4/6 guidé par l’ADN tumoral circulant (ctDNA) chez des patient·es atteint·es d’un cancer du sein positif aux récepteurs hormonaux (HR+) et HER2- avancé. Les résultats suggèrent une nouvelle stratégie thérapeutique de référence. Les présentations des études ASCENT-04/KEYNOTE-D19 et VERITAC-2 ont également été intéressantes.
Étude DESTINY-Breast09: les patient·es tirent profit du T-DXd plus pertuzumab en première ligne
Les médicaments ciblant HER2, pertuzumab et T-DXd, inhibent tous deux la dimérisation du récepteur HER2: le pertuzumab, l’hétérodimérisation avec HER3 et le T-DXd, l’homodimérisation. L’effet synergique est en outre renforcé par la libération du cytostatique après l’internalisation du T-DXd et par l’effet «bystander» dû à la pénétration du cytostatique dans les cellules tumorales voisines. L’association T-DXd plus pertuzumab a été comparée aux associations T-DXd plus placebo et taxane plus trastuzumab plus pertuzumab (THP) dans l’étude de phaseIII à trois bras DESTINY-Breast09. Au total, 1157 patient·es atteint·es d’un cancer du sein HER2+ avancé ou métastatique et n’ayant pas encore reçu de traitement systémique pour la maladie métastatique ont été inclus·es dans l’étude. Une hormonothérapie était autorisée au stade métastatique. Les patient·es présentant des métastases cérébrales inactives asymptomatiques ont pu être inclus·es. Le critère d’évaluation primaire de l’étude était la PFS. Une analyse intermédiaire d’une durée de suivi de 29,2 mois, qui ne prenait en compte que les deux bras de l’étude T-DXd plus pertuzumab et THP, a été présentée lors du congrès de l’ASCO.1 L’âge médian des patient·es était de 54 ans. Les tumeurs étaient HR+ chez 54% des personnes concernées. Des métastases cérébrales ont été identifiées chez environ 6% et des métastases viscérales chez 70 à 73%. Près d’un tiers des patient·es présentaient des mutations de PIK3CA.
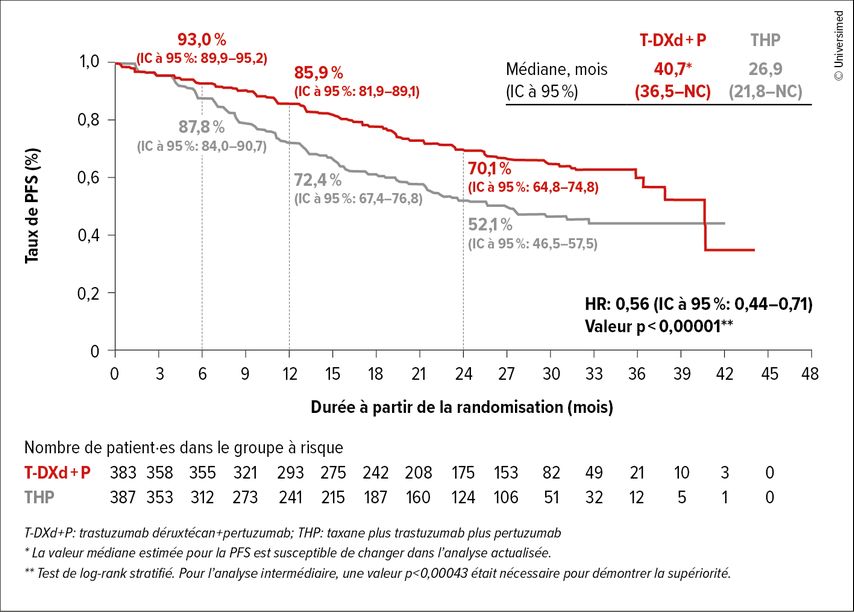
La PFS a été prolongée de manière statistiquement significative et cliniquement pertinente sous T-DXd plus pertuzumab en première ligne par rapport au THP (HR: 0,56; IC à 95%: 0,44–0,71; p<0,0001; Fig.1). La PFS médiane des patient·es était de 40,7 par rapport à 26,9 mois. Le taux de PFS était de 85,9 par rapport à 72,4% après 12 mois et de 70,1 par rapport à 52,1% après 24 mois. L’avantage en termes de PFS a été constaté de manière cohérente dans les sous-groupes pré-spécifiés. Une réponse a été observée chez 85,1 par rapport à 78,6% des patient·es, avec une durée médiane de la réponse de 39,2 par rapport à 26,4 mois. Après 24 mois, 73,3 par rapport à 54,9% des patient·es étaient encore en rémission durable. On a également observé un effet thérapeutique sur la PFS2. 32,4 par rapport à 46,8% des patient·es ont reçu un traitement de deuxième ligne après l’arrêt du médicament à l’étude. Le risque de progression sous traitement de deuxième ligne a été réduit de 40% dans le bras sous T-DXd plus pertuzumab par rapport au bras sous THP (HR: 0,60; IC à 95%: 0,45–0,79; p=0,00038). Le profil de sécurité de l’association T-DXd plus pertuzumab était cohérent avec les profils connus de chaque substance.
Fig.1: Le critère d’évaluation primaire de survie sans progression (PFS) dans l’étude DESTINY-Breast09: bénéfice statistiquement significatif du T-DXd+P (médiane Δ13,8 mois; modifiée selon Tolaney SM et al.)1
Conclusion
L’association T-DXd plus pertuzumab était significativement et cliniquement supérieure au THP en termes de PFS. Elle pourrait constituer un nouveau traitement de référence en première ligne chez les patient·es atteint·es d’un cancer du sein HER2+ avancé ou métastatique.
Étude SERENA-6: passage au camizestrant en cas de survenue demutations du gène ESR1
Environ 70% des cancers du sein sont positifs aux récepteurs des œstrogènes (ER+) et HER2-. Le gène ESR1 code pour les ER. Les mutations du gène ESR1 entraînent une activation constitutive des ER, indépendante des œstrogènes. Ces mutations sont rarement identifiées (<5%) au moment du diagnostic du cancer du sein. D’autres mutations du gène ESR1 se développent pendant le traitement de première ligne par un inhibiteur de l’aromatase (AI) et un inhibiteur de CDK4/6, de sorte qu’elles sont détectées chez environ 40% des patient·es en cas de progression de la maladie.
Le camizestrant est un dégradeur sélectif des récepteurs des œstrogènes (SERD) par voie orale de nouvelle génération, développé pour dégrader les ER mutés et sauvages. Comme les mutations du gène ESR1 peuvent être détectées par biopsie liquide dans le ctDNA avant la progression tumorale, l’étude SERENA-6 a évalué le passage de l’inhibiteur de l’aromatase (AI) au camizestrant, tout en conservant l’inhibiteur de CDK4/6 en cas de survenue d’une mutation du gène ESR1.2
Pour ce faire, 3256 patient·es déjà traité·es en première ligne par un AI plus inhibiteur de CDK4/6 pendant au moins 6 mois, ont été examiné·es tous les 2 à 3 mois pour détecter les mutations du gène ESR1 dans le ctDNA. Une mutation du gène ESR1 a été identifiée chez 548 patient·es au cours de l’étude. 315 ont été randomisé·es pour recevoir un traitement par camizestrant plus inhibiteur de CDK4/6 plus AI placebo ou par AI plus inhibiteur de CDK4/6 plus camizestrant placebo. Le critère d’évaluation primaire était la PFS selon l’évaluation de l’investigateur·rice.
La PFS a été prolongée de 9,2 à 16,0 mois en médiane par le remplacement de l’AI en cas de détection de mutations du gène ESR1. Le risque de progression de la maladie ou de décès a été réduit de 56% (HR: 0,44; IC à 95%: 0,31–0,60; p<0,0001). Le taux de PFS était de 60,7% dans le bras sous camizestrant par rapport à 33,4% dans le bras sous AI après 12 mois, et de 29,7 par rapport à 5,4% après 24 mois. Le délai jusqu’à une détérioration significative de la qualité de vie selon le questionnaire QLQ-C30 de l’EORTC a été plus que triplé (médiane de 23,0 par rapport à 6,4 mois; HR: 0,53; IC à 95%: 0,33–0,82; p<0,001). Une PFS prolongée a également été observée pour le traitement ultérieur (PFS2: HR: 0,52; IC à 95%: 0,33–0,81; p=0,0038). L’incidence des effets secondaires de grade≥3 était modérément plus élevée dans le bras sous camizestrant que dans le bras sous AI (60 par rapport à 46%) pour une durée de traitement plus longue (10,1 par rapport à 6,3 mois).
Dans les deux bras de l’étude, la neutropénie a été le principal facteur des effets secondaires de grade≥3. Les médicaments à l’étude ont été arrêtés par <2% des patient·es en raison d’effets secondaires.
Conclusion
Le passage d’un AI au camizestrant, tout en conservant l’inhibiteur de CDK4/6, en cas de survenue de mutations du gène ESR1 pendant le traitement de première ligne avant la progression de la maladie, prolonge significativement la PFS des patient·es atteint·es d’un cancer du sein HR+/HER2- avancé. Les résultats de l’étude SERENA-6 pourraient établir une nouvelle stratégie thérapeutique permettant de retarder la progression sous traitement de première ligne.
Étude ASCENT-04: un nouveau traitement de référence sans CTx en première ligne dans le TNBC?
Pour les patient·es atteint·es d’un cancer du sein triple négatif (TNBC) localement avancé, non résécable ou métastatique, PD-L1+, des options efficaces sont nécessaires dans le traitement de première ligne. Selon diverses études d’autorisation, une immunochimiothérapie a permis d’atteindre une PFS médiane de 7,5 à 9,7 mois et la plupart des patient·es ont connu une rechute de la maladie. Le sacituzumab govitecan est un conjugué anticorps-médicament (ADC) dirigé contre Trop-2 qui a démontré un avantage en termes de survie globale dans plusieurs entités. Dans l’étude de phaseIII ASCENT-04/KEYNOTE-D19, le sacituzumab govitecan a été combiné au pembrolizumab et évalué de manière randomisée par rapport à une chimiothérapie plus pembrolizumab. Le critère d’évaluation primaire de l’étude était la PFS selon une revue indépendante.3 Au total, 443 patient·es d’un âge médian de 54–55 ans ont été inclus·es dans l’étude. 26% des patient·es étaient âgé·es de 65 ans ou plus. Il s’agissait d’un cancer de novo chez 34%, d’une récidive dans les 6 à 12 mois chez 18% et d’une récidive plus de 12 mois après le traitement curatif chez 48%.
Au final, la PFS médiane était de 11,2 mois dans le bras expérimental par rapport à 7,8 mois dans le bras de contrôle. Le risque de progression ou de décès a été réduit de 35% sous govitecan sacituzumab par rapport au schéma thérapeutique comprenant une chimiothérapie (HR: 0,65; IC à 95%: 0,51–0,84; p<0,001). 72 par rapport à 63% des patient·es ne présentaient aucune progression après 6 mois, et 48 par rapport à 33% après 12 mois. Une réponse tumorale a été observée chez 60 par rapport à 53% des patient·es, avec des taux de rémission complète de 13 par rapport à 8%. La maladie s’est stabilisée chez 32% des patient·es des deux bras de l’étude. La durée de la réponse a également été plus longue sous sacituzumab govitecan plus pembrolizumab, avec 16,5 par rapport à 9,2 mois.
En ce qui concerne la sécurité, un taux comparable d’effets secondaires de grade≥3 (71 par rapport à 70%) a été observé, malgré une durée de traitement plus longue dans le bras expérimental. Les effets secondaires liés au traitement ayant entraîné une réduction de la dose (35 par rapport à 44%) ou l’arrêt du traitement (12 par rapport à 31%) ont été moins souvent rapportés sous sacituzumab govitecan plus pembrolizumab.
Conclusion
L’association sacituzumab govitecan plus pembrolizumab a prolongé la PFS de manière statistiquement significative et cliniquement pertinente par rapport à la chimiothérapie plus pembrolizumab. Elle constitue donc potentiellement un nouveau traitement de référence en première ligne dans le cancer du sein triple négatif localement avancé, non résécable ou métastatique, PD-L1+.
Étude VERITAC-2: le SERD vepdegestrant constitue une nouvelle option de deuxième ligne
En cas de progression d’un cancer du sein ER+/HER2- avancé après une hormonothérapie en première ligne, il n’existe aucune recommandation fondée sur des preuves pour le traitement ultérieur. Le vepdegestrant est un SERD par voie orale qui se lie à la fois aux ER sauvages et mutés.
L’étude de phaseIII VERITAC-2 a comparé de manière randomisée le vepdegestrant au fulvestrant.4
Au total, 624 patient·es atteint·es d’un cancer du sein ER+/HER2- avancé ou métastatique ont été inclus·es dans l’étude. Environ 80% des patient·es avaient déjà reçu une ligne de traitement et 20% deux lignes de traitement au stade avancé ou métastatique. Les critères d’évaluation primaires étaient la PFS dans la population présentant une mutation du gène ESR1 et chez l’ensemble des patient·es inclus·es.
En ce qui concerne la population présentant une mutation du gène ESR1, une réduction de 43% du risque de progression ou de décès a été observée (HR: 0,57; IC à 95%: 0,42–0,77; p<0,001). La PFS médiane était de 5,0 mois sous vepdegestrant par rapport à 2,1 mois sous fulvestrant. Le taux de PFS était de 45,2 par rapport à 22,7% à 6 mois. Pour l’ensemble de la population étudiée, aucun avantage significatif n’a été observé sous vepdegestrant par rapport au fulvestrant (HR: 0,83; IC à 95% 0,68–1,02; p=0,07).
18,6 par rapport à 4,0% des patient·es atteint·es de tumeurs présentant une mutation du gène ESR1 ont répondu au traitement par le vepdegestrant ou le fulvestrant, et le taux de contrôle clinique était de 42,1 par rapport à 20,2%. Pour l’ensemble de la population étudiée, une réponse de 10,9 par rapport à 3,6% et un taux de contrôle clinique de 34,3 par rapport à 28,7% ont été rapportés. Les deux médicaments ont été bien tolérés, avec un taux d’arrêt du traitement en raison d’effets secondaires liés au traitement de 3 et 1%, respectivement.
Conclusion
Le vepdegestrant a montré une prolongation statistiquement significative et cliniquement pertinente de la PFS par rapport au fulvestrant chez des patient·es atteint·es d’un cancer du sein HER2-/ER+ avancé avec mutation du gène ESR1. Il constitue une option thérapeutique potentielle chez cette population ayant reçu un traitement antérieur.
Source:
Congrès 2025 de l’American Society of Clinical Oncology (ASCO), 30 mai au 4 juin, Chicago, États-Unis
Littérature:
1 Tolaney SM et al.: Trastuzumab deruxtecan (T-DXd) + pertuzumab vs taxane + trastuzumab + pertuzumab (THP) for first-line treatment of patients with human epidermal growth factor receptor 2-positive (HER2+) advanced/metastatic breast cancer: interim results from DESTINY-Breast09. ASCO 2025; Abstr. #LBA1008 2 Turner NC et al.: Camizestrant + CDK4/6 inhibitor (CDK4/6i) for the treatment of emergent ESR1 mutations during first-line endocrine-based therapy and ahead of disease progression in patients with HR+/HER2- advanced breast cancer: phase 3, double-blind ctDNA-guided SERENA-6 trial. ASCO 2025; Abstr. #LBA4 3 Tolaney SM et al.: Sacituzumab govitecan + pembrolizumab vs chemotherapy + pembrolizumab in patients with previously untreated PD-L1+ advanced or metastatic triple-negative breast cancer (TNBC): primary results from the randomized phase 3 ASCENT-04/KEYNOTE-D19 study. ASCO 2025; Abstr. #LBA109 4 Hamilton EP et al.: Vepdegestrant, a PROTAC estrogen receptor (ER) degrader, vs fulvestrant in ER-positive/human epidermal growth factor receptor 2 (HER2)-negativ advanced breast cancer: results of the global, randomized, phase 3 VERITAC-2 study. ASCO 2025; Abstr. #LBA1000
Das könnte Sie auch interessieren:
Biomarqueurs hématologiques des infections – qu’est-ce qui est pertinent etdans quel cas?
Le dosage de différents biomarqueurs joue un rôle important dans le dépistage des infections fongiques invasives. L’évaluation d’un biomarqueur positif en cas d’infections fongiques ...
«Grâce à la Young Oncology Academy, j’ai pu me constituer un réseau»
La Young Oncology Academy (Academy) du Swiss Cancer Institute est un programme de promotion et de mentorat pour les jeunes oncologues. Le programme s’adresse aux médecins-assistants qui ...
«Ce serait bien d’établir un lien»
Le cancer du poumon de Michael Emmenegger-Müller a changé sa vie, mais pas sa motivation à s’engager pour les autres. Il a fondé l’organisation «Leben mit Lungenkrebs» (Vivre avec le ...