Quoi de neuf à propos de l’immunothérapie néoadjuvante?
Auteure:
PD Dre méd. Gudrun Absenger
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin
Medizinische Universität Graz
E-mail: gudrun.absenger@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’immunothérapie par inhibiteurs de point de contrôle fait partie intégrante du traitement palliatif du cancer du poumon non à petites cellules (CPNPC) métastatique. À l’avenir, elle aura également sa place dans la situation curative, comme le montrent de premières données sur l’utilisation adjuvante et néoadjuvante.
Keypoints
-
L’immunothérapie néoadjuvante permet un taux élevé de régression tumorale pathologique dans les études de phase II. Le taux de réponse pathologique majeure de l’immunothérapie seule se situe entre 14 et 45% selon les études.
-
Les études associant chimiothérapie néoadjuvante et immunothérapie ont tendance à afficher des taux de réponse pathologique plus élevés. Les données PFS et OS des grandes études de phase III ne sont pas encore disponibles.
Traitement adjuvant contre néoadjuvant au stade précoce
Le pronostic des patients atteints de CPNPC résécable à un stade précoce est limité, en dépit de la chirurgie et de la chimiothérapie. Le taux de survie à 5 ans varie entre 80% au stadeI et 40% au stadeIII. Une chimiothérapie (néo)adjuvante permet d’obtenir un bénéfice supplémentaire d’environ 5%, la chimiothérapie adjuvante et la chimiothérapie néoadjuvante étant équivalentes. Les avantages d’un traitement néoadjuvant résident dans l’éradication la plus précoce possible des micrométastases et une meilleure observance thérapeutique des patients. En ce qui concerne une immunothérapie néoadjuvante, l’avantage réside dans une tumeur in situ qui fait office de réservoir d’antigènes et déclenche la réponse du système immunitaire. Les lymphocytes T activées par le traitement par inhibiteur de point de contrôle n’agissent donc pas seulement dans la tumeur primaire, mais peuvent éradiquer précocement les micrométastases périphériques. Un autre avantage du traitement néoadjuvant réside dans la possibilité d’évaluer la réponse pathologique et donc d’estimer le résultat.
En revanche, une approche de traitement adjuvante aboutit rapidement à une opération sans le risque que celle-ci soit retardée par des complications préopératoires. Il est possible d’accorder aux patients le temps de récupération nécessaire au niveau postopératoire et une immunothérapie adjuvante pourrait être administrée plus longtemps qu’une immunothérapie néoadjuvante.
Immunothérapie néoadjuvante
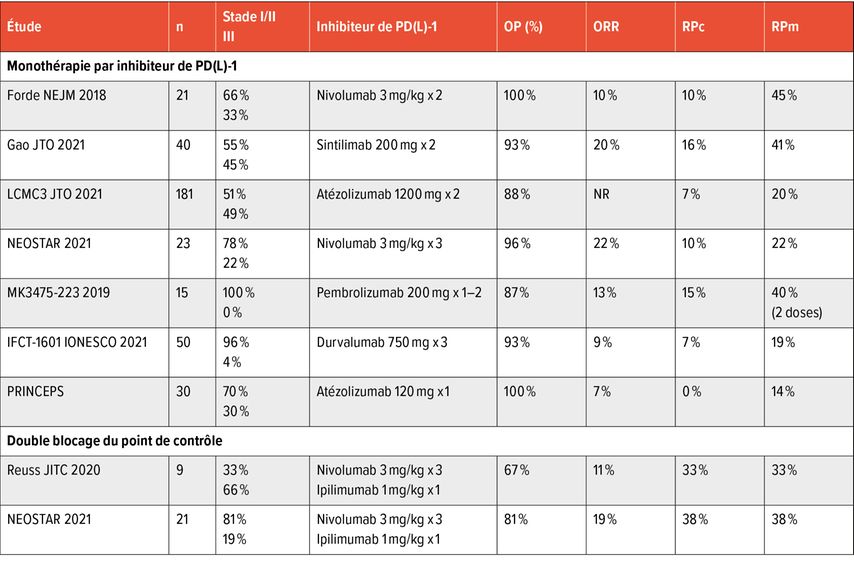
Les données actuelles sur l’immunothérapie néoadjuvante reposent majoritairement sur les résultats d’études de phase I/II,dont le Tableau 1 donne un aperçu. Les premières données sur le traitement néoadjuvant avec l’inhibiteur de la «Programmed cell death protein 1» (PD-1) nivolumab ont déjà été présentées lors de la réunion de 2016 de l’ESMO. Dans l’étude de Ford et al., 21 patients ont reçu deux cycles de nivolumab 28 ou 14 jours avant l’opération, puis un traitement «standard of care» (SoC). Une régression impressionnante de la tumeur a été observée, trois patients ayant présenté une rémission pathologique complète (RPc). La réponse pathologique majeure (RPm) a été définie comme critère de mesure de la rémission pathologique, celle-ci correspondant à ≤10% de cellules tumorales vitales dans le produit de résection. Le taux de RPm était de 45%.
Avec 181 patients, la LCMC3 est la plus vaste des études de phase II. Elle étudie l’utilisation de deux cycles d’atézolizumab en néoadjuvant suivis d’une résection avec l’option de poursuivre l’immunothérapie pendant un an au total. Le taux de RPm était de 21% parmi le groupe de patients sans mutations pilotes activatrices, 7% ont connu une RPc. L’analyse des biomarqueurs a mis en évidence une corrélation entre la RPm et une expression de PD-L1 ≥50%. En revanche, les patients présentant des mutations dans le marqueur prédictif négatif connu, la sérine/thréonine kinase 11 (STK11), avaient des taux de régression tumorale nettement plus faibles. Une analyse exploratoire a mis en évidence une association entre la RPm et la survie sans maladie (DFS) ou la survie globale (OS); les patients qui ont pu atteindre une RPm présentaient une DFS et une OS nettement prolongées.
L’étude de phase II IFCT-1601 IONESCO, présentée lors de la réunion 2021 de l’ESMO, a évalué l’inhibiteur de PD-L1 durvalumab dans le cadre d’un traitement néoadjuvant. 46 patients ont reçu trois cycles de durvalumab 750mg en néoadjuvant et ont ensuite été opérés. Le critère d’évaluation primaire était la résection R0, qui a pu être obtenue chez 89% des patients. En outre, les cellules tumorales vitales résiduelles (% RVT) dans le produit de résection ont été évaluées en aveugle par deux pathologistes indépendants. Les auteurs de l’étude sont parvenus à démontrer que la réponse pathologique, mesurée en termes de RVT, est un facteur pronostique indépendant de la DFS et l’OS des patients.
L’utilisation d’une double immunothérapie néoadjuvante a été étudiée dans NEOSTA. 44 patients ont reçu soit trois fois du nivolumab, soit trois fois du nivolumab et de l’ipilimumab, un inhibiteur de CTLA-4 («cytotoxic T-lymphocyte-associated protein 4»), en néoadjuvant, puis ont été opérés et ont ensuite reçu un traitement par SoC. Le taux de RPm était de 17% sous nivolumab et de 33% sous l’association, le taux de RPc étant surtout très élevé sous nivolumab et ipilimumab (29%). Une mise à jour de cette étude sur les patients en échec de traitement a été présentée lors de la réunion de l’ASCO l’année dernière. Au total, 11 patients sur 44 présentaient une progression confirmée radiologiquement ou histologiquement, et deux patients étaient décédés. Il était frappant de constater que 73% des patients ayant connu une progression présentaient des mutations sensibles aux ITK (inhibiteurs de tyrosine kinase) (5 patients: récepteur du facteur de croissance épidermique [EGFR], 1: kinase du lymphome anaplasique [ALK], 1: BRAF et 1: RET).
Immunochimiothérapie néoadjuvante
L’association d’une chimiothérapie et d’une immunothérapie est devenue – sauf chez les patients présentant une très forte expression de PD-L1 – l’approche standard dans le traitement palliatif du CPNPC. Quelques études sont également en cours dans le concept néoadjuvant, et de premières données sont déjà disponibles.
Dans l’étude de phase II NADIM, 46 patients atteints d’un CPNPC résécable de stade IIIA ont reçu trois cycles d’une association néoadjuvante de nivolumab et de chimiothérapie, puis ont été opérés. En postopératoire, il était prévu de poursuivre l’immunothérapie par nivolumab pendant un an au total. Au niveau radiologique, deux patients (4,3%) ont obtenu une RC et 32 (69,6%) une rémission partielle (RP). La réponse pathologique a été très impressionnante avec un taux de RPm de 83% et 59% des patients ont eu une RPc. Les données PFS et OS de l’étude NADIM ont été présentées lors de la World Conference on Lung Cancer (WCLC) 2021: après 42 mois, la PFS était de 69% et l’OS de 78,9%. Même si le nombre de patients est très faible, ces résultats soulignent la grande efficacité d’un traitement associé.
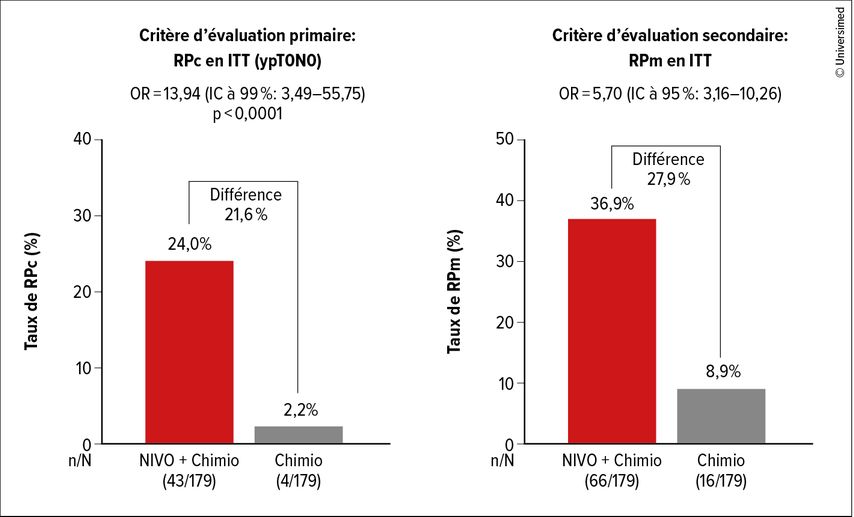
Plusieurs études de phase III évaluant une combinaison d’immunochimiothérapie néoadjuvante sont encore en cours de recrutement. Les premiers résultats sont disponibles pour CheckMate 816 et ont été présentés l’année dernière lors de la réunion de l’American Association for Cancer Research (AACR). Dans le cadre de l’étude, des patients atteints de CPNPC résécable de stade IB à IIIA sans mutations pilotes activatrices ont reçu trois cycles de chimiothérapie à base de platine en combinaison avec du nivolumab ou une chimiothérapie à base de platine seule, puis ont été opérés dans les six semaines. Une chimiothérapie ou une radiothérapie était possible en postopératoire. Le critère d’évaluation primaire RPc était positif avec un taux de RPc de 24% sous l’association contre 2,2% sous la chimiothérapie (OR: 13,94; IC à 99%: 3,49–55,75; p<0,0001), le taux de RPm était de 36,9% contre 8,9% (Fig. 1). L’avantage en termes de RPc était indépendant de l’histologie, du statut PD-L1 et de la charge mutationnelle tumorale (TMB). Cependant, la clairance de l’ADN tumoral circulant (ADNtc) a affiché une nette corrélation avec la réponse pathologique. Des dosages de l’ADNtc ont été effectués le jour 1 de chaque cycle de traitement. Une clairance de l’ADNtc a été considérée comme étant atteinte lorsque l’ADNtc initialement positif n’était plus détectable au troisième cycle. Les patients présentant une clairance de l’ADNtc ont obtenu une RPc dans 46% des cas (11/24) sous immunochimiothérapie, mais aucun patient (0/19) sans clairance de l’ADNtc n’a obtenu de RPc.
Fig. 1: Premiers résultats de CheckMate 816: patients atteints de CPNPC résécable de stade IB-IIIA sans mutations pilotes activatrices, traités par trois cycles de chimiothérapie à base de platine en association avec le nivolumab contre chimiothérapie à base de platine seule
Bilan
En résumé, les données actuelles de l’immunothérapie néoadjuvante sont très prometteuses, les résultats de grandes études de phase III – surtout en ce qui concerne la PFS et l’OS – sont encore attendus. On peut toutefois supposer qu’à l’avenir, l’immuno(chimio)thérapie jouera un rôle essentiel dans l’algorithme de traitement du CPNPC au stade précoce.
Littérature:
auprès de l’auteure
Das könnte Sie auch interessieren:
Redéfinition de la résécabilité à l’ère de l’immunothérapie
L’introduction de l’immunothérapie néoadjuvante a ouvert de nouveaux horizons quant aux limites de la résection chirurgicale des tumeurs du cancer du poumon. Toutefois, des problèmes ...
La perte de poids reste toujours le meilleur traitement en cas de MASLD
La directive commune pour la prise en charge de la maladie stéatosique du foie associée à une dysfonction métabolique (MASLD) de l’European Association for the Study of the Liver (EASL ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...