Les kystes du pancréas, un défi pour le diagnostic différentiel
Auteurs:
Dr méd. Christoph Kümmerli
PD Dr méd. Philip C. Müller
Pr Dr méd. Adrian T. Billeter, PhD
Pr Dr méd. Beat P. Müller
Viszeralchirugie
Clarunis – Universitäres Bauchzentrum Basel
Correspondance:
Pr Dr méd. Beat P. Müller
E-mail: beat.mueller@clarunis.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le terme de tumeurs kystiques du pancréas regroupe un ensemble hétérogène d’altérations du pancréas. Elles sont chacune associées à des comportements biologiques variables avec un risque différent de transformation maligne. La distinction du type de kyste ainsi que le risque de transformation correspondant sont des défis et nécessitent des analyses approfondies. Pour ce faire, outre les données cliniques, on dispose de procédés d’imagerie et du diagnostic endoscopique pour le prélèvement de tissus. Dans le cas des kystes pancréatiques présentant des indices de transformation, seule la résection chirurgicale permet de traiter de manière curative un kyste précancéreux. De nouvelles techniques chirurgicales, assistées par robot et préservant simultanément les organes, sont notamment envisagées.
Keypoints
-
Le diagnostic et l’évaluation du risque de transformation maligne sont difficiles dans le cas des tumeurs kystiques du pancréas et nécessitent un traitement central.
-
L’anamnèse, les marqueurs tumoraux, l’imagerie et la ponction à l’aiguille fine constituent la base du diagnostic. Un suivi étroit (3–12 mois) est pertinent pour évaluer l’évolution.
-
En cas de diagnostic précoce et d’ablation chirurgicale, les lésions précancéreuses peuvent être traitées de manière curative avec d’excellents résultats à long terme.
-
Les procédures assistées par robot permettent une ablation des kystes ménageant le patient et préservant les organes.
Les tumeurs kystiques du pancréas (TKP) forment un groupe hétérogène d’altérations qui sont de plus en plus souvent diagnostiquées grâce à l’imagerie à haute résolution. L’imagerie moderne en coupe permet de détecter de telles altérations du pancréas dans 8% des examens environ, souvent de façon fortuite.1 Cela s’explique par le fait que les examens d’imagerie sont plus fréquents et que la résolution des appareils modernes est plus élevée. Les quatre entités les plus fréquentes sont les tumeurs intracanalaires papillaires et mucineuses du pancréas (TIPMP) avec atteinte du canal principal ou des canaux secondaires, les tumeurs kystiques mucineuses (TKM), les tumeurs kystiques séreuses (TKS) et les tumeurs pseudopapillaires et solides (TPPS). La distinction entre les différentes altérations kystiques est un défi, mais elle est très importante du point de vue pronostique, car les TIPMP et les TKM peuvent être des lésions précancéreuses du cancer du pancréas, contrairement aux autres lésions kystiques du pancréas. Pour compliquer les choses, la prédiction du potentiel de transformation maligne de telles tumeurs est actuellement encore relativement imprécise.
Si une TKP se transforme en carcinome invasif, son pronostic est équivalent à celui du carcinome pancréatique. Si une résection est encore possible, le taux de survie à 5 ans est inférieur à 40%.2
Diagnostic grâce à une collaboration multidisciplinaire
Outre l’âge, le sexe et le site du kyste, c’est surtout l’anamnèse spécifique au pancréas qui fournit les premières indications pour le diagnostic (Tab. 1). Dans ce cas, il est important de demander si des antécédents familiaux de cancer du pancréas sont connus et si des pancréatites, des insuffisances endocrines et exocrines et des ictères sont survenus dans le passé. Pour les TIPMP, le marqueur tumoral CA19-9 doit être contrôlé de manière systématique, la sensibilité étant faible et la spécificité, élevée (52% vs 88%).3
Tab. 1: Vue d’ensemble des tumeurs kystiques du pancréas les plus fréquentes avec leurs caractéristiques typiques
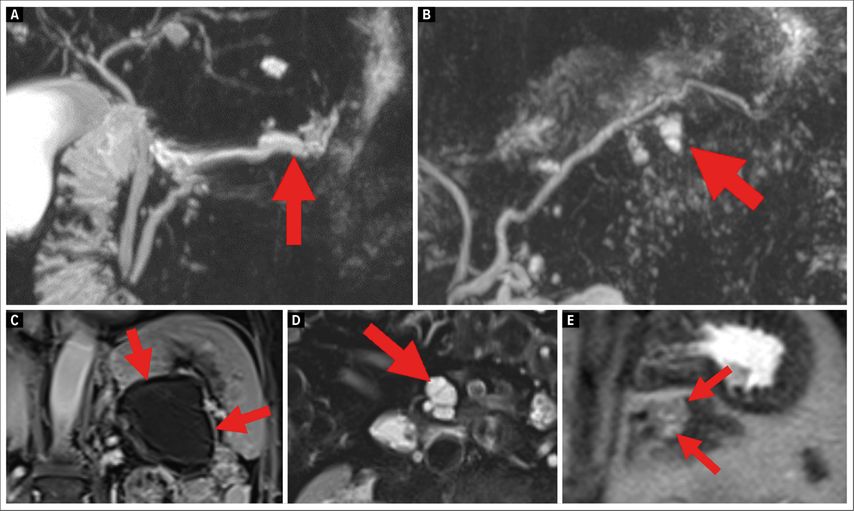
L’imagerie est généralement disponible en tant que premier diagnostic, car la TKP est souvent découverte de manière fortuite (Fig. 1). Bien que l’imagerie constitue le principal moyen de diagnostic, elle ne permet qu’une répartition approximative des différents types de kystes. L’imagerie par résonance magnétique est supérieure à la tomodensitométrie pour la prédiction de la malignité dans les tumeurs kystiques, avec une précision de 51% vs 44%.4
Fig. 1: Résultats de l’examen d’IRM des tumeurs kystiques du pancréas les plus fréquentes. A) tumeur intracanalaire papillomuqueuse du pancréas (TIPMP) du canal principal; B) TIPMP des canaux secondaires; C) tumeur kystique mucineuse (TKM); D) tumeur kystique séreuse (TKS); E) tumeur pseudopapillaire et solide (TPPS)
L’endosonographie constitue un autre pilier de l’imagerie diagnostique, mais elle n’est utilisée que lorsque l’imagerie précédente n’est pas concluante et qu’un prélèvement de tissu est nécessaire. De plus, il est possible de réaliser une ponction à l’aiguille fine (FNP) ou un examen du liquide du kyste. Le prélèvement de tissu permet de faire la distinction entre les tumeurs mucineuses (TIPMP et TKM) et les tumeurs non mucineuses. De plus, des cellules dysplasiques ou malignes ainsi que l’amylase pancréatique ou des marqueurs tumoraux (CEA: antigène carcinoembryonnaire) peuvent éventuellement être détectés dans le liquide du kyste. Des analyses génétiques plus poussées, comme les mutations KRAS et GNAS du liquide kystique, peuvent être indicatives d’une transformation maligne dans le cas de TIPMP. C’est dans ce domaine que les plus grands progrès diagnostiques sont attendus à l’avenir. Ainsi, de nouveaux biomarqueurs pourraient aider de manière très fiable à améliorer la différenciation des différents degrés de dysplasie dans les TIPMP. Dans une étude récente menée à Heidelberg, l’analyse des protéines et des microARN a permis d’atteindre une précision de la différenciation des TIPMP allant jusqu’à 95%.5
Traitement – de la chirurgie mini-invasive à la surveillance individuelle
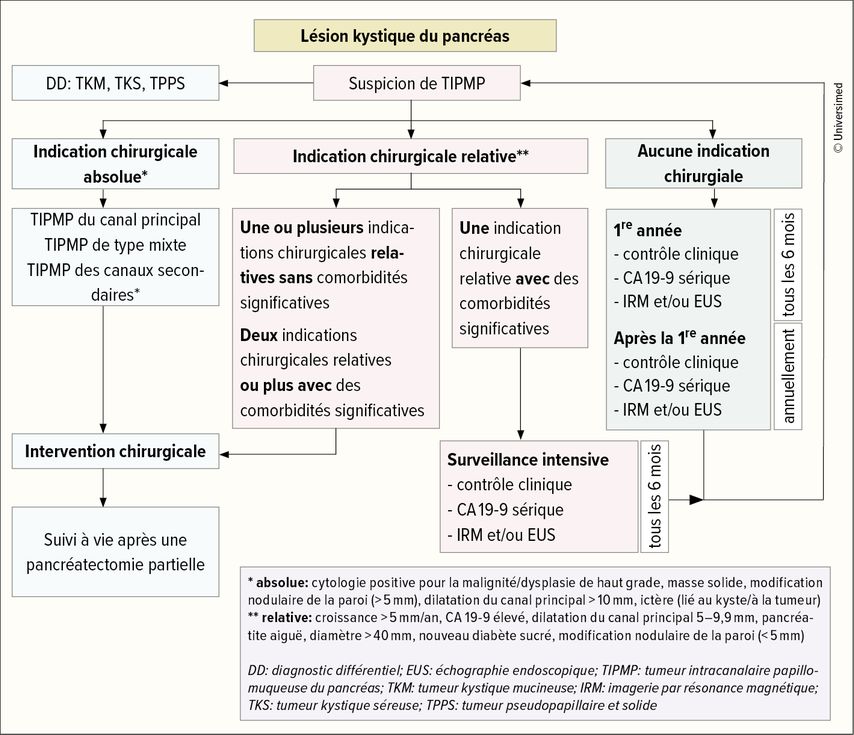
La prise en charge subséquente dépend de l’évaluation du risque de transformation maligne. L’European Study Group on Cystic Tumours of the Pancreas a publié en 2018 des recommandations à ce sujet (Fig. 2).6,7
Fig. 2: Vue d’ensemble de la prise en charge des tumeurs kystiques du pancréas (adapté de The European Study Group on Cystic Tumours of the Pancreas 2016)6
Tumeurs intracanalaires papillaires et mucineuses du pancréas (TIPMP)
Dans le cas des TIPMP, on distingue les lésions kystiques avec atteinte du canal principal ou des canaux secondaires, ou la combinaison des deux («mixed type»). Les TIPMP des canaux secondaires ont une présentation hétérogène. Le taux de transformations malignes dépend de différentes caractéristiques. Les facteurs de risque potentiels doivent être soigneusement évalués, car même les petites TIPMP peuvent contenir ou développer des dysplasies de haut grade ou un cancer. Les critères absolus («high-risk stigmata») pour la résection d’une TIPMP sont l’ictère, la cytologie positive pour la dysplasie de haut grade ou la présence de cellules malignes, la dilatation du canal principal ≥10mm, les nodules de la paroi ≥5mm ou la présence d’une masse solide dans le pancréas. Les critères relatifs («worrisome features») pour la résection des TIPMP sont un diamètre de kyste ≥30mm, un taux de croissance ≥5mm/an, des symptômes cliniques comme une pancréatite aiguë ou un diabète sucré récent, un taux de CA19-9 élevé, une dilatation du canal principal ≥5mm ou des modifications nodulaires de la paroi du kyste <5mm.6 Les patients présentant une TIPMP sans indication chirurgicale doivent être suivis par IRM et contrôle des marqueurs tumoraux tous les 1 à 6 mois au cours de la première année et tous les ans par la suite si le suivi est normal. Pour les patients ayant une indication chirurgicale relative, un suivi à 6 mois est recommandé. Il est important de procéder à une réévaluation immédiate en cas de modification des symptômes cliniques ou d’apparition de tels symptômes, ainsi qu’en cas d’augmentation du CA19-9. Dans l’ensemble, le suivi par imagerie n’a toutefois de sens que si un traitement chirurgical est envisageable. Chez les patients en mauvais état général, pour lesquels une résection du pancréas n’est pas envisageable, aucun suivi n’est indiqué.
Une TIPMP du canal principal présente un risque élevé de malignité (carcinomes et dysplasie de haut grade jusqu’à 70%) et doit être réséquée si le patient est apte à subir une intervention chirurgicale. Les TIPMP de type «mixte», avec des parties de TIPMP du canal principale et des canaux secondaires, sont associées à un risque de malignité aussi élevé que les TIPMP du canal principal, et la résection est donc également recommandée (Fig.2).
Des études récentes montrent que l’observation de certains TIPMP peut également être stoppée. En l’absence d’indication chirurgicale absolue et relative et si la taille du kyste est stable à <15mm chez les patients de plus de 65 ans ou si la taille du kyste est stable à <20mm chez les patients de plus de 75 ans, la surveillance peut être interrompue à condition qu’aucune modification morphologique du kyste n’ait eu lieu pendant 5 ans. Le risque de transformation maligne est alors conforme à celui de la population normale.8,9
Tumeurs kystiques mucineuses (TKM)
Le risque de transformation maligne des TKM dépend de la taille de la lésion, un diamètre <4cm étant rarement associé à une transformation maligne, tandis que jusqu’à 34% des lésions de plus grande taille deviennent des carcinomes. Une résection est donc indiquée lorsque la lésion kystique est ≥40mm, que le patient est symptomatique ou qu’il existe des facteurs de risque comme des nodules sur la paroi. En l’absence des facteurs de risque susmentionnés, l’imagerie de suivi peut être envisagée tous les 6 mois la première année, puis tous les ans. Il convient de noter que le taux de croissance de la TKM devrait être pris en compte dans le processus de décision.
Tumeurs kystiques séreuses (TKS)
Les TKS constituent une entité bénigne, la mortalité spécifique à la maladie est quasiment nulle. Les patients asymptomatiques doivent être suivis pendant un an, après quoi un suivi basé sur les symptômes est recommandé. Malgré la lenteur de la croissance, il apparait dans de rares cas des symptômes dus à la compression d’organes voisins. Dans ce cas, une résection pour décompression peut être effectuée.
Tumeurs pseudopapillaires et solides (TPPS)
Les TPPS, l’entité la plus rare, concernent surtout les jeunes femmes et doivent être réséqués, car elles représentent une entité de faible malignité. En cas de résection, il faut toutefois obtenir une résection R0, car les quelques cas métastatiques connus sont tous associés à une résection R1.10
Intervention chirurgicale
Fig. 3: Avec un diagnostic précoce, les lésions précancéreuses peuvent être traitées de manière curative par une ablation chirurgicale, avec d’excellents résultats à long terme
En ce qui concerne la technique chirurgicale, la résection mini-invasive assistée par robot ainsi que l’énucléation, en tant qu’alternative de préservation des organes, représentent aujourd’hui les options thérapeutiques de prédilection en l’absence de carcinome. L’accès mini-invasif de la chirurgie robotique permet de réduire considérablement le traumatisme d’accès et donc les douleurs, les infections de plaies et les adhérences dans l’abdomen, ce qui se traduit par une durée d’hospitalisation plus courte pour le patient.11,12 Grâce aux degrés de liberté supplémentaires qu’offrent les instruments robotiques, qui permettent un travail plus précis, et à la haute résolution avec une vue tridimensionnelle, il est possible de réaliser de nouvelles opérations du pancréas ménageant le patient. Dans certains cas, le kyste peut être retiré de manière ciblée lors de l’énucléation, ce qui permet de conserver le pancréas dans son intégralité. Si l’énucléation n’est pas possible, on a recours à des résections formelles comme la résection de la queue du pancréas ou la pancréatoduodénectomie. Ces résections plus radicales sont notamment indiquées en cas de suspicion de malignité pour une lymphadénectomie adéquate.
Le suivi postopératoire est tout aussi important que l’intervention chirurgicale, tant que le patient est suffisamment en forme et prêt à subir une nouvelle intervention si elle est indiquée. En effet, une néoplasie kystique est l’expression d’une transformation carcinogène du pancréas.13 Il existe donc toujours un risque plus élevé (environ 10 à 20%) d’apparition d’une autre tumeur maligne si une pancréatectomie totale n’a pas été effectuée.
Littérature:
1 Zerboni G et al.: Systematic review and meta-analysis: Prevalence of incidentally detected pancreatic cystic lesions in asymptomatic individuals. Pancreatology 2019; 19: 2-9 2 Kaiser J et al.: IPMN-associated pancreatic cancer: Survival, prognostic staging and impact of adjuvant chemotherapy. Eur J Surg Oncol 2022; 48: 1309-20 3 Lee SW et al.: Comparison of preoperative imaging modalities for the assessment of malignant potential of pancreatic cystic lesions: A network meta-analysis. Clin Nucl Med 2022; 47: 849-55 4 Wang W et al.: Serum carcinoembryonic antigen and carbohydrate antigen 19-9 for prediction of malignancy and invasiveness in intraductal papillary mucinous neoplasms of the pancreas: A meta-analysis. Biomedical Reports 2014; 3: 43-50 5 Zhang C et al.: Blood-based diagnosis and risk stratification of patients with pancreatic intraductal papillary mucinous neoplasm (IPMN). Clin Cancer Res 2023; 29: 1535-45 6 The European Study Group on Cystic Tumours of the Pancreas: European evidence-based guidelines on pancreatic cystic neoplasms. Gut 2018; 67: 789-804 7 Ohtsuka T et al.: International evidence-based Kyoto guidelines for the management of intraductal papillary mucinous neoplasm of the pancreas. Pancreatology 2024; 24: 255-70 8 Marchegiani G et al.: Surveillance for presumed BD-IPMN of the pancreas: stability, size, and age identify targets for discontinuation. Gastroenterol 2023; 165: 1016-24 9 Han Y et al.: Optimal surveillance interval of branch duct intraductal papillary mucinous neoplasm of the pancreas. JAMA Surg 2024; doi: 10.1001/jamasurg.2023.7010 10 Tjaden C et al.: Outcome and prognosis after pancreatectomy in patients with solid pseudopapillary neoplasms. Pancreatol 2019; 19: 699-709 11 Roesel R et al.: Minimally-invasive versus open pancreatic enucleation: systematic review and metanalysis of short-term outcomes. HPB 2023; 25: 603-13 12 Müller PC et al.: Robotic distal pancreatectomy: A novel standard of care? Benchmark values for surgical outcomes from 16 International Expert Centers. Ann Surg 2023; 278: 253-9 13 Marchegiani G et al.: IPMN involving the main pancreatic duct: biology, epidemiology, and long-term outcomes following resection. Ann Surg 2015; 261: 976-83
Das könnte Sie auch interessieren:
Revue de presse: L’importance d’objectifs thérapeutiques centrés sur les patient·es dans la SLA
Dans une revue récente, Chio et al., mettent en lumière la nécessité de repenser les critères d’évaluation dans les essais cliniques portant sur la sclérose latérale amyotrophique (SLA ...
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...