Nouveaux traitements des formes sévères d’asthme et de BPCO
Compte-rendu:
Regina Scharf, MPH
Rédactrice
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Dans le traitement de l’asthme, les premiers anticorps monoclonaux devraient bientôt intervenir si haut dans la cascade inflammatoire qu’ils devraient également être efficaces dans l’asthme sévère non-Th2. Vous en apprendrez davantage ici sur ce sujet et d’autres encore, comme le traitement par corticostéroïdes lors d’une exacerbation de la BPCO, la place de la thermoplastie bronchique dans le traitement de l’asthme et les médicaments biologiques dans la rhinosinusite chronique avec polypes nasaux.
La palette des anticorps monoclonaux («monoclonal antibodies», mAb) dans le traitement de l’asthme sévère continue de s’élargir. «Cela nécessite une compréhension approfondie des voies inflammatoires et du rôle des cytokines qui mènent à l’asthme sévère», a déclaré le Prof. Dr méd. Arnaud Bourdin, du Centre hospitalier universitaire de Montpellier, en France, lors du congrès annuel de la Société Suisse de Pneumologie à Lucerne.
Depuis quelque temps, la recherche sur l’asthme se penche sur les alarmines TSLP («thymic stromal lymphopoietin»), l’interleukine(IL)-25 et l’IL-33. Les cytokines sont libérées par l’épithélium des voies respiratoires en réponse à des stimuli environnementaux comme des allergènes, des polluants, des virus, des bactéries, etc. et provoquent une série de processus inflammatoires en aval. Les cytokines épithéliales semblent jouer un rôle important dans la physiopathologie de l’asthme.
Des données récentes montrent qu’elles participent non seulement à l’apparition de l’inflammation des voies respiratoires Th2, mais aussi non-Th2.1 L’étude de phase II PATHWAY a montré que le taux d’exacerbations chez les patients atteints d’asthme non contrôlé pouvait être réduit d’environ 50 à 80%, indépendamment du taux sanguin d’éosinophiles, de la fraction expirée du monoxyde d’azote (FeNO) et du profil inflammatoire Th2, grâce au traitement par tézépélumab, un inhibiteur de la TSLP (TSLP-I).2 Dans l’étude CASCADE, une autre étude de phase II menée auprès de patients atteints d’asthme modéré à sévère non contrôlé, le traitement par TSLP-I a réduit d’environ 85% le taux d’éosinophiles dans l’épithélium sous-muqueux des voies respiratoires.3 Ce résultat laisse envisager que l’issue clinique obtenue avec le tézépélumab est attribuable, au moins partiellement, à une réduction de l’inflammation éosinophilique des voies respiratoires. D’autres cellules inflammatoires, comme les lymphocytes neutrophiles, les lymphocytes T ou les mastocytes, n’ont pas été affectées par le traitement. Selon le conférencier, la diminution de l’hyperréactivité bronchique au mannitol, également démontrée dans cette étude, pourrait indiquer un mécanisme d’action non-inflammatoire. Dans la vaste étude de phase III NAVIGATOR menée auprès d’adolescents et d’adultes atteints d’asthme sévère non contrôlé, le traitement par TSLP-I a permis de réduire le taux annuel d’exacerbations de 56% en moyenne.4 Comme l’a montré la stratification par sous-groupes, les patients présentant un taux d’éosinophiles ≥300/µl dans le sang et une FeNO ≥25ppb ont le plus bénéficié du traitement, avec une diminution de 77% du taux annuel d’exacerbations. La diminution la plus faible du taux d’exacerbations (29%) a été observée chez les patients présentant un taux d’éosinophiles <300/µl et une FeNO <25ppb. On ignore encore si, et auprès de quels groupes de patients, un traitement préexistant par corticostéroïdes oraux (CSO) peut être réduit par le traitement par TSLP-I. Il n’y a pas encore de consensus sur ce point.
Le masitinib, un inhibiteur de la tyrosine kinase, pourrait être un autre nouveau principe actif dans le traitement de l’asthme. Il influence la fonction de différentes cellules immunitaires, dont les mastocytes, qui participent à l’apparition de l’asthme. La «small molecule» a entraîné une diminution de 35 à 38% du taux d’exacerbations, indépendamment du type d’inflammation, dans une étude menée auprès de patients n’ayant pas obtenu un contrôle suffisant de leur asthme malgré un traitement optimal par des corticostéroïdes inhalés (CSI) à forte dose, des agonistes bêta-2 à longue durée d’action (LABA) et des CSO.5 Une étude de phase II évaluant l’itépékimab, un mAb dirigé contre l’IL-33, chez des patients atteints d’asthme modéré à sévère, a également donné des résultats prometteurs.6 Le critère d’évaluation primaire de l’étude était la perte de contrôle de l’asthme après la randomisation en vue de recevoir l’itépékimab ou le dupilumab (mAb dirigé contre l’IL-4/IL-13) en monothérapie, un traitement associant l’itépékimab et le dupilumab ou un placebo, suivi d’un arrêt progressif du traitement de fond par CSI/LABA. Les résultats ont montré une perte de contrôle de l’asthme chez respectivement 19% et 22% des patients traités par itépékimab ou par dupilumab et chez respectivement 27% et 41% des patients recevant le traitement d’association ou le placebo. Bien que les deux monothérapies (itépékimab et dupilumab) aient eu un effet comparable sur le critère d’évaluation primaire, la mAb dirigé contre l’IL-33 a entraîné une suppression plus large des biomarqueurs Th2.
Stéroïdes systémiques dans la BPCO exacerbée: quelle dose et combien de temps?
Les corticostéroïdes systémiques sont utilisés pour traiter les exacerbations sévères et prévenir les exacerbations récurrentes dans la BPCO. Toutefois, la durée pendant laquelle les médicaments doivent être administrés n’est pas claire, compte tenu des nombreux effets secondaires systémiques. Pas trop longtemps, conclut le Prof. Dr méd. Jörg Leuppi, de la clinique universitaire de Bâle-Campagne. «Une dose d’environ 40mg/j pendant une durée maximale de 5 jours pendant l’exacerbation de la BPCO est appropriée», a déclaré le spécialiste. Le contexte du traitement de courte durée a été fourni par différentes études. Notamment, l’étude COPDGene a montré que les patients traités de façon chronique par CSO avaient une fonction pulmonaire inférieure, souffraient plus souvent d’exacerbations et parcouraient une distance de marche plus courte que celle des patients de l’étude ne recevant pas de CSO.7 Dans une autre étude, le risque de mortalité chez les patients atteints de BPCO sévère augmentait avec le niveau de dose de CSO et la durée du traitement.8
D’autre part, de nombreuses études démontrent les avantages d’un traitement par corticostéroïdes systémiques en cas d’exacerbation de la BPCO, notamment une amélioration plus rapide de la fonction pulmonaire et une durée d’hospitalisation inférieure.9 Une étude menée aux Pays-Bas conclut que l’effet positif d’un traitement par corticostéroïdes systémique sur la fonction pulmonaire est le plus important dans les trois premiers jours suivant le début du traitement. Par la suite, il n’y a plus réellement de différence entre le traitement comparé et le placebo.9 Une étude menée à Bâle a comparé un traitement par corticostéroïdes systémiques d’une durée de 5 jours ou de 14 jours et n’a pas montré de différence dans le risque de nouvelle exacerbation.10 Une revue Cochrane arrive à une conclusion similaire.11 Une récente étude de registre danoise montre en outre que la combinaison d’une dose plus élevée de CSO et d’une durée de traitement plus longue est associée à une augmentation des hospitalisations pour pneumonie et à une mortalité plus élevée qu’une faible dose de CSO administrée sur une période plus courte.12
Deux études évaluant si l’indication d’un traitement par corticostéroïdes systémiques devait dépendre du taux d’éosinophiles n’ont fourni que des informations limitées.13,14 «Selon moi, toutes les personnes souffrant d’une exacerbation de la BPCO devraient recevoir des corticostéroïdes systémiques pendant une courte période», a déclaré J. Leuppi.
Place de la thermoplastie bronchique à l’ère des médicaments biologiques
Plus de 200 travaux scientifiques sur la thermoplastie bronchique (TB) ont été rédigés depuis 2004. Depuis 2014, l’intervention est recommandée par la Global Initiative for Asthma (GINA) avec un niveau de preuve B comme traitement complémentaire au niveau 5 du traitement de l’asthme.15 Comme le montrent les résultats à 5 ans d’une étude d’observation multicentrique prospective publiés tout récemment dans «Chest», la TB permet de réduire le risque d’exacerbation à 42,7%, la fréquence des admissions aux urgences et des hospitalisations respectivement à 7,9% et 4,8% et le traitement à long terme par CSO à 9,7%, vs 77,8%, 29,4%, 16,1% et 19,4% au cours des 12 mois précédant l’intervention.16
Les patients qui ne répondent pas aux critères de traitement par mAb font partie des candidats classiques à une TB. «Il s’agit principalement de patients atteints d’asthme de type «Th2-low», pour lesquels aucun traitement biologique n’est actuellement autorisé», a déclaré la Prof. Dre méd. Daiana Stolz, de l’Hôpital universitaire de Fribourg-en-Brisgau. Environ 40% des patients asthmatiques présentent un tel type d’inflammation. D’autres candidats potentiels à l’ère des médicaments biologiques sont les patients asthmatiques qui refusent un traitement par des médicaments biologiques ou qui ne répondent pas suffisamment aux traitements par mAb disponibles.
Une étude récente portant sur l’effet de la TB sur les changements histopathologiques dans différents endo- et phénotypes d’asthme a montré qu’il existe un chevauchement des différents endo- et phénotypes chez de nombreux patients.17 «Il est donc difficile de prédire quel phénotype bénéficiera ou non de l’intervention», a déclaré la spécialiste. Alors que la TB a permis d’améliorer le contrôle de l’asthme chez tous les participants à l’étude, indépendamment de son phénotype, une réduction plus nette de la musculature lisse a été observée chez les patients présentant une inflammation «Th2-high». Chez les patients présentant une inflammation «Th2-low» sans antécédents d’allergie ou d’exposition au tabac, l’intervention a entraîné une prolifération plus nette des cellules épithéliales. Une découverte intéressante de l’étude a été l’augmentation de l’expression des récepteurs des glucocorticoïdes sur les cellules épithéliales après l’intervention. Cela suggère une sensibilité accrue aux corticostéroïdes.
Une étude de conception semblable, dont l’objectif était de tirer des conclusions sur les prédicteurs de la réussite du traitement à partir de la réponse au traitement, montre qu’un plus grand nombre de personnes jeunes présentant une atopie, des taux d’IgE élevés et un taux accru d’éosinophiles dans le sang répondent à la TB.18 «Une inflammation ‹Th2-high› est pour moi l’indication de première ligne pour le traitement biologique», a déclaré D. Stolz. «Tous les patients qui ne répondent pas au traitement, chez qui l’effet s’estompe ou qui ne remplissent pas les critères pour un traitement biologique sont des candidats potentiels à la TB.» Selon l’experte, l’élément déterminant pour la réussite du traitement est la sélection minutieuse des patients, qui s’avère toutefois difficile en raison de l’absence de prédicteurs spécifiques. La TB a récemment été freinée par son déclassement dans le 2022 National Asthma Education and Prevention Program (NAEPP) du National Heart, Lung, and Blood Institute des États-Unis. Celui-ci s’est en effet prononcé contre cette intervention en raison du peu de preuves disponibles. «Cela devrait encore compliquer à l’avenir la mise en œuvre de la procédure, dont la prise en charge financière n’est de toute façon pas garantie», a déclaré D. Stolz.
Rhinosinusite chronique avec polypes nasaux: mAb, intervention chirurgicale ou les deux?
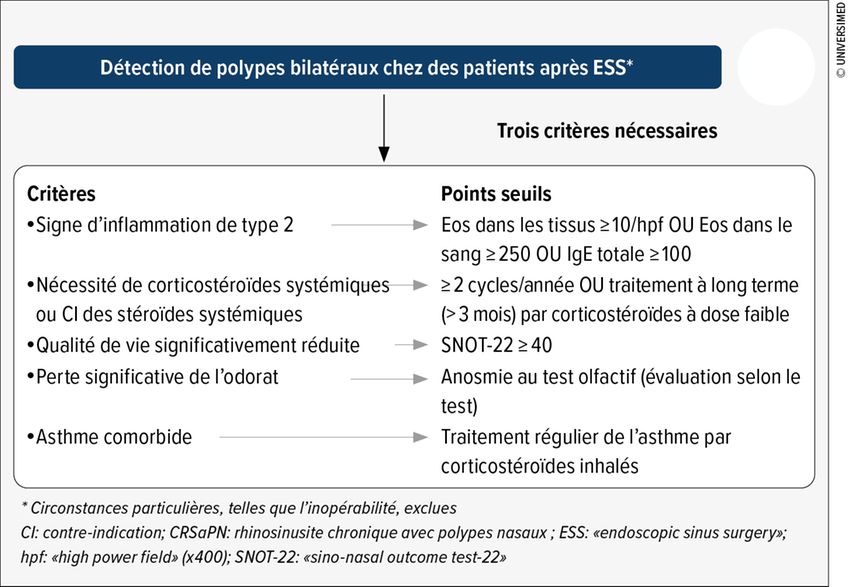
Le diagnostic de rhinosinusite chronique (RSC) avec polypes nasaux (RSCaPN) repose sur la présence d’au moins deux symptômes. L’un d’entre eux doit être une obstruction nasale ou une rhinorrhée, avec ou sans douleur ou pression faciale, avec ou sans réduction ou perte de l’odorat. En outre, la détection endoscopique de polypes ou de sécrétions mucopurulentes et/ou de modifications pathologiques au scanner est nécessaire. Les symptômes doivent être présents depuis au moins trois mois.19 Si le diagnostic de RSC est confirmé, on réalise alors une classification. Dans la plupart des cas, il s’agit d’une RSC primaire. Celle-ci peut être localisée (unilatérale) ou diffuse (bilatérale) et est associée ou non aux Th2.
La RSCaPN est l’un des quatre phénotypes de la RSC primaire diffuse associée au type 2. L’objectif du traitement de la RSC est d’obtenir le meilleur contrôle possible de la maladie sans altérer la qualité de vie. Le traitement de la RSC diffuse repose principalement sur les corticostéroïdes locaux et les lavages au sérum physiologique. La réussite du traitement dépend en grande partie de l’application correcte des médicaments. L’administration de corticostéroïdes topiques sous forme de gouttes nasales s’est avérée la plus efficace dans la position dite «de Mygind», dans laquelle le patient est allongé sur le dos, la tête en hyperextension. Dans le cas de la RSCaPN avec symptômes graves persistants, la question d’une intervention chirurgicale et d’un traitement par mAb se pose. Il ne s’agit pas d’un choix entre l’un ou l’autre: «Selon les recommandations actuelles, le traitement par mAb ne commence qu’après l’ablation des polypes nasaux», a déclaré le Prof. Dr méd. Basil Landis, des Hôpitaux universitaires de Genève. L’effet thérapeutique des mAb ne doit pas être surestimé. «Nous avons l’impression que les médicaments biologiques fonctionnent moins bien chez nos patients que dans les essais contrôlés et randomisés», a-t-il déclaré. Ici aussi, il est important de sélectionner soigneusement les patients (Fig. 1). Jusqu’à présent, il n’existe que peu de données en situation réelle sur l’utilisation des traitement par mAb dans la RSCaPN.20 De plus, la décision de prescrire un unique médicament biologique ne suffit généralement pas. Il faut souvent essayer plusieurs préparations avant d’obtenir un résultat. Le spécialiste est néanmoins convaincu que l’association d’une intervention chirurgicale et de mAb était la solution la plus prometteuse dans les cas graves. Le European Position Paper on Rhinosinusitis and Nasal Polyps (EPOS) 2020, librement accessible sur le site Web de la revue «Rhinology» fournit un bon résumé des recommandations actuelles.19
Source:
Congrès annuel de la Société Suisse de Pneumologie (SSP), 30 mars au 1er avril 2022, Lucerne
Littérature:
1 Menzies-Gow A et al.: Unmet need in severe, uncontrolled asthma: can anti-TSLP therapy with tezepelumab provide a valuable new treatment option? Respir Res 2020; 21: 268 2 Corren J et al.: Tezepelumab in adults with uncontrolled asthma. N Engl J Med 2017; 377: 936-46 3 Menzies-Gow A et al.: Tezepelumab in adults and adolescents with severe, uncontrolled Asthma. N Engl J Med 2021; 384: 1800-09 4 Wechsler ME et al.: SOURCE: a phase 3, multicentre, randomized, double-blind, placebo-controlled, parallel group trial to evaluate the efficacy and safety of tezepelumab in reducing oral corticosteroid use in adults with oral corticosteroid dependent asthma. Respir Res 2020; 21: 264 5 Chanez P et al.: Masitinib significantly decreases the rate of asthma exacerbations in patients with severe asthma uncontrolled by oral corticosteroids: a phase 3 multicenter study. Am J Resp Crit Care Med 2020; 201: A4210 6 Wechsler ME et al.: Efficacy and safety of itepekimab in patients with moderate-to-severe asthma. N Engl J Med 2021; 385:1656-68 7 Swift I et al.: Demographic, physiologic and radiographic characteristics of COPD patients taking chronic systemic corticosteroids. COPD 2012; 9: 29-35 8 Schols AM et al.: Dose dependent increased mortality risk in COPD patients treated with oral glucocorticoids. Eur Respir J 2001; 17: 337-42 9 Niewoehner DE et al.: Effect of systemic glucocorticoids on exacerbations of chronic obstructive pulmonary disease. Department of Veterans Affairs Cooperative Study Group. N Engl J Med 1999; 340: 1941-7 10 Leuppi JD et al.: Short-term vs conventional glucocorticoid therapy in acute exacerbations of chronic obstructive pulmonary disease: the REDUCE randomized clinical trial. JAMA 2013; 309: 2223-31 11 Walters JA et al.: Different durations of corticosteroid therapy for exacerbations of chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews 2018; CD006897 12 Sivapalan P et al.: COPD exacerbations: the impact of long versus short courses of oral corticosteroids on mortality and pneumonia: nationwide data on 67 000 patients with COPD followed for 12 months. BMJ Open Respir Res 2019; 6: e000407 13 Bafadehl M et al.: Blood eosinophils to direct corticosteroid treatment of exacerbations of chronic obstructive pulmonary disease: a randomized placebo-controlled trial. Am J Respir Crit Care 2012; 186: 48-55 14 Sivapalan P et al.: Eosinophil-guided corticosteroid therapy in patients admitted to hospital with COPD exacerbation (CORTICO-COP): a multicentre, randomised, controlled, open-label, non-inferiority trial. Lancet Respir Med 2019; 7: 699-709 15 2022 GINA Report, Global Strategy for Asthma Management and Prevention. Einsehbar unter: www.ginasthma.org 16 Chupp G et al.: Bronchial Thermoplasty in patients with severe asthma at 5 years: The Post-FDA Approval Clinical Trial Evaluating Bronchial Thermoplasty in Severe Persistent Asthma Study. Chest 2022; 161: 614-28 17 Papakonstantinou E et al.: Bronchial thermoplasty in asthma: an exploratory histopathological evaluation in distinct asthma endotypes/phenotypes. Respir Res 2021; 22: 186 18 Ladjemi MZ et al.: Clinical and histopathologic predictors of therapeutic response to bronchial thermoplasty in severe refractory asthma. J Allergy Clin Immunol 2021; 148: 1227-35 19 European position paper on rhinosinusitis and nasal polyps 2020. Rhinology 2020; Suppl. 29: 1-464 20 Meier EC et al. Real-Life Experience of Monoclonal Antibody Treatments in Chronic Rhinosinusitis with Nasal Polyposis. Int Arch Allergy Immunol 2021; 182: 736-43
Das könnte Sie auch interessieren:
Présentation des données pertinentes pour la pratique sur le mavacamten dans la CMHO
Le mavacamten, un inhibiteur de la myosine, a été la première substance de cette classe à être autorisée en 2023 pour le traitement de la cardiomyopathie hypertrophique obstructive (CMHO ...
La perte de poids reste toujours le meilleur traitement en cas de MASLD
La directive commune pour la prise en charge de la maladie stéatosique du foie associée à une dysfonction métabolique (MASLD) de l’European Association for the Study of the Liver (EASL ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...