La neuropathie diabétique et ses conséquences
Compte-rendu:
Claudia Benetti
Journaliste médicale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Jusqu’à 50 % des personnes atteintes de diabète présentent une neuropathie. Il s’agit donc de la complication du diabète la plus fréquente. Pour éviter d’autres problèmes comme l’ulcère du pied diabétique, le pied de Charcot ou l’amputation, la prévention joue un grand rôle. Ce sont surtout les médecins de famille qui sont sollicités, comme l’a souligné la Dre méd. Katrin E. Schimke, lors du forum FOMF Diabetes Update Refresher.
L’incidence de la neuropathie diabétique est deux fois plus élevée dans le diabète de type 2 (DT2) que dans le diabète de type 1 (DT1). «Cette différence s’explique par des différences dans la pathogenèse», a déclaré la Dre méd. Katrin E. Schimke, du Zentrumspraxis à Saint-Gall. La prévalence varie entre 10% et 50% selon la population étudiée et est à peu près la même pour les deux types de diabète.1 Elle augmente avec l’âge et la durée de la maladie.2
Physiopathologie de la neuropathie diabétique
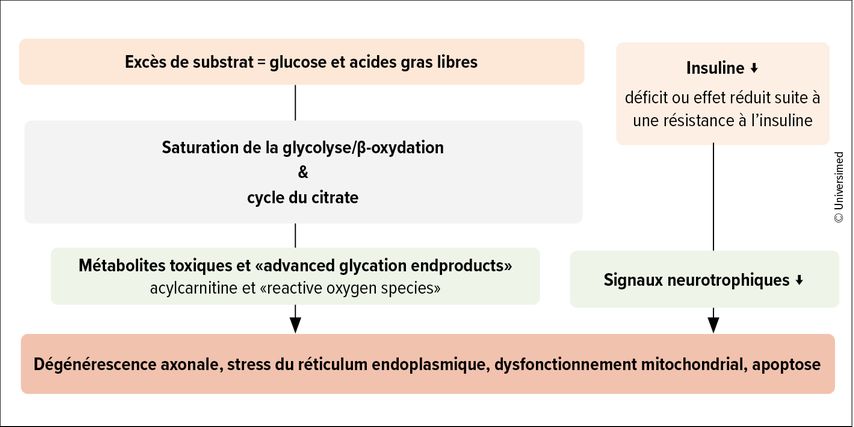
«La pathogenèse est complexe et est influencée par des facteurs métaboliques et vasculaires», a expliqué K.E. Schimke. En raison de l’hyperglycémie, il y a également un excès de glucose et d’acides gras libres dans les cellules nerveuses, ce qui entraîne une saturation des voies métaboliques comme la bêta-oxydation, la glycolyse et le cycle du citrate, ainsi qu’une augmentation de la formation de métabolites toxiques (acylcarnitine et «espèces réactives de l’oxygène» [ROS]) et de ce que l’on appelle les «advanced glycation endproducts» (AGE). «De plus, il existe un manque absolu d’insuline dans le DT1 et une insulinorésistance également au niveau des nerfs dans le DT2. Cela entraîne une diminution des signaux neurotrophiques», a-t-elle expliqué. Combiné aux modifications métaboliques, ce phénomène entraîne une dégénérescence axonale et, au niveau cellulaire, un stress, un dysfonctionnement mitochondrial et, finalement, une désintégration cellulaire (Fig. 1).3 Ce processus se déroule dans la direction distal vers proximal.
Une bonne maîtrise du diabète permet de réduire le risque relatif de neuropathie de près de 80% en cas de DT1 et de 5 à 10% en cas de DT2.4 «Le fait que l’influence soit nettement plus faible en cas de DT2 est probablement dû au fait que des facteurs de risque supplémentaires tels que l’obésité, l’hyperlipidémie, l’hypertension, le syndrome métabolique, le tabagisme, l’alcool et d’autres facteurs neurotoxiques jouent un rôle», a expliqué K.E. Schimke.
Formes et tableau clinique de la neuropathie diabétique
Dans la neuropathie diabétique, on distingue la mononeuropathie périphérique, la polyneuropathie périphérique et la neuropathie autonome. La plus fréquente est la neuropathie sensitivomotrice distale (DPN, «diabetic pheripheral neuropathy»). Elle s’accompagne d’une lésion symétrique ascendante distale du système nerveux qui se manifeste par des déficits typiques en chaussettes ou en gants.
En cas de lésion des petites fibres C non myélinisées, on observe de fortes douleurs, une hyperalgésie et une allodynie (symptômes dits positifs). La douleur est souvent décrite comme lancinante ou de type décharge électrique. Cliniquement, on observe une perte de la perception de la piqûre d’aiguille (pinprick) et de la température. Les tests de dépistage habituels avec le diapason et le monofilament donnent des résultats normaux, tout comme les examens électroneurographiques. Le plus souvent, les symptômes positifs apparaissent au début de la DPN ou au stade de transition vers la neuropathie indolore à grandes fibres avec des symptômes négatifs.
La neuropathie à grandes fibres se caractérise par des sensations d’engourdissement et éventuellement de légères dysesthésies. Cliniquement, on constate généralement une extinction du réflexe achilléen et une perte de la sensibilité à la douleur. S’y ajoutent parfois des symptômes moteurs tels que faiblesse, atrophie, troubles de la marche et de la coordination.
Il n’est pas rare de voir des formes mixtes avec une atteinte des deux types de fibres nerveuses et, par conséquent, des symptômes positifs et négatifs. Cela conduit au paradoxe du «pied douloureux insensible». «Les patients se plaignent d’un douleur au pied, mais ils ne ressentent aucune douleur en réponse à des stimuli qui provoquent normalement de la douleur», explique K.E.Schimke. «De plus, 50% des patients atteints de DPN sont asymptomatiques, ce qui fait que la DPN n’est découverte que tardivement, dans le pire des cas lorsqu’une ‹catastrophe› s’est déjà produite.»
Les conséquences cliniques de la DPN sont, outre les douleurs, un risque accru de chute, des ulcérations du pied (incidence à vie de 25%), une ostéoarthropathie neuropathique, un risque 15 fois plus élevé d’amputation ainsi que des répercussions psychosociales comme la dépression et les troubles anxieux. La qualité de vie est également durablement compromise. «Sans oublier les conséquences en termes de coûts. La DPN au stade terminal, ou le syndrome du pied diabétique, est l’une des complications du diabète les plus coûteuses qui soient», a déclaré l’intervenante.
Options thérapeutiques dans la DPN douloureuse
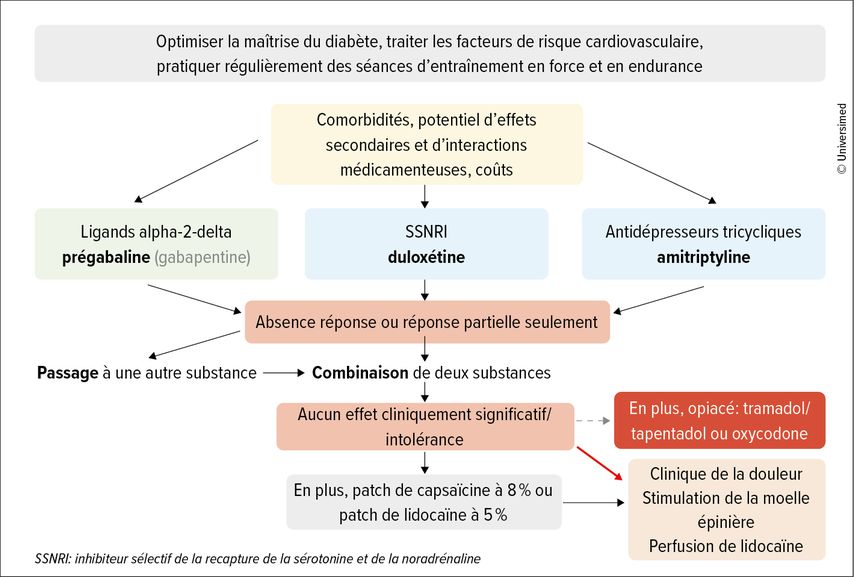
La plupart des directives recommandent l’amitriptyline, la duloxétine ou la prégabaline pour le traitement de première ligne. La gabapentine ainsi que le tramadol, le tapentadol et l’oxycodone sont également fréquemment prescrits, les opioïdes ne devant être utilisés qu’avec beaucoup de retenue en raison de leur potentiel de dépendance (Fig. 2).4–6 L’absence de douleur ne peut généralement pas être atteinte, un objectif thérapeutique réaliste étant une réduction de la douleur de 30 à 50%. «Le traitement de fond comprend toujours une optimisation de la maîtrise du diabète ainsi que le contrôle des facteurs de risque cardiovasculaires et des mesures relatives au style de vie comme des séances régulières d’entraînement en force et en endurance», a déclaré K.E. Schimke.
Fig. 2: Procédure thérapeutique pratique en cas de neuropathie diabétique distale douloureuse (adapté de Callaghan B et al. 2012; Pop-Busui R et al. 2017; Preston FG et al. 2023)4–6
La substance utilisée en premier dépend des comorbidités, du potentiel d’effets secondaires, des interactions médicamenteuses et, le cas échéant, des coûts. En cas d’absence de réponse ou de réponse insuffisante, soit on passe à une autre substance, soit on combine deux principes actifs. De plus, un patch de capsaïcine ou de lidocaïne peut également être appliqué. Si aucune de ces mesures ne permet d’atteindre l’objectif fixé, il convient de faire appel à un spécialiste.
Ulcère du pied diabétique et pied de Charcot
L’ulcère du pied diabétique et le pied de Charcot font partie des conséquences tardives du diabète les plus redoutées.
«Le mal fondamental de l’ulcère du pied diabétique est la neuropathie sensorimotrice», a expliqué la conférencière. Sur le plan physiopathologique, la composante motrice de la neuropathie entraîne une modification de la biomécanique du pied et des déformations du pied, la composante sensorielle a pour conséquence une limitation ou une perte de la perception nociceptive de la douleur et la neuropathie autonome provoque une modification trophique, la transpiration diminue, la peau des pieds est sèche et a tendance à sformer des callosités.
Le fait que des zones du pied normalement moins exposées à la pression soient davantage sollicitées lors de la marche contribue également à la formation de callosités prononcées. Les callosités créent des forces de cisaillement de plus en plus importantes entre la peau et l’hypoderme, ce qui peut entraîner la formation de cloques sous-cutanées, des saignements et finalement l’apparition d’un ulcère si les callosités ne sont pas éliminées à temps. Si à cela s’ajoute un trouble de la circulation sanguine, la cicatrisation est limitée, ce qui augmente le risque d’infection et, ainsi, le risque d’amputation.
«Une autre complication, souvent méconnue, est le pied de Charcot ou l’ostéoarthropathie diabétique. Il s’agit d’une destruction indolore et non infectieuse du squelette du pied», d’expliquer K.E. Schimke. On pense que la pathogenèse repose sur une certaine prédisposition, qui entraîne un affaiblissement local de l’os et une ostéopénie. Ceci, associé à une perception limitée de la douleur, entraîne une réaction inflammatoire déclenchée par un élément déclencheur, tel qu’un traumatisme (mineur), un ulcère ou une infection. Il se forme des microfractures, alimentant ainsi la réaction inflammatoire. En raison de la diminution de la sensation de douleur, le patient ne ressent rien et continue à solliciter le pied concerné. Tout cela déclenche un cercle vicieux qui conduit finalement à la destruction des os. «Ce processus ne peut être interrompu que par un traitement conséquent, en premier lieu par une immobilisation», a déclaré l’intervenante.
Au premier stade, le stade actif, de l’ostéoarthropathie diabétique, on ne constate cliniquement qu’une réaction inflammatoire locale avec rougeur, gonflement et échauffement, mais pas encore de déformations. La radiographie conventionnelle ne révèle généralement rien. «Dans ce cas, l’étape suivante obligatoire est une IRM», a souligné K.E. Schimke. Cette imagerie permet de visualiser les premières modifications telles que l’œdème de la moelle osseuse, les microfractures et les hématomes osseux. «Si ce stade est manqué et n’est pas traité à temps, le processus inflammatoire continue à progresser, entraînant une destruction du squelette du pied et finalement de graves déformations»
Les soins des pieds sont essentiels en cas de diabète
La prévention des ulcères du pied et le traitement des complications aiguës sont des éléments essentiels dans la prise en charge des personnes diabétiques. La prévention repose sur l’identification d’un pied à risque, l’éducation des patients, de leurs proches et des professionnels, l’identification et le traitement des lésions pré-ulcératives et la mise en place de chaussures adaptées. Les pieds des personnes atteintes de diabète devraient faire l’objet d’un examen clinique une à quatre fois par an. «Mais incitez aussi vos patients à bien regarder leurs pieds une fois par jour et à les soigner avec une préparation surgraissante. Conseillez-leur de faire attention à la chaleur et lors des bains de pieds, car il y a un risque de brûlure en raison de l’absence de sensation de température», a déclaré K.E. Schimke. Un soin professionnel des pieds et des ongles est également important. Depuis janvier 2022, les frais sont pris en charge par l’assurance de base si les soins sont prodigués par un podologue médical agréé. Le traitement des lésions pré-ulcéreuses telles que le vidage des ampoules, le traitement des ongles incarnés ou trop épais et des mycoses, ainsi que l’ablation des kératoses cutanées peuvent également être effectués au cabinet du médecin de famille.
Pour détecter un pied à risque, il est recommandé de procéder systématiquement selon la physiopathologie. Si le patient n’a pas de lésion au pied, il faut toujours rechercher des signes d’inflammation et de neuropathie. «En présence de tels signes, le diagnostic de suspicion est le pied de Charcot aigu jusqu’à preuve du contraire, ce qui constitue une urgence et doit être soulagé immédiatement», a souligné K.E. Schimke.
S’il existe une lésion du pied, la plaie doit être évaluée. Les questions suivantes sont alors abordées: comment la lésion s’est-elle formée? S’agit-il d’une forme neuropathique, d’une forme angiopathique ou d’une forme mixte? Quelle est la profondeur de la plaie? Y a-t-il des signes d’infection, éventuellement même avec une atteinte osseuse? Quelle est la qualité de la circulation sanguine? «En règle générale, plus la plaie est profonde, mal irriguée et infectée, plus le pronostic est mauvais», a déclaré l’intervenante. La classification WIfI, qui permet d’estimer le risque d’amputation à 1 an, se base précisément sur ces 3 paramètres: plaie, ischémie et infection du pied.7
Le traitement des complications aiguës comprend la garantie d’une bonne perfusion, la gestion des infections et des plaies et la mise en décharge. «Ce dernier point est malheureusement souvent négligé, alors qu’il est si important. En effet, si la plaie n’est pas soulagée, elle ne guérira pas, quel que soit le produit que vous appliquiez sur la plaie»,8 a fait remarquer K.E. Schimke. Le traitement de référence pour la mise en décharge en cas d’ulcère plantaire neuropathique est le plâtre de contact total.8,9 Les taux de guérison sont de 70 à 100% en 6 à 12 semaines, et ce, même pour des plaies présentes depuis longtemps.
Source:
FOMF Diabetes Update Refresher, du 9 au 12 novembre 2023, Zürich
Littérature:
1 Andersen ST et al.: Diabetes Care 2018; 41: 1068-75 2 Pop-Busui R et al.: Diabetes Care 2013; 36: 3208-15 3 Feldman EL et al.: Diabetic neuropathy. Nat Rev Dis Primers 2019; 5: 42 4 Callaghan B et al.: Lancet Neurol 2012; 11: 521-34 5 Pop-Busui R et al.: Diabetes Care 2017; 40: 136-54 6 Preston FG et al.: Diabetes Metab Syndr Obes 2023; 16: 1595-612 7 Mills JL Sr et al.; Society for Vascular Surgery Lower Extremity Guidelines Committee:J Vasc Surg 2014; 59: 220-34.e1-2 8 Armstrong DG et al.: Clin Infect Dis 2004; 39 (Suppl 2): S92-9 9 Petrova NL, Edmonds ME: Diabetes Metab Res Rev 2008; 24 (Suppl 1): S58-61
Das könnte Sie auch interessieren:
Revue de presse: L’importance d’objectifs thérapeutiques centrés sur les patient·es dans la SLA
Dans une revue récente, Chio et al., mettent en lumière la nécessité de repenser les critères d’évaluation dans les essais cliniques portant sur la sclérose latérale amyotrophique (SLA ...
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...