MICI et grossesse
Auteure:
PD Dre méd. Sophie Restellini
Privat docent à l’Université de Genève
Professeur titulaire à l’Université McGill, Montréal, Canada
Directrice du Centre Crohn et Colite Gastroentérologie La Tour
Hôpital de la Tour
3 avenue J.-D. Maillard
1217 Meyrin/Genève
E-mail: sophie.restellini@latour.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les maladies inflammatoires chroniques de l’intestin (MICI) sont généralement diagnostiquées chez des personnes jeunes en âge de concevoir. C’est pourquoi les problématiques liées à la fertilité, la grossesse et l’allaitement sont importantes pour ces patients.
Keypoints
-
Dans la grande majorité des cas, l’amélioration de la prise en charge des MICI permet de nos jours de mener à bien un projet parental.
-
Le contrôle de l’activité de la maladie est crucial, surtout au moment de la conception, car une maladie non contrôlée est associée à un risque plus élevé d’événements indésirables tant pour la mère que pour l’enfant.
-
Les traitements des MICI peuvent être poursuivis pendant la grossesse et l’allaitement, à l’exception du méthotrexate et du tofacitinib qui sont contre-indiqués.
-
Les corticoïdes sont le traitement de première ligne en cas de poussée pendant la grossesse.
L’incidence des MICI, qui comprennent la maladie de Crohn (MC) et la rectocolite hémorragique (RCH), a quadruplé depuis le milieu du vingtième siècle.1 À l’heure actuelle, on estime qu’environ une personne sur 200 présente une MICI en Suisse.2 Cette évolution semble être associée à l’occidentalisation des régimes et des environnements affectant le microbiote intestinal et augmentant ainsi le risque de développer une MICI chez un individu génétiquement prédisposé. Le diagnostic de ces maladies est réalisé en général chez des patients jeunes en âge de procréer; ainsi 25% d’entre eux auront leur premier enfant après leur diagnostic.3
Actuellement, l’amélioration continue de la prise en charge des MICI permet la plupart du temps de mener à bien un projet parental. Il est toutefois nécessaire de bien connaître les conseils à prodiguer aux patients avant, pendant et après la grossesse afin d’obtenir les meilleurs résultats. La prise en charge doit être multidisciplinaire et impliquer autant les spécialistes que les médecins de premiers recours. La communication entre les différents intervenants est cruciale afin d’éviter des conseils contradictoires qui peuvent représenter une source d’anxiété pour les patients.
Ces dernières années, des notions importantes sur la prise en charge des MICI pendant la grossesse ont émergé dans la littérature. Cet article a pour but de résumer les concepts clés relatifs à la prise en charge des MICI pendant la grossesse et la période post-partum.
MICI et fertilité
Les patients MICI ont en moyenne moins d’enfants que la population générale. Ceci s’explique en partie par le choix volontaire de ne pas avoir d’enfant – rapporté chez 17% des femmes MICI contre 6% dans la population générale – qui est lié à des craintes souvent injustifiées.4
Il est important de retenir que les femmes et les hommes atteints d’une MICI inactive et sans antécédent chirurgical ont des taux de fertilité similaires à ceux de la population générale.5
Une maladie active et/ou un antécédent chirurgical sont cependant associés à un risque augmenté d’infertilité à travers plusieurs mécanismes. Chez la femme, l’inflammation peut s’étendre dans le système tubulo-ovarien et engendrer également une aménorrhée secondaire ou une dysfonction sexuelle. De même, un status post chirurgical peut amener à la formation d’adhérences.6 Certains médicaments comme la sulfasalazine, qui entraine une oligospermie, ou le méthotrexate, qui est responsable d’une azoospermie, diminuent la fertilité chez l’homme.7,8 Un conseil précis dans cette population est donc nécessaire avant la conception, afin d’arrêter certains médicaments diminuant la fertilité, tout en maintenant un contrôle de la maladie.
Effet de la grossesse sur l’évolution de la MICI
La grossesse induit un état d’immunosuppression maternel. L’IL-17, une cytokine pro-inflammatoire responsable de l’inflammation et des symptômes de la maladie, est inhibée par l’IFN-γ sécrétée en grande quantité durant la période gestationnelle. La grossesse représente donc plutôt une période d’accalmie pour les patientes, tout principalement pour celles souffrant de MC.
Le risque de rechute pendant la grossesse dépend essentiellement du contrôle de la maladie avant la conception. Si la maladie est inactive, le risque de rechute est d’environ 30%, un taux similaire à celui des patientes MICI non-enceintes.9 En revanche, si la maladie est active, jusqu’à deux tiers des patientes auront une persistance d’activité inflammatoire pendant la grossesse.10
Effet de la MICI sur la grossesse et le fœtus
À l’exception d’un risque deux fois plus élevé de petit poids de naissance, il n’y a pas plus d’événements indésirables rapportés chez les bébés nés de patientes MICI avec une maladie inactive que chez ceux nés de patientes non atteints de MICI.11. La présence d’inflammation est toutefois associée à une augmentation du risque d’événements indésirables, comme la fausse couche, la prématurité, le petit poids de naissance, la césarienne, les admissions néonatales aux soins intensifs et le faible score APGAR.12,13 Le taux d’événements indésirables dépend également du degré d’activité de la maladie et du moment de sa survenue pendant la grossesse. Ceci renforce encore l’importance du contrôle de la maladie avant la conception, afin de maintenir la mère et l’enfant en bonne santé.
Surveillance de l’activité de la maladie pendant la grossesse
Afin de prendre les meilleures décisions thérapeutiques et de maintenir la patiente en rémission, une surveillance rapprochée est primordiale. La survenue d’une éventuelle poussée pendant la grossesse doit être identifiée le plus tôt possible pour permettre une prise en charge rapide.
Toutefois, le diagnostic d’une poussée de MICI chez une patiente enceinte peut s’avérer délicat, car certains paramètres biologiques sont naturellement modifiés pendant la grossesse. C’est le cas notamment de l’hémoglobine et de l’albumine, qui sont abaissées en raison du phénomène de dilution. La CRP et la calprotectine fécale (CF) sont des marqueurs non invasifs utiles présentant une corrélation relativement bonne avec l’activité de la maladie. Leur utilisation semble fiable pendant toutes les périodes de la gestation, même si la CF serait moins sujette aux altérations que la CRP durant la grossesse.14
Par ailleurs, il est tout-à-fait possible de réaliser une endoscopie pendant la grossesse. Ce geste médical n’est contre-indiqué qu’en cas de complication obstétrique, comme le décollement du placenta, la rupture des membranes ou l’éclampsie. Il devrait toutefois être réalisé par un endoscopiste expérimenté, afin de réduire la durée de la procédure; de plus, il serait préférable d’éviter le premier trimestre en raison de l’organogenèse. Une sigmoïdoscopie sans sédation peut, quant à elle, être effectuée à n’importe quel trimestre de la grossesse.
Les méthodes d’imagerie les plus sûres restent l’échographie et l’imagerie par résonance magnétique sans contraste. En l’absence de données de sécurité, le gadolinium est contre-indiqué pendant la grossesse.
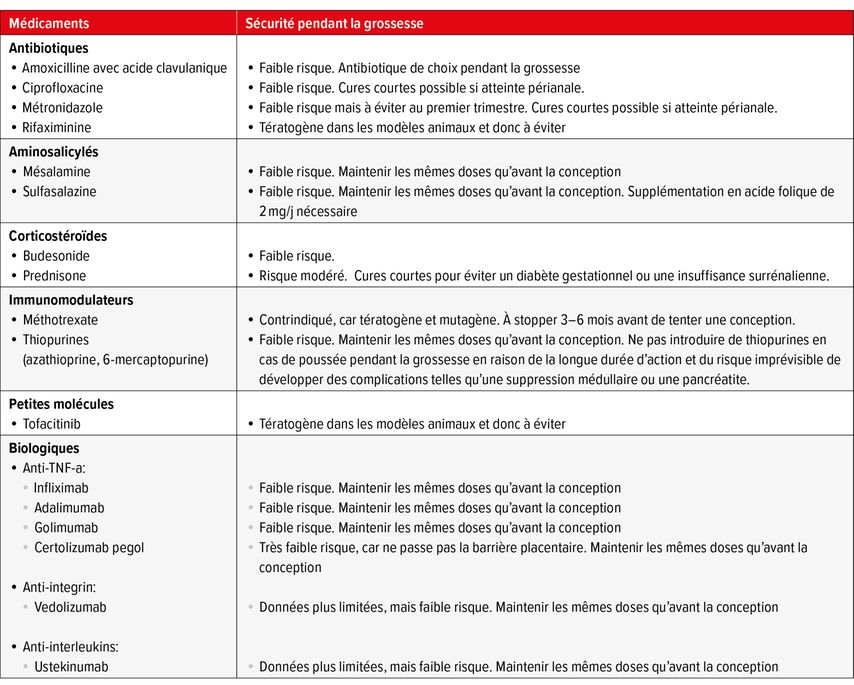
Traitements médicamenteux des MICI pendant la grossesse
Il n’existe pas de traitement curatif des MICI. Les médicaments actuels permettent toutefois un contrôle durable de la maladie chez la majorité des patients. Les traitements de fond des MICI comprennent tout d’abord les traitements anti-inflammatoires appelés 5-aminosalicylés (5-ASA), administrés uniquement dans la RCH non sévère. La MC ou RCH plus actives nécessitent l’introduction d’un traitement immunomodulateur comme l’azathioprine, le 6-mercaptopurine, le methotrexate (MTX), le tofacitinib ou encore un traitement immunosuppresseur – dits biologiques – constitué d’anticorps monoclonaux de synthèse. Les plus utilisés sont les anti-TNFα, qui bloquent spécifiquement le TNFα, une molécule centrale de l’inflammation; l’ustékinumab qui inhibe 2 cytokines clés, l’IL-12 et IL-23; ou encore le vedolizumab, un anticorps monoclonal bloquant une intégrine, qui permet spécifiquement d’acheminer les lymphocytes T au niveau du tube digestif.
Actuellement, les données publiées sur la sécurité de ces traitements durant la grossesse sont nombreuses et rassurantes (Tab. 1). Certaines femmes s’inquiètent toutefois des effets de leur traitement sur leur enfant à naitre et sont tentées de l’arrêter pendant la grossesse par crainte des risques supposés pour le fœtus et des effets défavorables associés.15,16 En 2021, les résultats de la large étude prospective américaine PIANO (Pregnancy and Inflammatory Bowel Disease in Neonatal Outcomes) ont été publiés.17 PIANO est un registre aux États-Unis incluant 1490 femmes enceintes atteintes de MICI entre 2007 et 2020: 379 femmes ne prenaient pas de thiopurine ou de produit biologique, 242 prenaient une thiopurine, 642 prenaient un produit biologique, et 227 une combinaison de thiopurine et de biologique. En tout, 1431 bébés nés de ces grossesses n’ont pas présenté d’augmentation significative d’événements indésirables, comme une anomalie congénitale, un avortement spontané, une naissance prématurée, un faible poids de naissance ou une infection au cours de la première année de vie. Cette étude a permis ainsi de confirmer l’innocuité de la grande majorité des traitements des MICI pendant la grossesse. Les études les plus récentes suggèrent que l’arrêt des biologiques pendant la grossesse augmente le risque de poussée.17–19 Aussi, il est maintenant recommandé de poursuivre ces traitements tout au long de la grossesse, afin d’éviter les complications dues à une recrudescence d’inflammation à l’arrêt du traitement. Un arrêt au 3e trimestre peut toutefois être considéré au cas par cas chez des femmes ayant une MICI en rémission profonde depuis plusieurs années et souhaitant arrêter leur traitement en fin de grossesse.
Quelques notions importantes concernant le traitement des MICI pendant la grossesse sont toutefois à retenir suivant la catégorie de médicaments:
-
Des courtes cures de corticoïdes sont généralement utilisées comme traitement d’attaque lors des poussées. Les corticostéroïdes peuvent être utilisés à n’importe quel trimestre, mais une exposition prolongée n’est pas recommandée, principalement pour éviter un diabète gestationnel chez la mère.
-
Il est conseillé de ne pas dépasser la dose de 2–3g/j de 5-ASA. La sulfasalazine inhibant l’absorption et le métabolisme de l’acide folique, une substitution d’acide folique de 2mg/j est nécessaire avant la conception et pendant la grossesse pour éviter les risques d’anomalies de fermeture du tube neural.
-
Les thiopurines et les biologiques peuvent être utilisés sans danger pendant toute la grossesse sans adaptation de dose.
-
Le MTX, quant à lui, est tératogène et mutagène. Son utilisation est donc contre-indiquée lors de la conception et pendant la grossesse. La prise de méthotrexate doit systématiquement être associée à une contraception efficace, tant chez l’homme que chez la femme; en effet son utilisation pendant le premier trimestre entraîne de multiples malformations congénitales, tandis que l’exposition tardive pendant les 2e et 3e trimestres résulte en une toxicité et une mortalité fœtale.
Mode d’accouchement
Les femmes atteintes de MICI ont deux fois plus d’accouchements par césarienne que la population générale.20 La plupart du temps, une césarienne est proposée ou demandée en raison de craintes injustifiées de la part des patientes ou des soignants. Seule une maladie périanale ou rectale active et la présence d’une fistule rectovaginale ouverte au moment de l’accouchement imposent une césarienne planifiée.20 Un status post coloproctectomie totale avec anastomose iléo-anale est une contre-indication relative à l’accouchement par voie vaginale. Dans le reste des cas, l’accouchement par voie vaginale peut être proposé.
Période post-partum et allaitement
Le risque de rechute de la maladie est plus élevé pendant la période post-partum et reflète en partie la conséquence de l’arrêt du traitement proposé ces dernières années pendant la grossesse.21 En l’absence de complication infectieuse, le traitement biologique peut être administré 24h après un accouchement par voie basse et 48h après une césarienne.22 Le MTX peut être repris en post-partum uniquement dans les cas où la mère n’allaite pas.
Un grand nombre de femmes atteintes de MICI craignent d’allaiter leur enfant. Toutefois, la plupart des traitements des MICI peuvent être utilisés sans restriction pendant l’allaitement, car ils sont soit indétectables dans le lait maternel, soit présents à des concentrations qui ne devraient pas nuire à l’enfant allaité. Ceci permet d’encourager l’allaitement maternel, qui a démontré un bénéfice substantiel chez les patientes atteintes de MICI.23
Certains experts recommandent d’éviter l’allaitement 3–4h après la prise de thiopurines et corticoïdes afin de limiter la quantité de médicament transmise à l’enfant, bien que ceci ne soit pas complétement nécessaire. En cas de traitement par ciclosporine, thalidomide, méthotrexate ou tofacitinib, l’allaitement est toutefois contre-indiqué; de même, la ciprofloxacine et la métronidazole devraient être évitées.
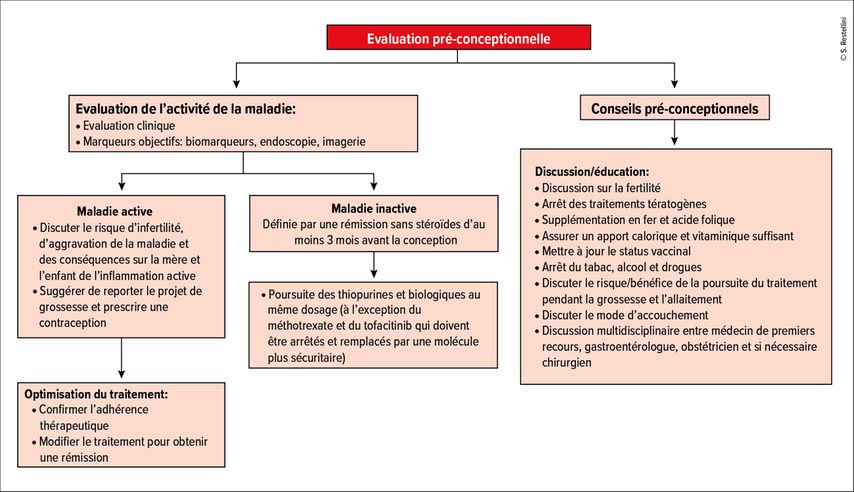
Le conseil pré-conceptionnel
Il est maintenant bien établi qu’un conseil pré-conceptionnel prodigué par les différents prestataires de soins et une approche multidisciplinaire coordonnée pour éviter les conseils contradictoires conduisent à moins d’anxiété chez les patientes atteintes de MICI. Le conseil pré-conceptionnel est également associé à une meilleure observance du traitement et à un meilleur contrôle de la maladie.23 Un résumé des conseils à prodiguer est décrit dans la Figure 1.
Impact de la MICI sur l’enfant
Le risque d’hériter d’une MICI est en réalité faible, de l’ordre de 0,5–1% pour la RCH et de 2–3% pour la MC si l’un des parents est atteint de MICI. Ce risque peut s’élever jusqu’à 30% si les deux parents sont atteints.23 Les enfants de mères traitées jusqu’à l’accouchement par traitement biologiques ne présentent pas un risque accru d’infection au cours de la première année de vie. Toutefois, ils doivent être considérés comme immunodéprimés jusqu’à l’âge de six mois et les vaccins vivants sont donc interdits.
Les données les plus récentes confirment l’absence d’impact négatif des traitements des MICI sur le développement de l’enfant. Toutefois, des effets de l’inflammation in utero sur le cerveau en développement en termes d’influence négative sur la neurogénèse de l’hippocampe et la cytoarchitecture neuronale ont été rapportés. Ceci confirme d’autant plus l’importance d’un bon contrôle de la maladie pendant la grossesse.17
Conclusion
L’obtention d’une rémission de la MICI avant la conception et tout au long de la grossesse représente la pierre angulaire de la prise en charge des femmes enceintes MICI. Ceci permet de limiter les risques maternels et néonataux. C’est dans cette optique que la plupart des patientes doivent continuer leur traitement de fond pendant la grossesse, puis durant l’allaitement. Le profil de sécurité de la très grande majorité des traitements administrés en cas de MICI est actuellement jugé comme rassurant, les bénéfices liés au traitement dépassant largement les risques associés à leur interruption. Dans tous les cas, la prise en charge d’une patiente MICI enceinte doit faire l’objet d’un suivi multidisciplinaire, afin de prodiguer un plan thérapeutique commun, améliorant l’anxiété des patientes et ainsi la compliance thérapeutique et le contrôle de la maladie.
Littérature:
1 Kaplan GG, Ng SC: Understanding and preventing the global increase of inflammatory bowel disease. Gastroenterology 2017; 152: 313-21 e2 2 Bahler C et al.: Trends in prevalence, mortality, health care utilization and health care costs of Swiss IBD patients: a claims data based study of the years 2010, 2012 and 2014. BMC Gastroenterol 2017; 17: 138 3 Ng SC et al.: Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. Lancet 2017; 390: 2769-78 4 Mountifield R et al.: Fear and fertility in inflammatory bowel disease: a mismatch of perception and reality affects family planning decisions. Inflamm Bowel Dis 2009;15:720-5 5 Tavernier N et al.: Systematic review: fertility in non-surgically treated inflammatory bowel disease. Aliment Pharmacol Ther 2013; 38: 847-53 6 Rajaratnam SG et al.: Impact of ileal pouch-anal anastomosis on female fertility: meta-analysis and systematic review. Int J Colorectal Dis 2011; 26: 1365-74 7 Narendranathan M et al.: Male infertility in inflammatory bowel disease. J Clin Gastroenterol 1989; 11: 403-6 8 Sussman A, Leonard JM: Psoriasis, methotrexate, and oligospermia. Arch Dermatol 1980; 116: 215-7 9 Bortoli A et al.: Pregnancy before and after the diagnosis of inflammatory bowel diseases: retrospective case-control study. J Gastroenterol Hepatol 2007; 22: 542-9 10 Schulze H et al.: Review article: the management of Crohn‘s disease and ulcerative colitis during pregnancy and lactation. Aliment Pharmacol Ther 2014; 40: 991-1008 11 Bengtson MB et al.: Inadequate gestational weight gain, the hidden link between maternal ibd and adverse pregnancy outcomes: results from the norwegian mother and child cohort study. Inflamm Bowel Dis 2017; 23: 1225-33 12 Abdul Sultan A et al.: Adverse pregnancy outcomes among women with inflammatory bowel disease: a population-based study from England. Inflamm Bowel Dis 2016; 22: 1621-30 13 Kammerlander H et al.: The effect of disease activity on birth outcomes in a nationwide cohort of women with moderate to severe inflammatory bowel disease. Inflamm Bowel Dis 2017; 23: 1011-8 14 Kammerlander H et al.: Fecal calprotectin during pregnancy in women with moderate-severe inflammatory bowel disease. Inflamm Bowel Dis 2018; 24: 839-48 15 Julsgaard M et al.: Self-reported adherence to medical treatment prior to and during pregnancy among women with ulcerative colitis. Inflamm Bowel Dis 2011; 17: 1573-80 16 Nielsen MJ et al.: Self-reported antenatal adherence to medical treatment among pregnant women with Crohn‘s disease. Aliment Pharmacol Ther 2010; 32: 49-58 17 Mahadevan U et al.: Pregnancy and neonatal outcomes after fetal exposure to biologics and thiopurines among women with inflammatory bowel disease. Gastroenterology 2021; 160: 1131-9 18 Nguyen GC et al.: The Toronto consensus statements for the management of inflammatory bowel disease in pregnancy. Gastroenterology 2016; 150: 734-57 e1 19 Restellini S et al.: Update on the management of inflammatory bowel disease during pregnancy and breastfeeding. Digestion 2020; 101 (Suppl 1): 27-42 20 Cornish JA et al.: The effect of restorative proctocolectomy on sexual function, urinary function, fertility, pregnancy and delivery: a systematic review. Dis Colon Rectum 2007; 50: 1128-38 21 Kane S, Lemieux N: The role of breastfeeding in postpartum disease activity in women with inflammatory bowel disease. Am J Gastroenterol 2005; 100: 102-5 22 Mahadevan U et al.: Drug safety and risk of adverse outcomes for pregnant patients with inflammatory bowel disease. Gastroenterology 2017; 152: 451-62 e2 23 Mahadevan U et al.: Inflammatory bowel disease in pregnancy clinical care pathway: a report from the American Gastroenterological Association IBD Parenthood Project Working Group. Gastroenterology 2019; 156: 1508-24
Das könnte Sie auch interessieren:
Revue de presse: L’importance d’objectifs thérapeutiques centrés sur les patient·es dans la SLA
Dans une revue récente, Chio et al., mettent en lumière la nécessité de repenser les critères d’évaluation dans les essais cliniques portant sur la sclérose latérale amyotrophique (SLA ...
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...