Le traitement de l’insuffisance rénale chronique
Auteurs:
Susanne Winkler
Prof. Dr méd. Michael Dickenmann
Nephrologie und Transplantationsimmunologie
Universitätsspital Basel
Petersgraben 4
4031 Basel
E-mail: susanneandrea.winkler@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le traitement des patients souffrant d’insuffisance rénale fait partie du quotidien de tout médecin interniste et généraliste. En Suisse, environ 10% des adultes sont concernés par une insuffisance rénale chronique modérée à sévère; la prévalence est nettement plus élevée dans les cabinets de médecine de premier recours, les homes pour personnes âgés et les hôpitaux. L’hypertension artérielle et le diabète en sont les causes les plus fréquentes et leur prévalence augmente, c’est pourquoi leur contrôle précoce et optimal revêt une grande importance pronostique. Aussi, parce que l’exposition à ces maladies augmente avec l’espérance de vie.
Keypoints
-
Des mesures régulières de la créatinine sur une période prolongée améliorent l’évaluation de la progression.
-
Une néphroprotection optimale peut empêcher la progression vers l’insuffisance rénale terminale ou la retarder de plusieurs années.
-
Plus le patient est jeune et plus la protéinurie est élevée, plus l’ajustement des facteurs de risque cardiovasculaire doit être strict.
-
Les concentrés d’érythrocytes chez les patients susceptibles de bénéficier d’une transplantation rénale en cours de traitement ne doivent être utilisés que s’il existe une indication vitale.
Le diagnostic de l’insuffisance rénale chronique
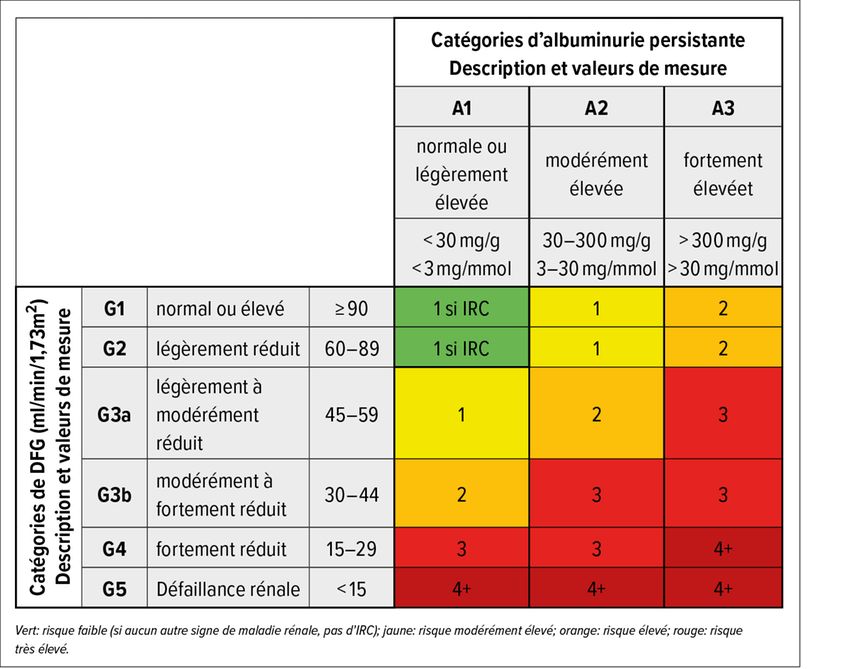
Deux valeurs de DFGe (débit de filtration glomérulaire estimé) basées sur la créatinine (selon la CKD-EPI) <60ml/min, mesurées à au moins trois mois d’intervalle, peuvent déboucher sur un diagnostic d’insuffisance rénale chronique (IRC). Si le DFGe est supérieur à cette valeur, le diagnostic nécessite la mise en évidence de lésions structurelles, qui peuvent être recherchées au moyen d’un test de bandelette urinaire et/ou d’une échographie. En cas d’anomalies dans l’analyse de la bandelette urinaire (microhématurie, protéinurie), il convient de procéder à une investigation supplémentaire au moyen d’un sédiment urinaire et de quantifier la protéinurie en déterminant le quotient protéines/créatinine et albumine/créatinine dans l’urine ponctuelle.1
Une investigation ciblée de l’IRC est recommandée chez les patients présentant une configuration de risques afférente (hypertension artérielle, diabète, maladie rénale fréquente dans les antécédents familiaux). Cependant, même sans la présence de facteurs de risque, nous considérons que le dosage de la créatinine sérique ainsi que la réalisation d’une bandelette urinaire tous les cinq ans sont utiles chez les patients âgés >50 ans. Il convient de mentionner qu’une perte de la fonction rénale liée à l’âge, avec une diminution du DFGe d’environ 1ml/min par an à partir de l’âge de 40 ans, peut être considérée comme physiologique.
Traitement de l’insuffisance rénale chronique
Nous n’abordons pas dans cet article les traitements immunosuppresseurs des glomérulonéphrites ni la correction des détériorations prérénales et postrénales de la fonction rénale. L’accent est mis sur les mesures thérapeutiques visant à retarder la progression de la maladie et sur le traitement des séquelles rénales.
Néphroprotection
En principe, le terme de néphroprotection peut être compris comme désignant toutes les mesures qui protègent le rein contre de plus amples dommages. Dans un sens plus étroit, cependant, il fait généralement référence à l’influence positive exercée sur des processus mal adaptés dans les glomérules. L’hypertension artérielle, le diabète et l’obésité entraînent une hyperfiltration dans les glomérules individuels et donc leur «usure» s’étalant sur de nombreuses années. Par conséquent, les glomérules restants sont encore plus sollicités et la maladie rénale progresse. Cette dynamique peut être interrompue en contrôlant de manière optimale les facteurs de risque cardiovasculaire et en réduisant autant que possible la protéinurie.
Hypertension artérielle
En principe, les patients souffrant d’insuffisance rénale doivent viser une normotension (<140/90mmHg). Toutefois, si une albuminurie de >300mg/d est déjà présente (microalbuminurie de 30–300mg/d en cas de diabète), il convient de procéder à un contrôle plus strict de la pression artérielle (<130/80mmHg).2 En outre, plus le patient est jeune, plus les objectifs de traitement sont ambitieux.
Dans le rein, les inhibiteurs de l’ECA (iECA) et les antagonistes des récepteurs de l’angiotensine II (ARA) abaissent la pression de filtration intraglomérulaire de chaque glomérule par le biais d’une vasodilatation au niveau de l’artériole efférente du glomérule, ce qui s’accompagne généralement d’une réduction significative de la protéinurie. En raison de ces propriétés rénoprotectrices, les deux classes de substances constituent le traitement de choix. L’augmentation fréquemment observée de la créatinine après le début du traitement reflète la réduction souhaitée de l’hyperfiltration – jusqu’à 30% peuvent être tolérés (pensez à la sténose de l’artère rénale si l’augmentation est plus élevée). Des effets antiprotéinuriques additifs peuvent être obtenus avec les antagonistes de l’aldostérone (attention à l’hyperkaliémie).
En cas de contrôle insuffisant de la pression artérielle sous iECA ou ARA, l’association avec des diurétiques est utile, étant donné qu’ils contrecarrent la rétention de sodium liée à l’insuffisance rénale avec hypervolémie et hypertension consécutives. Les thiazides peuvent être utilisés jusqu’à un DFGe de 30ml/min; les diurétiques de l’anse sont préférables à des valeurs inférieures. Les inhibiteurs calciques font également partie du traitement de première intention chez les patients atteints d’IRC, mais ils n’ont pas d’effets intrarénaux et antiprotéinuriques.
Diabète
Les valeurs cibles d’HbA1c ne diffèrent pas chez les diabétiques avec et sans IRC. Comme pour l’hypertension artérielle, la fourchette cible doit être fixée individuellement (en gros entre 6,5 et 7,5%). La metformine continue à faire partie du traitement de base, mais ne doit pas être prescrit si le DFGe <45ml/min et doit être arrêtée si le DFGe <30ml/min en raison du risque d’acidose lactique.
Inhibiteurs du SGLT2
Plusieurs études menées ces dernières années montrent que l’utilisation d’inhibiteurs du SGLT2 («sodium-glucose cotransporter 2»), initialement testés uniquement chez les diabétiques, entraîne également un ralentissement de la perte de fonction rénale et une diminution de la protéinurie chez les non-diabétiques et que leur utilisation est sûre jusqu’à un DFGe de 25ml/min.3 Cela s’applique aux patients qui ont été prétraités par un iECA ou un ARA.
La diurèse osmotique induite par la glucosurie ne semble pas être la seule à jouer un rôle. En raison de l’inhibition du cotransporteur du glucose et du sodium, la réduction de la réabsorption du glucose dans le tubule contourné proximal s’accompagne également d’une augmentation de la natriurèse, qui entraîne à son tour une vasoconstriction au niveau de l’artériole afférente du glomérule avec une réduction de l’hyperfiltration via une augmentation du feedback tubuloglomérulaire. En outre, une réduction de la demande en oxygène des cellules du tubule contourné proximal en raison de la moindre «charge de travail» (avec un risque réduit de dommages hypoxiques) fait l’objet de discussions, et la légère perte de poids a certainement aussi un effet favorable.
Dans les milieux néphrologiques, on ne s’accorde toujours pas sur l’importance effective du bénéfice thérapeutique additif des inhibiteurs du SGLT2 chez les patients non diabétiques sous traitement optimal ou bien dosé en iECA, diurétiques (et antagonistes de l’aldostérone).
Ajustement de la dose de médicaments
De nombreux médicaments sont totalement ou partiellement éliminés par voie rénale. En cas de diminution pertinente de la fonction rénale, une accumulation de substance peut donc se produire, avec éventuellement des effets néphrotoxiques. Une évaluation régulière des médicaments et de leurs posologies est donc conseillée à partir d’un DFGe <45ml/min. Vous trouverez de l’aide pour une adaptation correcte de la dose sur www.compendium.ch ou www.dosing.de .
Fig. 1: Recommandations concernant le nombre de contrôles par an en fonction de la catégorie de DFG et d’albuminurie (adapté d’après Kidney Disease: Improving Global Outcomes [KDIGO] CKD Work Group)6
Alimentation
Il existe peu de preuves en faveur de recommandations spécifiques, de sorte que les recommandations nutritionnelles pour la population générale sont aussi largement valables pour les patients souffrant d’IRC. Une consommation modérée de sel ainsi que la consommation d’une quantité suffisante de légumes et de fruits (lesquels contiennent des alcalis) sont avantageuses. À partir d’un DFGe <20ml/min, un conseil nutritionnel est pertinent, notamment en ce qui concerne le phosphate et le potassium. Un apport excessif en protéines est à éviter, tout comme la malnutrition.
Séquelles rénales
Anémie rénale
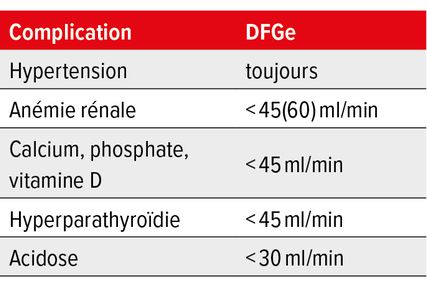
L’anémie rénale est une complication fréquente de l’IRC et peut se développer à partir d’un DFGe <60ml/min. Une formule sanguine comprenant une numération des réticulocytes de même qu’un bilan ferrique (ferritine, fer, transferrine) font partie de l’investigation. Si une autre cause est suspectée, le diagnostic doit être étendu (p.ex. recherche d’un déficit en substrat, électrophorèse, exclusion d’une hémolyse, ponction de moelle osseuse). Le dosage de l’érythropoïétine, en revanche, n’est pas utile et ne fait pas partie du diagnostic.
Une carence en fer absolue ou fonctionnelle est fréquente chez les patients atteints d’IRC, en partie à cause de la dégradation de l’absorption intestinale, et doit être généreusement substituée (de préférence par voie i.v.). L’objectif est une ferritine sérique de 200–500μg/l avec une saturation de la transferrine de 25–40%.
Un traitement par agents stimulant l’érythropoïétine (ASE) n’est utilisé que lorsque la valeur de l’hémoglobine est <100g/l malgré une substitution optimale en fer et en substrat. Ensuite, avec la darbapoétine α ou l’époétine β pégylée, on dispose de deux préparations qui peuvent être administrées par voie sous-cutanée toutes les deux ou quatre semaines et qui sont donc bien adaptées au contexte ambulatoire. La valeur cible de l’hémoglobine sous traitement ASE est de 100–120g/l. Une valeur d’Hb >130g/l doit être évitée en raison du risque de complications cardiovasculaires accrues.3
Chez les patients susceptibles de bénéficier d’une transplantation rénale à terme, les transfusions sanguines doivent être évitées autant que possible. Une sensibilisation aux antigènes du donneur peut considérablement détériorer les chances de recevoir un organe immunologiquement adapté.
Calcium – phosphate – hormone parathyroïdienne
Des modifications de l’équilibre calcium-phosphate ainsi que du métabolisme osseux et de la vitamine D sont à rechercher dans les IRC de stade 3b et plus. Ces changements sont résumés sous le terme de CKD-MBD («CKD-mineral and bone disorder») et concernent également les calcifications extrasquelettiques (notamment des vaisseaux).
L’altération de la fonction rénale entraîne le développement d’une hyperphosphatémie, qui peut être corrigée dans un premier temps par une augmentation de la sécrétion de l’hormone parathyroïdienne (PTH) avec une augmentation consécutive de la phosphaturie. En parallèle, cependant, l’hypocalcémie entraîne souvent une stimulation supplémentaire de la PTH. L’hyperparathyroïdie secondaire entraîne alors une résorption du calcium et du phosphate de l’os et donc une ostéodystrophie.
L’hypocalcémie est généralement due à une carence en vitamine D active, qui ne peut plus être produite suffisamment par les reins en cas d’IRC. Cette carence entraîne une réduction de l’absorption intestinale du calcium. À un DFGe >30ml/min, la carence en vitamine D peut être traitée par cholécalciférol. Au-delà d’un DFGe <30ml/min, la vitamine D active (calcitriol) est souvent nécessaire pour corriger l’hypocalcémie. Ces deux médicaments peuvent provoquer une augmentation de l’hyperphosphatémie et doivent donc être évalués dans le contexte global.
Si une hyperphosphatémie persiste même après un conseil nutritionnel professionnel, il convient de mettre en œuvre des chélateurs de phosphate. En cas d’hypocalcémie à normocalcémie, les chélateurs de phosphate contenant du calcium sont à privilégier (gélules d’acétate de calcium), en cas d’hypercalcémie les chélateurs de phosphate sans calcium (carbonate de sévélamer > carbobate de lanthane > oxyhydroxyde sucroferrique). Un traitement suffisant nécessite généralement 1 à 2 comprimés à chaque repas.
La fourchette idéale de PTH n’est pas claire, et le traitement doit être administré seulement en cas d’augmentation continue de la PTH ou d’augmentation élevée permanente (p.ex. si la PTH >300ng/l). En plus du traitement de la carence en vitamine D, de l’hypocalcémie et de l’hyperphosphatémie, l’hyperparathyroïdie secondaire peut être traitée par des calcimimétiques. S’ils se soldent par un échec du traitement, une parathyroïdectomie peut s’avérer nécessaire. Les deux traitements doivent être discutés avec un néphrologue.5
Acidose
Avec la perte progressive de la fonction rénale, le risque d’acidose métabolique pertinente s’accroît. En raison de l’augmentation des pertes osseuses et protéiques, l’acidose doit être corrigée par des préparations contenant des substances alcalines. Le citrate de potassium, le citrate de magnésium ou le bicarbonate de sodium sont disponibles pour une administration orale. Pour réduire les fréquents effets secondaires gastro-intestinaux, il vaut la peine d’instaurer la posologie lentement (dose nécessaire souvent comprise entre 2 et 6 comprimés ou gélules par jour). L’objectif du traitement est un bicarbonate sérique >20mmol/l.
Orientation vers un néphrologue
Le timing d’une orientation vers le spécialiste doit être évalué au cas par cas. En général, les jeunes patients doivent être orientés rapidement. Chez les patients âgés de plus de 70 ans, la nécessité d’une évaluation néphrologique doit être discutée avec le patient. En général, nous recommandons un bilan néphrologique – éventuellement unique – à partir du stade 4 de l’IRC (DFGe <30ml/min), en cas de perte rapide de la fonction rénale (>5ml/min par an), de maladies génétiques rares ou de protéinurie de >1g/d (ou >500mg/d si un sédiment urinaire pathologique est également présent; correspond à un quotient protéines/créatinine de 100 ou 50mg/mmol).
Substitution rénale
Au plus tard à partir d’un DFGe <20ml/min, la suite à donner en termes de substitution rénale doit être abordée. Une greffe du rein est-elle envisageable? Y a-t-il des donneurs vivants éventuels? Le patient bénéficierait-il davantage d’une hémodialyse ou d’une dialyse péritonéale? Quel type d’accès vasculaire peut-on créer? Ces investigations et informations nécessitent du temps et un encadrement néphrologique.
Littérature:
1 Stevens PE et al.: Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline. Ann Intern Med 2013; 158: 825-30 2 Jafar TH et al.: Progression of chronic kidney disease: the role of blood pressure control, proteinuria, and angiotensin-converting enzyme inhibition: a patient-level meta-analysis. Ann Intern Med 2003; 139: 244-52 3 Wheeler DC et al.: The dapagliflozin and prevention of adverse outcomes in chronic kidney disease (DAPA-CKD) trial: baseline characteristics. Nephrol Dial Transplant. 2020; 35:1700-11 4 KDIGO: Chapter 3: Use of ESAs and other agents to treat anemia in CKD. Kidney Int Suppl 2012; 2:299-310 5 Ketteler M et al.: Executive summary of the 2017 KDIGO Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) Guideline Update: what‘s changed and why it matters [published correction appears in Kidney Int 2017; 92: 1558]. Kidney Int 2017; 92: 26-36 6 Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group: KDIGO 2012: Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int 2013; 1(S3): S1-150
Das könnte Sie auch interessieren:
Redéfinition de la résécabilité à l’ère de l’immunothérapie
L’introduction de l’immunothérapie néoadjuvante a ouvert de nouveaux horizons quant aux limites de la résection chirurgicale des tumeurs du cancer du poumon. Toutefois, des problèmes ...
La perte de poids reste toujours le meilleur traitement en cas de MASLD
La directive commune pour la prise en charge de la maladie stéatosique du foie associée à une dysfonction métabolique (MASLD) de l’European Association for the Study of the Liver (EASL ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...