«L’infarctus débute au niveau de la jambe» – aperçu du pronostic de l’AOMI
Auteurs:
Dr méd. Lili Sike
Médecin-assistante
Dr méd. Thorsten Grumann
Médecin adjoint
Abteilung Angiologie, Department Medizin, Luzerner Kantonsspital
Spitalstrasse, 6000 Luzern 16
E-mail: thorsten.grumann@luks.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’artériopathie oblitérante des membres inférieurs (AOMI) est sous-estimée, sous-diagnostiquée et passe souvent inaperçue. Pourtant, elle fait désormais partie des maladies les plus fréquentes chez le sujet âgé et a pris un caractère pandémique. Dans la grande majorité des cas (>90%), l’AOMI chronique est causée par l’artériosclérose, les formes aiguës, donc souvent symptomatiques, sont majoritairement dues à l’athérothrombose.
Keypoints
-
L’AOMI a pris un caractère pandémique. La prévalence augmente dans le monde entier, de 22% au cours de la dernière décennie, et le plus fortement en Europe.
-
L’ABI, le TBI et la pression d’orteil sont des paramètres pronostiques importants: plus l’ABI est bas, plus la morbidité et la mortalité CV sont élevées.
-
AOMI, diabète et IRC – le «trio infernal»: l’AOMI est plus fréquente, se manifeste plus tôt et présente une progression plus rapide vers des stades critiques plus élevés, associée à un risque beaucoup plus élevé de MACE et à une diminution drastique de la survie sans amputation.
-
Le manque de sensibilisation, l’absence de diagnostic et le nihilisme thérapeutique qui en découle sont alarmants.
-
«Window of opportunity»: le dépistage précoce de l’AOMI permet un traitement conséquent des facteurs de risque CV en temps voulu, ce qui peut retarder la progression de la maladie.
-
La mise en œuvre de 4 recommandations basées sur des preuves et issues des directives internationales actuelles peut plus que diviser par trois le taux de MACE et par deux celui de MALE: 1. aspirine ou clopidogrel en monothérapie en cas d’AOMI symptomatique; 2. traitement par statine; 3. traitement antihypertenseur, de préférence des inhibiteurs du SRA; 4. arrêt du tabac.
L’artériosclérose est un processus pathologique insidieux et complexe. Elle évolue «sans faire de bruit», le plus souvent à l’insu des personnes concernées. Ainsi p.ex., seule une personne sur quatre souffrant d’AOMI présente également des symptômes typiques, comme une claudication intermittente (CI). C’est là d’autant plus dangereux lorsque d’autres régions vasculaires sont en outre touchées. En effet, des événements graves tels que l’infarctus du myocarde (IM) et l’accident vasculaire cérébral (AVC) ne sont que des manifestations différentes d’une seule et même maladie. Ils sont associés à une mortalité élevée. L’absence de dépistage et de diagnostic signifie donc que l’on passe à côté d’une approche préventive.
En ce qui concerne l’AOMI, des lacunes se font jour dans la prévention, le dépistage précoce et le traitement. Une réalité démontrée de manière impressionnante dans une étude récente menée en Angleterre, dans laquelle l’incidence de la coronaropathie et de l’AOMI a été analysée entre les années 2006 et 2015. Pour ce faire, on a utilisé les données électroniques du système de santé de 4,6 millions de personnes. Alors que la mortalité cardiovasculaire (CV) a diminué de 43% chez les patients atteints de coronaropathie au cours de cette période, elle est restée largement inchangée chez les patients atteints d’AOMI. Cette différence a été attribuée principalement au diagnostic plus précoce et à l’amélioration du traitement du syndrome coronarien aigu.1
L’AOMI soulève donc la question de la sensibilisation.
Faut-il avoir l’œil sur l’AOMI dans le quotidien clinique?
L’AOMI a une dimension globale. Elle est la troisième cause de morbidité athérosclérotique après la coronaropathie et l’AVC. En 2015, 237 millions de personnes âgées de ≥25 ans vivaient avec une AOMI (5,6%). Ainsi, sa prévalence a augmenté de 22% depuis 2010 et c’est en Europe qu’elle est la plus élevée, avec près de 8%, l’Allemagne étant en tête (10,7%).2 Avec le vieillissement de la population, l’importance de l’AOMI va encore augmenter. Selon des scénarios sur l’évolution de la population des cantons en Suisse, l’Office fédéral de la statistique estime que la part des plus de 60 ans doublera d’ici à 2045, et que celle des plus de 80 ans triplera.3
Si la prévalence de l’AOMI est d’environ 5% entre 40 et 44 ans, elle est de 20% parmi le groupe d’âge >65 ans. En présence de facteurs de risque CV supplémentaires, en particulier le tabagisme et le diabète, mais aussi la dyslipidémie, l’hypertension artérielle et l’obésité, le risque relatif ou la chance de développer une AOMI est multiplié. Ainsi, 29% des patients atteints de diabète présentent déjà une AOMI à l’âge de 50 ans. Le risque de la développer est multiplié par 2 ou 3.4 L’effet sur le métabolisme se fait également ressentir: chaque augmentation de 1% de l’HbA1c augmente le risque d’AOMI d’environ 28%.5,6
L’effet du tabagisme sur le risque et le degré de sévérité de l’AOMI est bien établi. Tous deux augmentent avec le début de l’exposition ainsi qu’avec la durée et le niveau d’exposition (nombre de paquets-années). Ainsi, le risque relatif d’AOMI est même deux fois plus élevé que celui de coronaropathie ou d’AVC. Les personnes qui fument depuis 35 ans ou plus ont un risque 5,6 fois plus élevé de développer une AOMI.7
Le lien entre hypertension artérielle et AOMI est également de plus en plus concret. Dans l’étude ARIC (Atherosclerosis Risk in Communities), une pression artérielle systolique ≥140mmHg a révélé un risque plus de 2,5 fois plus élevé (HR: 2,6) d’AOMI. Ce risque était moins prononcé si l’on considérait la pression artérielle diastolique de façon isolée et n’était significatif qu’à partir de >90mmHg.8
Traditionnellement, on considère que les hommes sont plus touchés par une AOMI que les femmes. Cependant, des études récentes basées sur la population font ressortir des résultats contradictoires sur la relation entre le sexe et l’AOMI. Sur la base des mesures de l’ABI («ankle-brachial index»), les femmes semblent avoir une prévalence égale voire même supérieure. Toutefois, la plupart des maladies athérosclérotiques surviennent environ 10 ans plus tard que chez les hommes (en raison de l’effet protecteur des hormones sexuelles féminines). Par conséquent, les femmes sont souvent plus âgées au moment du diagnostic de l’AOMI, présentent des stades plus graves et davantage de comorbidités.9
L’influence des facteurs socio-économiques est également intéressante. Les adultes ayant un faible revenu du ménage, un faible niveau d’éducation et une situation familiale difficile sont exposés à un risque de développement d’une AOMI plus de deux fois supérieur, même après ajustement des facteurs de risque CV.10,11
Quels sont les facteurs qui influencent le pronostic de l’AOMI?
La sévérité clinique
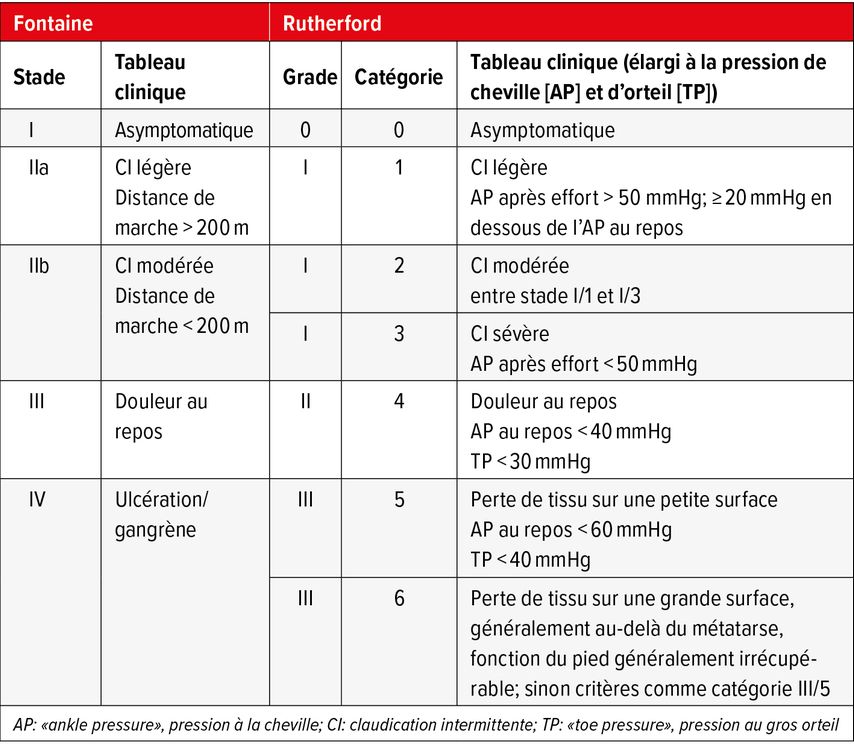
La classification clinique de l’AOMI s’effectue en fonction des symptômes, dans les pays germanophones selon les stades de Fontaine. La classification de Rutherford est en revanche plus courante au niveau international et dans les travaux scientifiques (Tab. 1).12 Les stades symptomatiques sont désignés par le terme de «claudication intermittente» et, au stade tardif, d’«ischémie critique des membres inférieurs» (ICMI).
La claudication intermittente décrit non seulement une diminution de la distance parcourue sans douleur, mais aussi une diminution de la vitesse de marche. L’apparition de douleurs musculaires reproductibles et dépendantes de l’effort, qui peuvent régresser rapidement au repos, est typique, comparable à l’angine de poitrine au niveau du cœur en cas de coronaropathie symptomatique. En fonction de la localisation en hauteur de la sténose artérielle ou de l’occlusion, la douleur peut être segmentaire ou combinée dans la musculature des fessiers, des cuisses, des mollets et des pieds. Parmi les autres symptômes figurent une sensation de faiblesse et de fatigue des jambes, souvent accompagnée d’une perte de motricité fine avec une démarche incertaine.
Le sort des patients est avant tout déterminé de manière décisive par des événements CV graves (MACE «major adverse cardiovascular events»), tels que l’IM, l’AVC, le décès d’origine CV et les MALE («major adverse limb events»). Il s’agit notamment de l’amputation et de l’ischémie aiguë ou chronique des jambes nécessitant une revascularisation. Le pronostic se détériore inexorablement avec la sévérité clinique de l’AOMI. Dès le stade asymptomatique, la mortalité totale double en 5 ans,13 mais elle ne change guère aux stades de Rutherford 1–3 symptomatiques, où elle atteint 18,9%.
L’ICMI est la forme la plus grave d’AOMI et se définit généralement par des douleurs au repos, des plaies qui ne cicatrisent pas ou une perte de tissus (Fontaine III–IV ou stade Rutherford 4–6). Environ 10% des patients atteints d’AOMI présentent une progression vers un stade «critique». Outre un risque accru de morbidité et de mortalité CV (globale), l’ICMI entraîne également un risque accru d’amputation, qui varie en fonction du degré de sévérité de l’ICMI.14,15 Elle s’accompagne d’une augmentation brutale de la mortalité, qui passe à plus de 37,7% (stade 4), 52,2% (stade 5) et 63,5% (stade 6) en l’espace de quatre ans.16 Il est fait état d’une mortalité à un an de 20%!17 La présence d’ulcérations la fait encore augmenter à 28,7%.18 Le taux d’amputation à un an est de près de 20%.19
Les paramètres de mesure physiques ABI, TBI et pression d’orteil: des diagnostics de première intention non invasifs à la valeur pronostique précieuse
Dans près de 80% des cas, le diagnostic de suspicion d’une AOMI peut être posé de manière fiable à l’aide de l’anamnèse, de l’état du pouls et de l’auscultation des artères. Dans la pratique clinique quotidienne, une simple question peut déjà servir de première étape: «Avez-vous des douleurs dans les jambes lorsque vous marchez normalement?»20
Pour confirmer le diagnostic d’une AOMI, l’anamnèse et l’examen clinique sont suivis de la mesure non invasive de l’indice cheville-bras (ABI) au moyen des pressions d’occlusion à l’échographie Doppler, c’est-à-dire du rapport entre la pression artérielle systolique au niveau de la cheville et la pression artérielle moyenne au niveau du bras – exception: en cas de différence de pression ≥10mmHg, on utilise la pression la plus élevée. La condition préalable est une méthode de mesure standardisée. Une valeur ABI de <0,9 est considérée comme une preuve de la présence d’une AOMI pertinente (Tab. 2). Alors que des études antérieures utilisaient la pression la plus élevée mesurée à la cheville, l’utilisation de la pression artérielle au niveau du pied la plus basse pour exclure ou prouver une AOMI est désormais une norme généralement acceptée. Elle augmente la sensibilité pour l’identification d’une artériopathie oblitérante pertinente à >90%, avec une spécificité comparable de quasiment 100%. Elle permet ainsi de réduire le taux de patients à haut risque non identifiés. Le principe est le suivant: plus la valeur est basse, plus les modifications athérosclérotiques dans la jambe sont prononcées et donc plus la circulation sanguine est entravée. Cependant, un ABI «normal» n’exclut pas une AOMI. Une bonne collatéralisation permet de compenser suffisamment les sténoses et/ou les occlusions vasculaires. En cas de suspicion, notamment en tenant compte d’une anamnèse typique, il est impératif de procéder à une mesure complémentaire de l’ABI après un effort (p.ex. test sur tapis roulant: 3,5km/h, pente de 12%, alternativement 30 postures sur la pointe des pieds). Bien que les critères d’évaluation de l’ABI après l’effort ne soient pas normalisés, un ABI <0,9 ou une chute de l’ABI de >20%, respectivement une chute de la pression au niveau de la cheville de >30mmHg, sont généralement considérés comme pertinents.
Les valeurs ABI faussement élevées (>1,3) dues à une sclérose médiale compliquent l’évaluation. Elles sont fréquentes chez les diabétiques, les patients souffrant de maladies rénales chroniques ou d’œdèmes périphériques. Dans un tel cas, la détermination de l’indice orteil-brachial («toe-brachial index», TBI) ou de la pression d’orteil peut être utile, car la calcification de la média n’affecte que rarement les artères digitales. En général, un TBI ≤0,70 est accepté pour confirmer l’AOMI. Une pression d’orteil <40mmHg augmente le risque de lésions du pied ou d’absence de cicatrisation.
Il existe une forte corrélation entre un ABI faible (≤0,9) et élevé (>1,3) et la mortalité globale et CV. Il constitue à cet égard un facteur prédictif indépendant. Dans une méta-analyse de 16 études de cohorte basées sur la population, la mortalité totale a doublé pour un ABI compris entre 0,81 et 0,9, et a même quadruplé pour les personnes ayant un ABI ≤0,70. Les personnes dont l’ABI était limite faible présentaient également un taux de mortalité significativement plus élevé.21
Le «duo infernal» n° 1: AOMI et diabète
Plus de la moitié des grosses amputations (majeures) (au-dessus ou au-dessous du genou) sont dues à un diabète et à une AOMI.22,23 Jusqu’à 30% de tous les patients atteints de CI et 50% de tous les patients atteints d’ICMI sont diabétiques.24 Ce groupe de patients présentant simultanément un diabète et une AOMI est exposé à un risque d’amputation quatre fois plus élevé que la moyenne.25,26
Différents aspects sont à l’origine de ce phénomène: par rapport aux personnes non diabétiques, l’AOMI se développe plus tôt chez les personnes diabétiques, progresse plus rapidement et évolue plus souvent vers l’ICMI. Sur le plan anatomique et morphologique, la pathologie se manifeste généralement de façon multisegmentaire et est associée à de longues sténoses/occlusions calcifiées, surtout au niveau des artères de la jambe, ainsi qu’à une collatéralisation insuffisante. Sur le plan clinique, les personnes atteintes de diabète se présentent souvent avec une ischémie critique, notamment parce que la CI et la douleur au repos précédant une ischémie critique peuvent rester longtemps masquées en raison de la polyneuropathie sensitive diabétique. Les ulcères diabétiques, qui s’accompagnent de neuropathies motrices, sensorielles et autonomes et de déformations du pied qui en résultent ainsi que d’une cicatrisation perturbée, contribuent également de manière significative au risque d’amputation chez les patients diabétiques. On estime toutefois qu’environ 50% des patients souffrant d’un ulcère diabétique présentent simultanément une AOMI.27
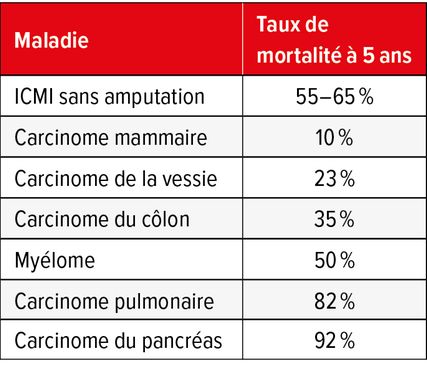
Outre les taux élevés d’ischémie et de récidive d’ulcère, le mauvais pronostic global est également dû au taux élevé de comorbidités et à la coprévalence de lésions d’organes terminaux, telles que l’insuffisance cardiaque et rénale, qui augmentent la mortalité de manière indépendante. Les amputations liées au diabète et à l’AOMI représentent un fardeau énorme pour les patients et leur entourage. Parmi les patients qui doivent subir une amputation en raison d’un diabète et/ou d’une AOMI, plus de la moitié sont ensuite durablement handicapés. Un nombre similaire, en particulier ceux qui doivent subir une amputation au-dessus du genou, ne reviennent jamais à un statut ambulatoire.28 Chez les patients qui ont dû subir une amputation majeure en raison d’une ICMI, la mortalité à un an était de 40,4% dans le cadre d’une récente étude Medicare aux États-Unis. De quoi illustrer la gravité de cette maladie au fil du temps. La mortalité à cinq ans en cas d’ICMI sans amputation est estimée à 55–65%.17 Comme le montre le Tableau 3, cela dépasse la mortalité à cinq ans due, p.ex., au cancer du sein (10%), au cancer du côlon (35%) et au myélome (50%).29
«Duo infernal» n° 2: AOMI et insuffisance rénale chronique
Les patients souffrant d’insuffisance rénale chronique (IRC) sont exposés à un risque nettement plus élevé de développer une AOMI. Ainsi, des données de l’étude américaine NHANE (National Health and Nutrition Examination Survey) montrent que la prévalence de l’AOMI est 6,5 fois plus élevée chez les patients ayant un débit de filtration glomérulaire (DFGe) estimé <60ml/min/1,73m2 par rapport à un DFGe ≥60.30 Au stade 5 de l’IRC, le phénomène concerne environ 30% des patients, et près d’un sur deux en cas de nécessité d’une dialyse.31,32 L’IRC est en soi un état clinique caractérisé par une morbidité et une mortalité (CV) élevées, avec une prévalence et une incidence croissantes. Si une AOMI s’y ajoute, le risque est potentialisé.33,34 Il est multiplié par quatre chez les patients souffrant à la fois d’AOMI et d’IRC par rapport aux patients non atteints et par deux par rapport à ceux qui ne souffrent que d’une seule entité de la maladie. En termes absolus, le taux de mortalité à six ans dans cette population AOMI+IRC est de 45%.35
En outre, il a été démontré que l’IRC en soi, mais surtout aux stades 4 et 5, est associée à une ICMI.36 Elle réduit drastiquement la probabilité de survie sans amputation chez les patients atteints d’ICMI sur une période d’observation de 3 ans (HR: 3,68; IC à 95%: 1,51–8,94).37
AOMI – la sentinelle d’une maladie polyvasculaire
L’AOMI a récemment fait l’objet d’une attention accrue dans le contexte des maladies polyvasculaires. Le registre REACH (Reduction of Atherothrombosis for Continued Health) peut être cité comme référence. Il s’agit d’une base de données multinationale dans laquelle la fréquence des maladies athérothrombotiques et les facteurs de risque associés sont enregistrés dans la pratique clinique quotidienne. Avec plus de 68000 patients dans 44 pays, il s’agit du plus grand registre de patients sur l’athérothrombose, tant du point de vue géographique que du nombre de cas. Trois patients sur cinq atteints d’AOMI y ont une manifestation dans un autre lit vasculaire (61,5% dans ≥1; 48% dans 2 et 13,5% dans 3). Le taux d’événements graves à un an (décès d’origine CV, AVC non fatal et IM) augmente alors nettement avec le nombre de lits vasculaires symptomatiques, allant de 2,2% (chez les patients présentant uniquement des facteurs de risque) à 9,2% (chez les patients présentant une maladie vasculaire cardiaque, cérébrale et périphérique documentée).38
Dans plusieurs études évaluant de nouveaux traitements hypolipémiants ou antithrombotiques dans le domaine de la prévention CV, telles que l’étude FOURIER (Further Cardiovascular Outcomes Research With PCSK9 Inhibition in Patients With Elevated Risk) et l’étude COMPASS (Cardiovascular Outcomes for People Using Anticoagulation Strategies), les patients souffrant de maladies polyvasculaires présentaient un risque plus élevé que les patients sans ces maladies, ce qui s’est traduit par une réduction plus importante du risque absolu grâce à ces nouveaux traitements.39,40 Dans l’étude FOURIER, p.ex., l’association AOMI et IM/AVC présentait, comme on pouvait s’y attendre, le risque le plus élevé d’événements CV graves (mortalité CV, IM et AVC), avec un risque à 2,5 ans de 14,9%. Il est intéressant de noter qu’une AOMI sans IM/AVC présentait un risque plus élevé d’événements CV indésirables sévères (10,3%) qu’un IM/AVC sans AOMI (7,6%).
L’AOMI – un défi de taille!
Mise en œuvre insuffisante du traitement préventif basé sur des preuves
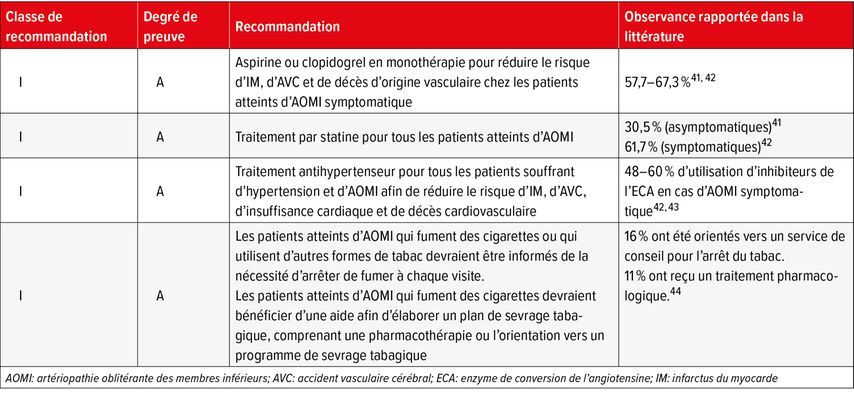
Toutes les lignes directrices internationales désignent les antiagrégants plaquettaires, les statines, les antihypertenseurs, le contrôle de la glycémie et le sevrage tabagique comme des recommandations de classe I (forte) et IIa (modérée). En dépit de ces recommandations de lignes directrices fondées sur des preuves, les patients atteints d’AOMI continuent d’être drastiquement sous-traités (Tab. 4). Dans une analyse de personnes atteintes d’AOMI (définies par un ABI ≤0,9) issue de la NHANES, l’utilisation d’aspirine, de statines et d’inhibiteurs du système rénine-angiotensine (iSRA) n’était que de 35,8%, 30,5% et 24,9%, respectivement (Tab. 4).41 Une étude plus récente portant sur des patients ayant subi une revascularisation périphérique – un sous-groupe présentant un risque particulièrement élevé de complications CV et ischémiques aux extrémités – a fait état de l’utilisation d’aspirine, d’antagonistes des récepteurs P2Y12 (tels que le clopidogrel) et d’iSRA chez uniquement 67,3%, 57,7% et 47,6% des patients à leur sortie de l’hôpital, respectivement. Seuls 61,7% des patients ont reçu une statine.42
Tab. 4: Lignes directrices internationales sur l’AOMI: recommandations de classe I (niveau de preuve A) et leur mise en œuvre dans la pratique clinique
Dans ce contexte, les résultats d’une analyse systématique récente sur les connaissances et le degré de notoriété de l’AOMI ne sont pas surprenants. Dans cet essai, seuls 61% des médecins généralistes avaient examiné leurs patients pour dépister une AOMI et seuls 6% connaissaient les lignes directrices pour un traitement fondé sur des preuves. Parmi les patients et le public, le pourcentage de personnes connaissant l’AOMI varie entre 21% et 61%. Le manque de sensibilisation des patients et des professionnels de santé contribue de manière décisive à un traitement retardé et/ou insuffisant.45 Ainsi, il n’est pas rare que les douleurs de claudication, en particulier de la région fessière et de la plante des pieds, soient d’abord attribuées à d’autres pathologies, principalement neurologiques et/ou orthopédiques.
Un important facteur dans la non-perception de l’AOMI réside certainement dans la méconnaissance et l’appréciation du mauvais pronostic de l’AOMI. Dans ce contexte, l’usage, parfois, du terme «périphérique» pour qualifier cette maladie, suggère qu’elle serait anodine. Cette idée est – comme nous l’avons montré – clairement fausse!
La sensibilisation à tous les aspects de l’AOMI, y compris la définition, le diagnostic, les manifestations cliniques et les complications, est essentielle pour améliorer le pronostic global dans cette population en augmentation et sous-traitée.
Littérature:
1 Sundaram V et al.: Eur Heart J 2020; 41: 1636-49 2 Song P et al.: Lancet Glob Health 2019; 7: e1020-30 3 Szenarien zur Bevölkerungsentwicklung der Kantone 2015–2045, Quelle: Bundesamt für Statistik, Schweiz 4 American Diabetes Association: Diabetes Care 2013; 26: 3333-41 5 Zhang Y et al.: PLoS One 2012; 7: e42551 6 Adler AI et al.: Diab Care 2002; 25: 894-9 7 Ding N et al.: J Am Coll Cardiol 2019; 74: 498-507 8 Lu Y et al.: Eur J Prev Cardiol 2020; 27: 51-9 9 Peters F et al.: Eur J Vasc Endovasc Surg 2020; 60: 421-9 10 Pande RL, Creager MA: Circ Cardiovasc Qual Outcomes 2014; 7: 532-9 11 Vart P et al.: J Am Heart Assoc 2017; 6: e004995 12 Hirsch AT et al.: Circulation 2006; 113: 463-654 13 Diehm C et al.: Circulation 2009; 120: 2053-61 14 Agarwal S et al.: J Am Coll Cardiol 2016; 67: 1901-13 15 Unwin N: Br J Surg 2000; 87: 328-37 16 Reinecke H et al.: Eur Heart J 2015; 36: 932-8 17 Abu Dabrh AM et al.: J Vasc Surg 2015; 62: 1642-51 18 Cambou JP et al.: Eur J Vasc Endovasc Surg 2010; 39: 577-85 19 Duff S et al.: Vasc Health Risk Manag 2019; 15: 187-208 20 Kieback AG et al.: PLoS One 2019; 14: e0224608 21 Fowkes FG et al.: JAMA 2008; 300: 197-208 22 Goldberg JB et al.: J Vasc Surg 2012; 56: 1663-8 23 Goodney PP et al.: J Vasc Surg 2009; 50: 54-60 24 Malyar N et al.: J Diab Compl 2016; 30: 1117-22 25 Bild DE et al.: Diabetes Care 1989; 12: 24-31 26 Humphries MD et al.: J Vasc Surg 2016; 64: 1747-55.e3 27 Prompers L et al.: Diabetologia 2007; 50: 18-25 28 Goodney PP et al.: J Vasc Surg 2009; 49: 1431.e1-1439.e1 29 American Cancer Society: Cancer Facts & Statistics. American Cancer Society. http://cancerstatisticscenter.cancer.org/ . Accessed November 3, 2019 30 Selvin E, Erlinger TP: Circulation 2004; 110: 738-43 31 Leskinen Y et al.: Am J Kidney Dis 2002; 40: 472-9 32 United States Renal Data System. Annual Data Report: Epidemiology of Kidney Disease in the United States. Bethesda, MD: National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases; 2018 33 Liew YP et al.: Clin J Am Soc Nephrol 2008; 3: 1084-9 34 Otmann J et al.: J Vasc Surg 2012; 56: 737-45.e1 35 Zlatanovi P et al.: Eur J Vasc Endovasc Surg 2018; 56: 78-86 36 Owens CD et al.: J Vasc Surg 2007; 45: 944-52 37 Engelhardt M et al.: Eur J Vasc Endovasc Surg 2012; 43: 55-61 38 Steg PG et al.: JAMA 2007; 297: 1197-206 39 Bonaca MP et al.: Circulation 2018; 137: 338-50 40 Steffel J et al.: Circulation 2020; 142: 40-8 41 Pande RL et al.: Circulation 2011; 124: 17-23 42 Hess CN et al.: J Am Coll Cardiol 2018; 72: 999-1011 43 Armstrong EJ et al.: J Am Heart Assoc 2014; 3: e000697 44 Patel KK et al.: J Am Heart Assoc 2018; 7: e010076 45 Bridgwood BM et al.: Vasc Med 2020; 25: 263-73
Das könnte Sie auch interessieren:
Revue de presse: L’importance d’objectifs thérapeutiques centrés sur les patient·es dans la SLA
Dans une revue récente, Chio et al., mettent en lumière la nécessité de repenser les critères d’évaluation dans les essais cliniques portant sur la sclérose latérale amyotrophique (SLA ...
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...