Endocardite après un TAVI
Auteure:
PD Dre méd. Anna Conen, MSc
Klinik für Infektiologie und Infektionsprävention
Kantonsspital Aarau
Tellstrasse 25
5001 Aarau
E-mail: anna.conen@ksa.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’endocardite infectieuse (EI) est une complication connue survenant suite à un remplacement valvulaire aortique (RVA) chirurgical ou interventionnel. Même si l’incidence de l’EI semble similaire pour les deux formes de RVA, il existe pourtant des différences significatives entre ces deux tableaux cliniques. L’EI associée au TAVI semble survenir, de façon particulièrement fréquente, très tôt après la pose de la valve et être principalement causée par des entérocoques. Cet état de fait, mais aussi les taux élevés de morbidité et de mortalité liés à l’EI associée au TAVI, justifient des mesures d’hygiène et de prévention optimisées en phase péri-interventionnelle et post-interventionnelle. Des données du registre suisse des endocardites sur TAVI sont présentées ci-après.
Keypoints
-
Il faut s’attendre à une augmentation des nombres de TAVI, étant donné que de plus en plus de patients, également ceux qui présentent un risque périopératoire intermédiaire ou faible, sont traités.
-
L’incidence de l’endocardite infectieuse (EI) après un TAVI est de 1,0/100 personnes-années et est donc à peu près la même qu’après un remplacement valvulaire aortique chirurgical. L’incidence la plus élevée est observée très tôt après un TAVI (<100 jours).
-
Le spectre des agents pathogènes de l’EI après un TAVI diffère selon le moment de l’apparition de l’EI: les entérocoques dominent lors de la phase très précoce (<100 jours après le TAVI), alors que les S. aureus et les streptocoques alpha-hémolytiques sont prépondérants en phase tardive (>1 an après un TAVI).
-
Le taux de complications chez les patients atteints d’une EI associée au TAVI est élevé: le risque d’accident vasculaire cérébral est multiplié par 4 et le risque de mortalité multiplié par 6,5.
-
La prévention de l’endocardite est donc essentielle.
En 2002, une valve aortique a été implantée pour la première fois par cathétérisme cardiaque chez un patient présentant une sténose valvulaire aortique symptomatique («transcatheter aortic valve implantation», TAVI). Depuis lors, cette méthode est devenue un traitement standard de la sténose valvulaire aortique symptomatique sévère. Alors qu’initialement, surtout les patients présentant un risque périopératoire élevé étaient traités par TAVI, le TAVI s’est également avéré efficace et au moins équivalent au remplacement valvulaire aortique (RVA) chirurgical chez les patients présentant un risque périopératoire intermédiaire et faible.1–3 Sur la base de ces résultats d’études favorables, mais aussi en raison des progrès techniques et de la simplification des procédures, le TAVI est devenu une méthode thérapeutique largement acceptée de la sténose valvulaire aortique symptomatique, ce qui se reflète dans le nombre de cas en nette augmentation.
L’endocardite infectieuse (EI) est une complication connue survenant après un RVA chirurgical, mais aussi après un TAVI, qui a un impact important sur la morbidité, la mortalité et les coûts de santé.4 L’EI après un TAVI a été décrite pour la première fois en 2010.5 D’après une vaste étude de registre internationale (20006 patients ayant bénéficié d’un TAVI, dont 250 patients présentant une EI), l’incidence de l’EI après un TAVI est de 1,1/100 personnes-années (IC à 95%: 1,1–1,4).6 Cette incidence est donc comparable à celle observée après un RVA chirurgical, et ce bien que de nombreuses interventions TAVI soient réalisées dans un laboratoire de cathétérisme et non pas au bloc opératoire, ce qui pourrait se traduire par des différences en termes de mesures de prévention des infections. D’autre part, la durée de l’intervention et la surface de la plaie sont nettement plus importantes dans le cas du RVA chirurgical, ce qui pourrait favoriser un taux d’infection plus élevé.1,3,7–9 Il existe toutefois des différences pertinentes concernant le spectre des agents pathogènes entre l’EI après un RVA chirurgical (avant tout des staphylocoques) et après un TAVI (majoritairement des entérocoques). Ces différences peuvent notamment s’expliquer par le fait que les patients TAVI sont nettement plus âgés et ont plus de comorbidités, qu’ils ont davantage de contacts avec le système de santé et présentent donc une modification de la colonisation cutanée; mais la technique d’intervention utilisée joue aussi un rôle. Le TAVI est, dans la majorité des cas, inséré par voie inguinale, la flore de la région inguinale étant différente de la flore cutanée dans la zone thoracique, qui est, elle, pertinente pour le RVA chirurgical.7,10–14
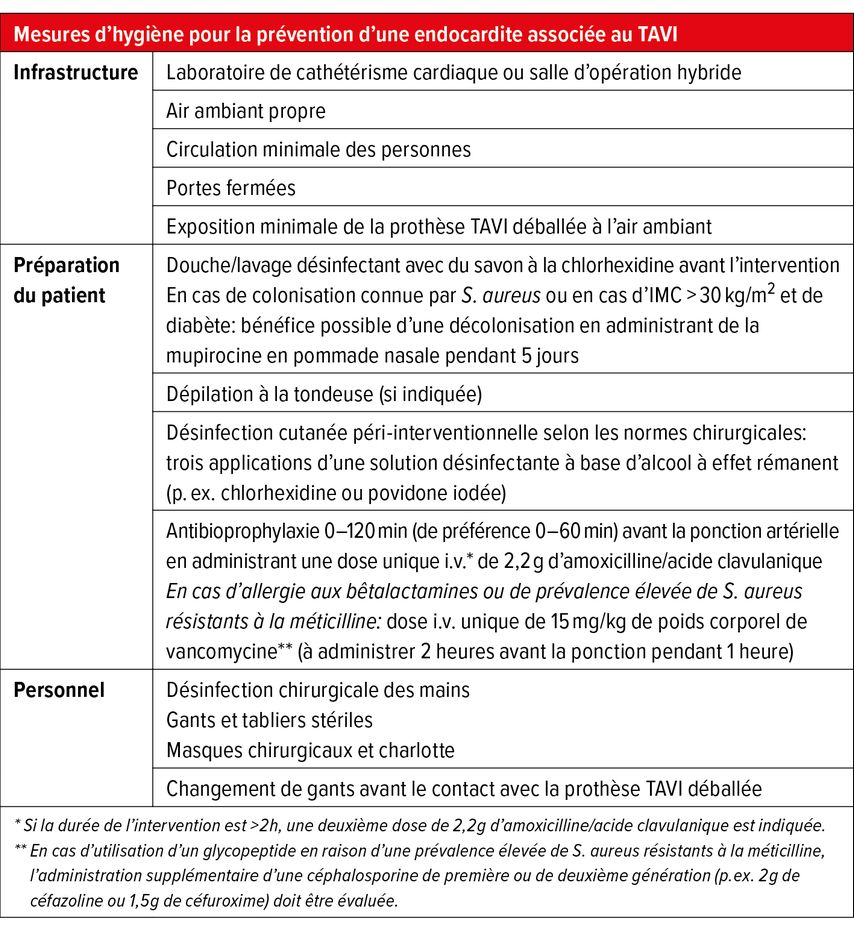
Prévention
Contrairement au RVA chirurgical, pour lequel l’OMS et les sociétés médicales ont publié des recommandations concernant la prévention de l’EI, il n’y en avait aucune jusqu’à récemment pour les patients ayant subi un TAVI.15–17 Ce n’est qu’en 2021 qu’ont été publiées, en collaboration avec la Société internationale des maladies infectieuses cardiovasculaires (ISCVID), des recommandations concernant la prévention des infections en lien avec l’infrastructure (laboratoire de cathétérisme ou salle d’opération hybride), la préparation des patients et les mesures à prendre par le personnel.18 Il est à noter qu’une antibioprophylaxie adaptée tient compte des agents pathogènes fréquents mentionnés ci-dessus (y compris les entérocoques) (Tab. 1). Ces efforts de prévention optimisés sont essentiels dans ce contexte, dans la mesure où le taux de mortalité de l’EI associée au TAVI se chiffrant à 30 à 40% à l’hôpital, est l’un des plus élevés après une EI.6,8,11,19
Registre suisse des endocardites sur TAVI
En Suisse, des procédures TAVI sont pratiquées depuis 2007. Conformément à la décision de l’OFSP, depuis 2011, tous les patients sont inclus dans une étude de cohorte nationale, multicentrique et prospective (Swiss TAVI Registry) à des fins de contrôle de la qualité et d’indemnisation financière. La collecte des données se fait par voie électronique et les événements cliniques, y compris l’EI, sont validés par un comité d’événements défini. Les premiers résultats du registre suisse des endocardites sur TAVI, un sous-registre du Swiss TAVI Registry, sont présentés ici.20
Population de l’étude et définitions
Entre 02/2011 et 07/2018, 7203 patients de 15 hôpitaux ont été inclus dans le Swiss TAVI Registry. Dans ce contexte, les patients répondaient à la définition d’une EI si celle-ci était classée selon les critères de Duke soit comme une EI définitive, soit comme une EI possible, traitée en tant que EI.21 L’EI était classifiée, en fonction de la date de survenue, en EI survenant en phase périprocédurale (<100 jours après le TAVI), en EI survenant à retardement (≥100 jours, mais <12 mois après le TAVI) et en EI tardive (≥12 mois après le TAVI). L’EI survenant en phase périprocédurale et l’EI survenant à retardement ont été regroupées sous l’étiquette d’EI précoce.
Résultats
Au total, 149 patients (5,8%) ont été atteints d’une EI associée au TAVI. Les patients ayant présenté une EI avaient un âge moyen de 80,1 ans (±8,0) et 31,5% étaient des femmes. Ces caractéristiques étaient significativement différentes de celles des patients ne présentant pas d’EI (n=7054), dont l’âge moyen était de 82,0 ans (±6,4) et dont 50,1% étaient des femmes. Aucune différence significative n’a été observée concernant les prévalences des comorbidités et les paramètres suivants: diabète (29,5%), dyslipidémie (54,4%), hypertension artérielle (83,9%), coronaropathie (55,0%), intervention chirurgicale cardiaque préalable (14,8%), BPCO (13,4%), artériopathie occlusive périphérique (15,4%) et maladie cérébrovasculaire (12,1%). La fraction d’éjection ventriculaire gauche moyenne était de 53,8% (±15,5) et le risque périopératoire a été évalué à un STS-PROM («Society of Thoracic Surgeons Predicted Risk of Mortality») moyen de 5,0 (±3,9).
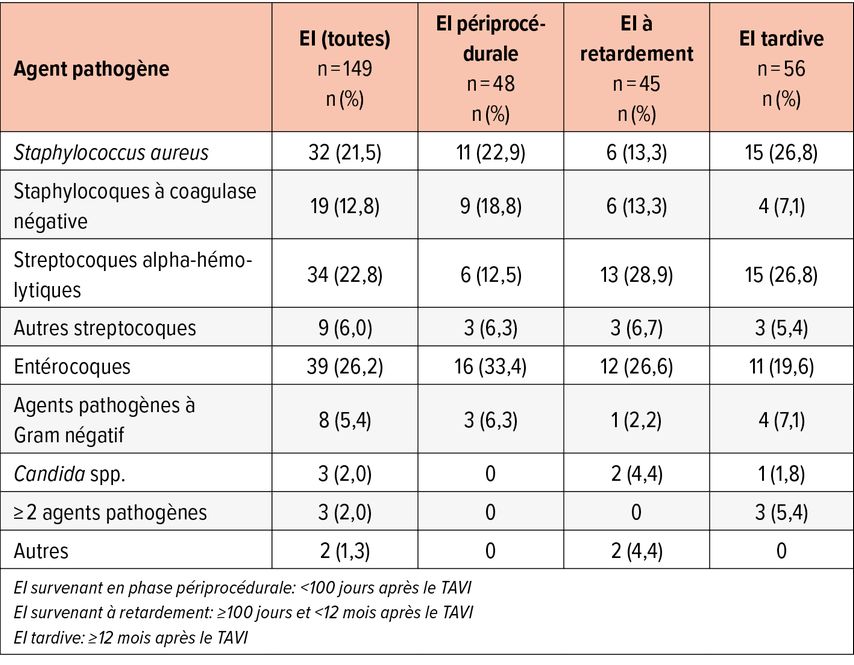
Tab. 2: Spectre d’agents pathogènes de l’endocardite infectieuse (EI) subdivisé en fonction du moment d’apparition après le TAVI
Incidence de l’EI après un TAVI
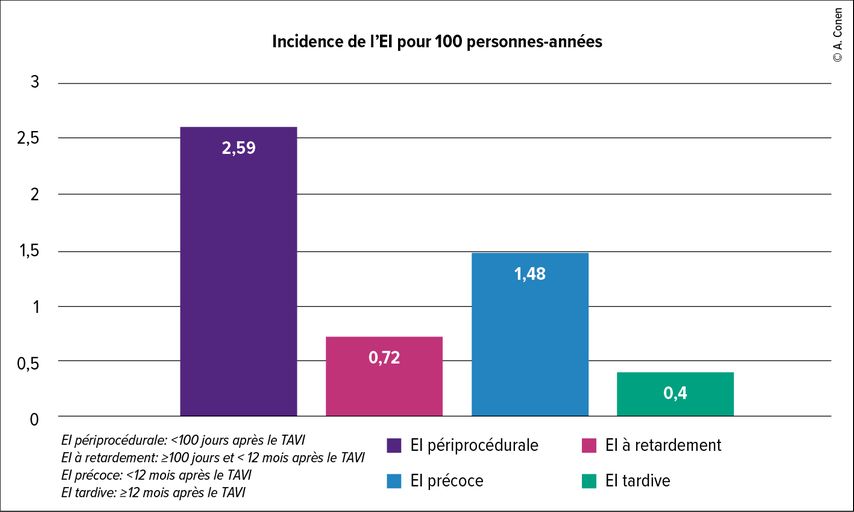
Pendant la période d’observation de cinq ans, l’incidence de l’EI était de 1,0/100personnes-années (IC à 95%: 0,85–1,17). Il était intéressant d’observer que l’incidence de l’EI survenant en phase périprocédurale était particulièrement élevée avec 2,59/100personnes-années (IC à 95%: 1,95–3,44). L’EI survenant à retardement présentait une incidence de 0,72/100personnes-années (IC à 95%: 0,54–0,97) et l’EI tardive une incidence de 0,40/100personnes-années (IC à 95%: 0,31–0,53) (Fig. 1).
Fig. 1: Incidence de l’endocardite infectieuse (EI) pour 100 personnes-années subdivisée en fonction du moment d’apparition après le TAVI
Caractéristiques spécifiques à l’endocardite
Au total, 94 patients (63,1%) remplissaient les critères d’une EI définitive selon les critères de Duke. On disposait d’hémocultures positives pour pratiquement tous les patients (n=148, 99,3%). Les résultats de l’échocardiographie ont été jugés comme étant non concluants ou normaux dans 47,7% des cas, 36,2% présentaient des végétations, 9,4% un abcès local et 8,7% une insuffisance valvulaire nouvellement apparue.
Les résultats microbiologiques sont résumés dans le Tableau 2. Globalement, les entérocoques étaient dominants (26,2%), suivis des streptocoques alpha-hémolytiques (22,8%) et des Staphylococcus aureus (21,5%). Fait intéressant: la répartition des micro-organismes en fonction de la date d’apparition de l’EI après le TAVI, selon laquelle les entérocoques dominaient surtout dans le contexte de l’EI précoce (30,1%) et les streptocoques alpha-hémolytiques et S. aureus dans le contexte de l’EI tardive (26,8% pour ces deux derniers).
En comparaison avec les patients ne présentant pas d’EI, le TAVI chez les patients atteints d’EI a été posé plus souvent en laboratoire de cathétérisme qu’en salle d’opération hybride (55,7% vs 42,8%; p=0,024). En outre, les patients atteints d’EI ont reçu plus souvent une valve expansible mécaniquement (13,3% vs 4,2%; p<0,001) et ont subi plus rarement une prédilatation par valvuloplastie par ballonnet (57% vs 63,5%; p=0,003).
L’analyse multivariable a permis d’identifier différents facteurs de risque d’EI après un TAVI. En termes de caractéristiques des patients, il s’agissait de l’âge jeune (HR: 0,97; IC à 95%: 0,94–0,99) et du sexe masculin (HR: 1,99; IC à 95%: 1,40–2,82) tandis que la réalisation de l’intervention en laboratoire de cathétérisme et non pas en salle d’opération hybride (HR: 1,65; IC à 95%: 1,19–2,29) et l’absence de prédilatation par valvuloplastie par ballonnet (HR: 1,49; IC à 95%: 1,07–2,07) étaient les facteurs déterminants en phase périprocédurale.
Il est aussi à noter que 47,9% des patients présentant une EI survenant en phase périprocédurale ont reçu une antibioprophylaxie inadéquate lors de la procédure TAVI qui consistait en majorité en l’administration d’une céphalosporine de première ou de deuxième génération.
Pronostic
Lors de l’analyse du pronostic concernant la mortalité et l’accident vasculaire cérébral (AVC), une approche «de cas-témoins appariés» a été utilisée et 148 patients atteints d’EI ont été comparés à 579 témoins appariés ne présentant pas d’EI. L’appariement 1:4 a pris en compte le délai jusqu’au diagnostic d’EI après le TAVI et a été effectué en fonction de l’âge, du sexe, de l’année de la procédure TAVI et du STS-PROM. Pour l’ensemble des patients présentant une EI, le HR pour la mortalité était de 6,55 (IC à 95%: 4,44–9,67) et le HR pour l’AVC était de 4,03 (IC à 95%: 1,54–10,52). Subdivisés en fonction de la date de survenue de l’EI après le TAVI, les patients atteints d’EI ont présenté une mortalité plus élevée dans toutes les catégories, avec un HR de 7,19 (EI survenant en phase périprocédurale), de 5,05 (EI survenant à retardement) et de 7,34 (EI tardive), mais seuls les patients atteints d’EI tardive ont présenté un risque significativement plus élevé d’AVC (HR: 11,92; IC à 95%: 2,76–51,53).
Discussion
Globalement, l’incidence de l’EI associée au TAVI en Suisse est de 1,0/100personnes-années, ce qui se situe dans la fourchette des incidences décrites dans la littérature.6 L’incidence était particulièrement élevée lors de la phase périprocédurale (<100 jours après le TAVI), les entérocoques étant les agents pathogènes les plus fréquents chez ces patients. Il est à noter que près de la moitié des patients présentant une EI survenant en phase périprocédurale ont reçu une antibioprophylaxie inadéquate lors de la procédure TAVI. Certainement en raison du fait qu’au moment de l’étude, la prophylaxie recommandée consistait en l’administration d’une céphalosporine de première ou de deuxième génération, qui présentent toutes deux une faille vis-à-vis des entérocoques. Les recommandations décrites ci-dessus concernant la prévention des infections en cas de TAVI devraient permettre d’optimiser ce point, notamment la recommandation d’une antibioprophylaxie péri-interventionnelle active contre les entérocoques par l’administration d’amoxicilline/acide clavulanique (Tab. 1).18 Le taux élevé de streptocoques alpha-hémolytiques (22,8% au total, 26,8% en présence d’EI tardive) plaide également en faveur d’un potentiel d’amélioration de la prophylaxie, dans la mesure où les patients ayant subi un TAVI, tout comme les patients ayant subi un RVA chirurgical, devraient bénéficier d’un traitement régulier d’hygiène dentaire avant et après la pose de la valve et, si nécessaire, d’un traitement médico-dentaire. Les patients ayant subi un TAVI doivent être en possession d’un certificat d’endocardite afin que la nécessité d’une antibioprophylaxie avant des interventions définies soit clairement établie.
Fig. 2: En cas d’endocardite infectieuse après un TAVI, on observe le plus souvent des entérocoques, suivis des streptocoques alpha-hémolytiques et des Staphylococcus aureus
Les facteurs de risque connus d’une EI après un TAVI, tels que l’âge jeune et le sexe masculin, sont ceux qui sont mentionnés dans la littérature.6 Le fait que la réalisation de l’intervention en laboratoire de cathétérisme et non pas en salle d’opération hybride soit associée à un risque accru d’EI est toutefois nouveau. Là aussi, les aspects concernant l’hygiène peuvent expliquer cet état de fait; ils sont peut-être mieux définis et plus strictement respectés en salle d’opération hybride, notamment parce que le personnel y est régulièrement formé. Ainsi, l’observance des normes de désinfection chirurgicale pourrait être meilleure, la circulation des personnes moins importante et la connaissance de la nécessité d’une asepsie absolue lors de la manipulation d’implants plus familière. Il s’agit toutefois de spéculations qui devraient être évaluées rigoureusement dans le cadre d’une étude prospective avant que la procédure TAVI en laboratoire de cathétérisme puisse être considérée comme un facteur de risque définitif.
Non seulement la morbidité des patients souffrant d’une EI après un TAVI, mais également la mortalité sont considérables. La mortalité est l’une des plus élevées qui soit et se situe entre 30 et 40% à l’hôpital, ce qui peut certainement s’expliquer par une population de patients généralement polymorbides et d’un âge avancé.6 Dans le cadre de l’analyse actuelle, le risque de mortalité était presque sept fois plus élevé pour les patients atteints d’EI, le risque accru étant présent dans tous les intervalles de temps définis après le TAVI (EI survenant en phase périprocédurale, EI survenant à retardement, EI tardive). Le risque quatre fois plus élevé d’AVC était surtout présent chez les patients atteints d’EI tardive après un TAVI, ce qui pourrait s’expliquer par le taux plus élevé d’infections à S. aureus.
En raison du mauvais pronostic en cas d’EI associée à un TAVI, des mesures d’hygiène et de prévention péri-interventionnelles et post-interventionnelles optimisées revêtent une énorme importance.
Littérature:
1 Leon MB et al.: N Engl J Med 2016; 374: 1609-20 2 Mack MJ et al.: N Engl J Med 2019; 380: 1695-705 3 Mack MJ et al.: Lancet 2015; 385: 2477-84 4 Heredia-Rodriguez M et al.: J Gen Intern Med 2018; 33: 1610-3 5 Carnero-Alcazar M et al.: Interact Cardiovasc Thorac Surg 2010; 11: 252-3 6 Regueiro A et al.: JAMA 2016; 316: 1083-92 7 Kolte D et al.: Am J Cardiol 2018; 122: 2112-9 8 Moriyama N et al.: EuroIntervention 2019; 15: e500-7 9 Butt JH et al.: J Am Coll Cardiol 2019; 73: 1646-55 10 Regueiro A et al.: Circ Cardiovasc Interv 2019; 12: e007938 11 Amat-Santos IJ et al.: Circulation 2015; 131: 1566-74 12 Slipczuk L et al.: PLoS One 2013; 8: 1-17 13 Mangner N et al.: J Am Heart Assoc 2018; 7: e010027 14 Oliver L et al.: Heart 2017; 103: 1602-9 15 Allegranzi B et al.: Lancet Infect Dis 2016; 16: e288-303 16 WHO: Global guidelines on the prevention of surgical site infection. Geneva: World Health Organisation, 2016. Accessed 15.5.2019 17 Habib G et al.: Eur Heart J 2015; 36: 3075-128 18 Conen A et al.: EuroIntervention 2020; 16: 1135-40 19 Lalani T et al.: JAMA Intern Med 2013; 173: 1495-504 20 Stortecky S et al.: J Am Coll Cardiol 2020; 75: 3020-30 21 Li JS et al.: Clin Infect Dis 2000; 30: 633-8
Das könnte Sie auch interessieren:
Modulateurs du récepteur de la sphingosine-1-phosphate dans le traitement de la SEP
Les modulateurs du récepteur de la sphingosine-1-phosphate représentent une classe de médicaments prometteurs pour le traitement de deuxième ligne de la sclérose en plaques (SEP). Deux ...
Présentation des données pertinentes pour la pratique sur le mavacamten dans la CMHO
Le mavacamten, un inhibiteur de la myosine, a été la première substance de cette classe à être autorisée en 2023 pour le traitement de la cardiomyopathie hypertrophique obstructive (CMHO ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...