Diverticulite du côlon: quand opérer?
Auteurs:
Dre méd. Vaihere Delaune1,2
Dr méd. Nicolas Christian Buchs1
Dre méd. Emilie Liot1
Prof. Dr méd. Frédéric Ris1
1 Service de chirurgie viscérale Hôpitaux Universitaires de Genève
2 Laboratoire de chirurgie et transplantation Centre Médical Universitaire
Université de Genève
E-mail: vaihere.delaune@hcuge.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
L’incidence de la diverticulite a considérablement augmenté au cours des dernières décennies et de plus en plus de jeunes patients sont concernés. La prise en charge de cette pathologie est devenue plus conservatrice. Cet article vise à résumer les éléments à prendre en compte pour proposer une intervention chirurgicale ou, en d’autres termes, savoir quand opérer.
Keypoints
-
Les diverticulites Hinchey 0 à II sont généralement traitées de manière conservative.
-
La chirurgie d’urgence comprend classiquement la résection du segment malade avec: soit une colostomie terminale, soit une anastomose d’emblée (plus-ou-moins protégée par une iléostomie latérale).
-
La sigmoïdectomie élective n’est plus une chirurgie de prévention de complications ou de récidives, mais une chirurgie d’amélioration de la qualité de vie, pondérée pour chaque patient.
-
Les règles hygiéno-diététiques (régime pauvre en viande rouge, perte de poids, sevrage tabagique, lutte contre la sédentarité) sont efficaces pour prévenir les récidives et doivent être privilégiées.
-
Le dépistage du cancer du côlon par coloscopie, en l’absence de coloscopie récente (<3ans) est primordial après un épisode de diverticulite (prévalence de 1,9% de cancer colorectal dans cette population).
La maladie diverticulaire du côlon, pathologie qui était seulement en émergence dans les années 1970,1 est de nos jours un des troubles du système digestif les plus fréquents du monde occidental.2 La maladie diverticulaire du côlon est définie comme une diverticulose colique devenue symptomatique (infection/inflammation et/ou saignement de diverticule).3
La diverticulose colique augmente avec l’âge; sa prévalence est estimée à environ 50% des patients dès 60 ans.4 Ce chiffre augmente à plus de 70% pour les plus de 80 ans.4,5 Néanmoins, le taux recensé de diverticulite du côlon a flambé ces dernières décennies, surtout chez les patients jeunes; ainsi, en moins de trois décennies (1980–2007), son incidence a augmenté de 132% chez les quadragénaires.6 Au total, entre 10 à 35% de la population porteuse d’une diverticulose colique présentera une maladie diverticulaire (infection/inflammation ou saignement).7
Cette augmentation significative de l’incidence de la maladie diverticulaire, et l’augmentation des connaissances, a conduit à un changement progressif des modèles de prise en charge. Il est donc essentiel pour les chirurgiens de redéfinir les indications opératoires, moins tranchées que celles de nos prédécesseurs, en prenant en compte les dernières publications.
Définitions, physiopathologie et facteurs de risque
Le diverticule colique que nous retrouvons classiquement dans la population occidentale est en réalité un «faux», ou pseudo-diverticule. En effet, c’est une herniation de la muqueuse et la sous-muqueuse au travers de la musculeuse du côlon, au niveau des zones de faiblesses induites par les points d’entrée des vasa recta. Ces pseudo-diverticules sont le plus souvent retrouvés sur le côlon gauche et sigmoïde, mais peuvent être présents sur tout le cadre colique. Les «vrais» diverticules, soit une herniation de toute la paroi colique (y compris la musculeuse), sont généralement retrouvés dans la population orientale, et sont plutôt localisés au niveau du côlon droit.8
La physiopathologie exacte de la survenue des diverticules n’est pas formellement établie, néanmoins plusieurs théories ont été avancées.4 La théorie la plus répandue est celle d’une surpression intraluminale, anatomique au niveau de la charnière recto-sigmoïdienne, qui serait accentuée par un transit ralenti; la survenue des diverticules serait facilitée par le vieillissement tissulaire et une augmentation de l’élasticité des tissus. Dans la dernière décennie, les regards se sont tournés vers la dégénérescence neurologique du tissu colique pouvant entraîner un péristaltisme anarchique avec augmentation des pressions intraluminales,9 et également vers une possible origine génétique.10
Historiquement, nous retenons la stagnation de matière fécale dans les diverticules comme étant à l’origine des diverticulites, entraînant une pullulation bactérienne avec érosion de la muqueuse. Néanmoins, des théories plus récentes évoquent la possibilité d’une inflammation chronique à bas bruit liée à une dysbiose intestinale,11 ou même une origine ischémique chez les patients jeunes.12
Du fait de l’incertitude physiopathologique, plusieurs facteurs de risque sont évoqués. Le régime pauvre en fibres, longtemps incriminé dans la survenue de la diverticulose colique,1 semble plutôt être un facteur de risque de déclaration de maladie diverticulaire quand il est combiné avec une consommation importante de viande.13 Contrairement à ce qui a longtemps été évoqué, la consommation de noix et de graines n’augmente pas le risque de saignement ou d’infection de diverticule.7 Les autres facteurs de risque de la maladie diverticulaire sont l’obésité, le tabagisme (relation dose-dépendante),14 la sédentarité, et certains médicaments (stéroïdes, anti-inflammatoires non-stéroïdiens)4.
Diagnostic et classification de la diverticulite du côlon
Généralement les patients présentent des douleurs de la fosse iliaque gauche, pouvant irradier en hypogastrique et/ou en fosse iliaque droite. Ils ont souvent un état fébrile associé et un syndrome inflammatoire biologique. Néanmoins, l’ensemble de ces signes ne permet en général pas d’établir le diagnostic (moins de 50% des cas.) Il y a peu de corrélation entre les signes cliniques et la sévérité de l’infection.3
Le scanner abdominal avec contraste intraveineux (plus-ou-moins contraste oral et/ou rectal) est l’examen radiologique de référence.15 Il nous permet de confirmer le diagnostic et de déterminer la sévérité de l’infection afin d’adapter la prise en charge. L’échographie abdominale peut être une option, si elle est réalisée par un radiologue expérimenté; elle peut en revanche méconnaître la présence d’un abcès, et n’est pas très sensible dans la détection d’un diagnostic alternatif. L’IRM est très sensible et spécifique pour le diagnostic de la diverticulite, néanmoins c’est un examen coûteux et difficile à obtenir dans l’urgence.16 L’échographie et/ou l’IRM abdominale sont des examens tout à fait acceptables pour faire le diagnostic de diverticulite chez la femme enceinte.
Les diverticulites peuvent être classées en deux grandes catégories: non-compliquée, et compliquée. La diverticulite non-compliquée, ou simple, présente un épaississement des parois coliques et une infiltration de la graisse péricolique centrée sur un diverticule. La diverticulite compliquée peut être divisée en deux sous-classes: aiguë – avec présence d’un abcès et/ou de signes de perforation en péritoine libre; chronique – fistuleuse (vessie, vagin, peau, autre organe), ou sténosante (pseudo-tumeur inflammatoire).3
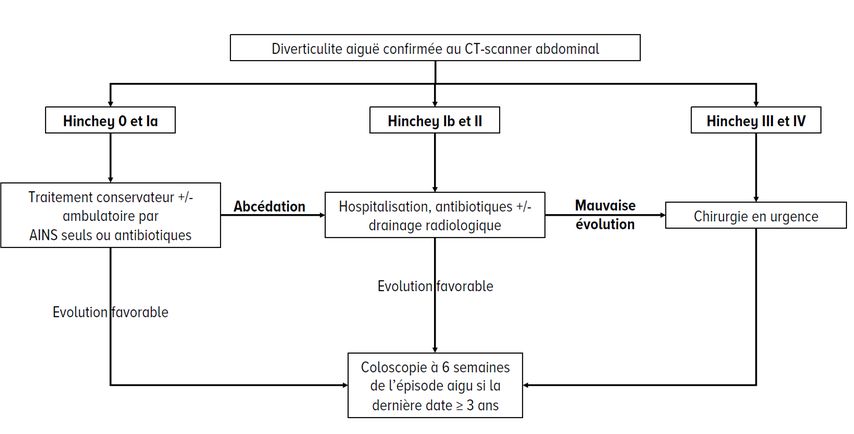
Cette classification est néanmoins un peu simpliste et ne permet pas de distinguer certaines subtilités, notamment de la diverticulite aiguë compliquée. Ainsi, de nombreuses autres classifications, résumées dans le Tableau 1, ont été développées ces dernières décennies afin de pouvoir adapter au mieux la prise en charge.17,18 La première de ces classifications, décrite par Hinchey en 1978, était une détermination peropératoire de la sévérité de la diverticulite;19 elle a, depuis, été adaptée au scanner. Quelle que soit la classification utilisée, la distinction entre les stades III (péritonite purulente) et IV (péritonite stercorale) n’est possible qu’au bloc opératoire. La Figure 1 résume, en image, ces différents stades.
Tab. 1: Classification des diverticulites aiguës. Classification originale selon Hinchey, qui était une détermination peropératoire développée en 1978. Modifications, adaptées à l’imagerie scannographique, de la classification originale. La distinction entre les stades III et IV ne peut être faite qu’au bloc opératoire
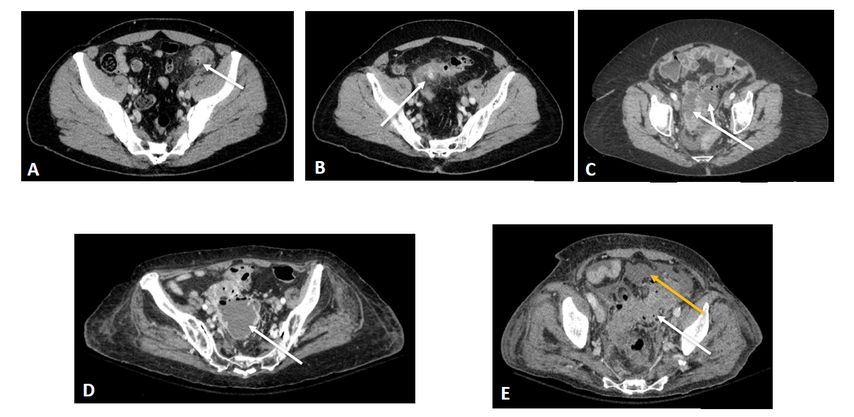
Fig. 1: Illustration de la classification modifiée de Hinchey selon Kaiser. A: Hinchey 0 – épaississement colique sans infiltration de la graisse péri-colique (flèche). B: Hinchey 1a – épaississement colique centré sur un diverticule avec infiltration de la graisse péricolique (flèche). C: Hinchey 1b – abcès confiné péri-colique (flèches). D: Hinchey 2 – abcès pelvien (flèche). E: Hinchey 3 ou 4 – épaississement sigmoïdien diverticulaire (flèche blanche), liquide libre (flèche jaune)
La classification dite «Hinchey» utilisée dans la suite de ce texte sera la classification de Hinchey modifiée selon Kaiser.20
Prise en charge de l’épisode aigu
Traitement conservateur
La prise en charge conservatrice est indiquée de première intention pour les diverticulites non-compliquées (Hinchey 0 et Ia) ou compliquées par un abcès (Hinchey Ib ou II).
Pour la diverticulite Hinchey 0 et Ia, de plus en plus de centres traitent les patients en ambulatoire avec une antibiothérapie per os.21 Trois études randomisées ont été encore plus loin dans le traitement conservateur, en démontrant la non-infériorité d’un traitement anti-inflammatoire seul (sans antibiotiques) pour les formes légères.22–24 Cette conclusion est validée par des méta-analyses récentes,25–27 et la prise en charge est désormais recommandée par plusieurs sociétés scientifiques et recommandations nationales, notamment dans les pays Scandinaves et aux Pays-Bas.3,28
Les diverticulites abcédées (Hinchey Ib et Hinchey II) chez des patients stables, sont généralement traitées en première intention par une antibiothérapie. Celle-ci peut être combinée à un drainage radiologique, si la taille de l’abcès est supérieure à 4cm et selon la fenêtre d’accès radiologique.3 Cette prise en charge aiguë conservatrice est efficace dans environ 80% des cas.28
Traitement chirurgical en urgence
Le traitement chirurgical en urgence d’un épisode aigu est indiqué en cas de mauvaise évolution d’une diverticulite traitée de manière conservative, de non-évolution d’une diverticulite abcédée malgré un drainage radiologique et une antibiothérapie optimale (environ 15 à 32% des patients28), en cas d’instabilité hémodynamique et/ou de péritonite.
Le choix de la voie d’abord et de la technique chirurgicale restent très controversées. Historiquement, la chirurgie urgente de la diverticulite, associant la résection sigmoïdienne avec une colostomie terminale en fosse iliaque gauche selon Hartmann, était recommandée pour la prise en charge en urgence des diverticulites compliquées. Néanmoins, jusqu’à 50% de ces patients gardent leur stomie à vie.29,30 Plusieurs études randomisées ont démontré que chez des patients hémodynamiquement stables et sans comorbidité majeure ayant une péritonite généralisée, une résection sigmoïdienne avec anastomose directe accompagnée d’une iléostomie de décharge était non-seulement comparable sur le plan morbi-mortalité, mais que ces patients avaient un taux nettement plus important de rétablissement de continuité.31–33 Cependant, le taux de complications augmente considérablement si l’anastomose primaire est effectuée en situation d’urgence par un chirurgien autre qu’un spécialiste en chirurgie colorectale.34 Par ailleurs une chirurgie urgente dite de «damage control» avec résection du segment intestinal incriminé, puis reprise chirurgicale à 36–48 heures avec anastomose directe semble être faisable dans certains cas sélectionnés.35 Malgré ces résultats encourageants, la chirurgie avec confection d’une colostomie selon Hartmann reste encore la plus utilisée36 et le choix de la chirurgie reste lié à l’appréciation du chirurgien, de sa spécialisation, des moyens locaux et de son expérience,3,28 même si les recommandations actuelles poussent en faveur d’un rétablissement direct.
Fig. 2: Algorithme de prise en charge de la diverticulite aiguë en fonction de la classification de Hinchey modifiée selon Kaiser
Enfin, malgré un engouement certain pour la préservation d’organe avec lavage laparoscopique seul pour une péritonite purulente (Hinchey III), les recommandations actuelles gardent la résection colique comme gold standard. En effet, les résultats des études randomisées sur le lavage laparoscopique ont peiné à montrer une supériorité par rapport au traitement conventionnel, avec des taux de complication similaires, une morbidité élevée, et un risque de non-diagnostic de maladie oncologique.37–39 Cette approche n’est donc validée que dans des cas très sélectionnés. La prise en charge de la diverticulite aiguë est résumée dans la Figure 2.
Indications de la chirurgie à distance de l’épisode aigu
La technique chirurgicale élective de choix est, de nos jours, la résection sigmoïdienne par voie minimalement invasive (laparoscopique) dans la mesure du possible. Elle comprend la résection du sigmoïde et de la charnière recto-sigmoïdienne, avec anastomose colorectale directe (sans stomie, en principe). Dans tous les cas, une première crise de diverticulite, ou une diverticulite compliquée d’un abcès, doivent être suivis d’une coloscopie de contrôle à 6 semaines de l’épisode aigu, en l’absence d’une coloscopie récente (<3 ans), pour ne pas méconnaître la présence d’un cancer sous-jacent.40
Les indications formelles à la chirurgie élective à distance de l’épisode aigu de deux types: les complications chroniques de la diverticulite (sténose colique; fistule entre le côlon et un autre organe); ou la découverte d’un cancer à la coloscopie.
Les indications chirurgicales relatives sont, quant à elles, à adapter individuellement pour chaque patient:
Nombre d’épisodes aigus
Le plus grand changement dans l’attitude chirurgicale de ces deux dernières décennies porte sur l’indication à une chirurgie élective après plusieurs épisodes de diverticulite non-compliquée. En effet, le dogme de «à partir de deux épisodes on opère» a progressivement été abandonné en faveur de l’évaluation selon le retentissement sur la qualité de vie du patient. Ce fameux dogme avait été instauré par crainte que le nombre de récidives et le risque d’une perforation menant à une stomie seraient augmentés après deux épisodes. Néanmoins, il a été démontré qu’il n’y a pas d’augmentation du risque de perforation avec le nombre de poussées,41,42 et que le risque de récidive au-delà de deux poussées aiguës est négligeable43. Ainsi, nous sommes passés d’une optique de prévention de complications à celle d’une amélioration de la qualité de vie des patients. La chirurgie élective de la maladie diverticulaire améliore grandement la qualité de vie des patients présentant des récidives fréquentes de diverticulite, diminue le risque de récidive à moins de 5%, mais la chirurgie expose à environ 10% de complications majeures.44
Immunosuppression
L’indication à une chirurgie «prophylactique» après un premier épisode de diverticulite chez les patients immunosupprimés reste débattue. Malgré les évidences de présentation clinique plus sévère chez les sujets transplantés et/ou sous corticothérapie au long cours,45,46 ces patients sont également exposés à une morbi-mortalité postopératoire plus élevée, raison pour laquelle la prise en charge doit d’être individualisée.
Douleurs persistantes
Un premier épisode aigu avec présence d’abcès et/ou la persistance d’une symptomatologie algique à distance de l’épisode aigu sont des indications relatives à une chirurgie élective, à pondérer et à discuter au cas par cas. Ce point est primordial, car les patients connus pour un côlon irritable présentent un risque relatif augmenté de récidive des douleurs après résection colique.47
L’indication à la chirurgie élective après un ou plusieurs épisodes de diverticulite (Tab. 2) est donc pondérée pour chaque patient selon ses comorbidités, le nombre d’épisodes et le retentissement des crises sur sa qualité de vie.3,28
Conclusion
L’incidence de la maladie diverticulaire est en constante augmentation depuis sa description dans les années 1970, notamment chez des patients de plus en plus jeunes. De ce fait, la prise en charge de cette pathologie est devenue nettement plus conservatrice ces dernières années. L’indication chirurgicale élective n’est plus orientée vers une prévention de récidives ou de survenue de formes graves, mais sur le retentissement sur la qualité de vie et/ou l’apparition de complications à distance de l’épisode aigu (douleurs, sténose, fistule). La prise en charge chirurgicale en urgence reste néanmoins nécessaire en cas de péritonite ou de mauvaise évolution d’une diverticulite.
Enfin, en raison d’une prévalence augmentée de cancer colorectal dans cette population (1,9%), les patients n’ayant pas eu de coloscopie récente (<3ans), doivent avoir une nouvelle coloscopie 6 semaines après l’épisode aigu.

Tab. 2: Indications à la chirurgie élective de la maladie diverticulaire
Littérature:
1 Burkitt DP et al.: JAMA 1974; 229: 1068-74 2 Strate LL, Morris AM: Gastroenterology 2019; 156: 1282-98.e1 3 Schultz JK et al.: Colorectal Dis 2020; 22 (Suppl 2): 5-28 4 Feuerstein JD, Falchuk KR: Mayo Clin Proc 2016; 91: 1094-104 5Everhart JE, Ruhl CE: Gastroenterology 2009; 136: 741-54 6 Bharucha AE et al.: Am J Gastroenterol 2015; 110: 1589-96 7 Strate LL et al.: JAMA 2008; 300: 907-14 8 Tursi A et al.: Aliment Pharmacol Ther 2015; 42: 664-84 9 Wedel T et al.: Neurogastroenterol Motil 2010; 22: 407-e94 10 Granlund J et al.: Aliment Pharmacol Ther 2012; 35: 1103-7 11 Simpson J et al.: Br J Surg 2003; 90: 899-908 12Piscopo N, Ellul P: Ulster Med J 2020; 89: 83-8 13 Crowe FL et al.: BMJ 2011; 343: d4131 14 Peery AF: N C Med J 2016; 77: 220-2 15 Laméris W et al.: Eur Radiol 2008; 18: 2498-511 16 Heverhagen JT et al.: Dis Colon Rectum 2008; 51: 1810-5 17 Stocchi L: World J Gastroenterol 2010; 16: 804-17 18 Bates DDB et al.: Abdom Radiol 2018; 43: 2060-5 19 Hinchey EJ et al.: Adv Surg 1978; 12: 85-109 20 Kaiser AM et al.: Am J Gastroenterol 2005; 100: 910-7 21 Biondo S et al.: Ann Surg 2014; 259: 38-44 22 Chabok A et al.: Br J Surg 2012; 99: 532-9 23 Daniels L et al.: Br J Surg 2017; 104: 52-61 24 Mora-López L et al.: Ann Surg 2021; 274: e435 25 Au S, Aly EH: Dis Colon Rectum 2019; 62: 1533-47 26 Desai M et al.: al.: Br J Surg 2020; 107: 1062-9 28 Hall J et al.: Dis Colon Rectum 2020; 63: 728-47 29 Salem L et al.: Dis Colon Rectum 2005; 48: 988-95 30Roig JV et al.: Cir Esp 2018; 96: 283-91 31 Oberkofler CE et al.: Ann Surg 2012; 256: 819-26; discussion 826-827 32 Bridoux V et al.: J Am Coll Surg 2017; 225: 798-805 33 Lambrichts DPV et al.: Lancet Gastroenterol Hepatol 2019; 4: 599-610 34 Goldstone RN et al.: Dis Colon Rectum 2019; 62: 71-8 35 Faes S et al.: BJS Open 2021; 5: zrab106 36 Cauley CE et al.: Dis Colon Rectum 2018; 61: 586-92 37 Angenete E et al.: Ann Surg 2016; 263: 117-22 38 Schultz JKet al.: JAMA 2015;314:1364-7539 Vennix S et al.: Lancet 2015; 386: 1269-77 40 Meyer J et al.: Clin Gastroenterol Hepatol 2019; 17: 1448-56.e17 41 Buchs NC et al.: Br J Surg 2013; 100: 976-9 42 Buc E et al.: Gastroentérologie Clin Biol 2007; 31: 35-46 43 Broderick-Villa G et al.: Arch Surg 2005; 140: 576-81; discussion 581-3 44 Santos A et al.: JAMA Surg 2021; 156: 129-36 45 Hwang SS et al.: Dis Colon Rectum 2010; 53: 1699-707 46 Oor JE et al.: J Gastrointest Surg Off J Soc Surg Aliment Tract 2014; 18: 2038-46 47 Choi KK et al.: Am Surg 2020; 86: 49-55 48 Wasvary H et al.: Am Surg 1999; 65: 632-5; discussion 636 49 Mora Lopez L et al.: Colorectal Dis 2013; 15: 1442-7 50 Sher ME et al.: Surg Endosc 1997; 11: 264-7 51 Siewert JR et al.: Chirurg 1995; 66: 1182-9 52 Hansen O et al.: Chirurg 1998; 69: 443-9
Das könnte Sie auch interessieren:
Revue de presse: L’importance d’objectifs thérapeutiques centrés sur les patient·es dans la SLA
Dans une revue récente, Chio et al., mettent en lumière la nécessité de repenser les critères d’évaluation dans les essais cliniques portant sur la sclérose latérale amyotrophique (SLA ...
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...