Diète cétogène & diabète
Auteur:
Dr méd. Christophe Kosinski
FMH en Endocrinologie & Diabétologie
FMH en Médecine Interne Générale
Service d’endocrinologie, diabétologie et métabolisme
Centre hospitalier universitaire vaudois (CHUV)
Av. de la Sallaz 8, 1011 Lausanne
E-mail: christophe.kosinski@chuv.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La diète cétogène est un sujet à la mode, parfois faussement définie dans la culture populaire, et source de débats dans la communauté scientifique. Néanmoins, elle illustre bien le concept de «Food as medicine», c’est-à-dire qu’un type de diète peut remplacer l’utilisation de médicaments.
Keypoints
-
La diète cétogène induit des effets glucométabolique positifs se maintenant au moins 3 à 6 mois.
-
Elle est relativement sûr chez les personnes avec un diabète de type 2 non insulinopéniques.
-
Elle est contraignante et associée à de nombreux effets indésirables initiaux.
-
Il est impératif que la pratique de cette diète soit fait sous supervision de professionnels de la santé ayant une expertise dans ce domaine.
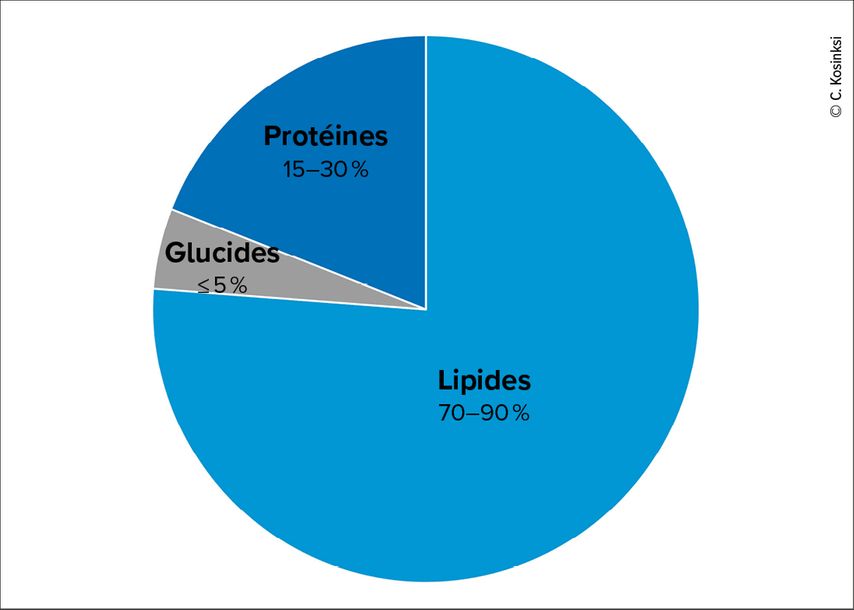
La diète cétogène consiste en un apport (très) élevé en graisses, tout en réduisant les glucides à généralement moins de 50g par jour,1 mais souvent ≤20g par jour (Fig. 1).2,3 Elle est souvent assimilée au régime «Atkins» et parfois confondue avec le régime pauvre en glucides («low carb») dans la littérature. La diète cétogène a été développé initialement dans les années 1920, pour traiter l’épilepsie réfractaire.4 Il a été observé que lorsque des personnes souffrant d’épilepsie sévère suivaient un jeûne prolongé, leurs symptômes s’amélioraient nettement. En effet, lors d’un jeûne prolongé, les sources d’énergie pour le cerveau varient selon la durée: initialement le glucose provenant surtout de sources exogènes, puis après plusieurs heures la majeure partie provient du glycogène hépatique. Ensuite, comme aucun aliment n’est apporté, les substrats de la néoglucogenèse proviennent du catabolisme musculaire, du pyruvate et du lactate, du glycérol, et dans une certaine mesure des corps cétoniques. La gluconéogenèse (GNG) est la sources d’énergie principale, tant que les réserves de glycogène sont présentes. Ensuite, la GNG diminue significativement et à ce moment-là, la source d’énergie provient essentiellement de l’oxydation des graisses, et donc des corps cétoniques.
Fig. 1: Exemple de composition d’une diète cétogène (les macronutriments sont exprimés en % de l’apport énergétique journalier)
La diète cétogène est aussi utilisée dans de multiples autres pathologies, notamment à but d’améliorer le contrôle glucométabolique de personnes souffrant de diabète et/ou d’obésité.5 En effet, au cours des dernières décennies, l’incidence de l’obésité et du diabète de type 2 (DT2) a considérablement augmenté dans le monde, en raison de la disponibilité accrue d’aliments dont la qualité et la composition ont changé au fil du temps pour favoriser un apport énergétique excessif.6,7 En conséquence, différentes stratégies alimentaires ont été proposées, telles que le jeûne intermittent, des diètes pauvres en graisses ou réduites en glucides, mais aussi des régimes pauvres en glucides et riches en graisses, également connu sous le nom de diète cétogène.
Sur le plan physiologique, la diète cétogène induit un passage de l’oxydation des glucides à l’oxydation des graisses avec la production de corps cétoniques (acétoacétate [AcAc], acétone et β-hydroxybutyrate [βOHB]) dans les mitochondries des cellules hépatiques.3 L’AcAc et le βOHB sont libérés dans la circulation, puis atteignent ensuite le sang et d’autres organes (muscle squelettique, cœur, cerveau) pour servir comme métabolites alternatifs.8 L’acétone, qui n’est pas métaboliquement active, est générée par décarboxylation spontanée de l’AcAc et est responsable de l’odeur sucrée de l’haleine des individus avec acidocétose.8 Une diète cétogène imite ainsi l’état métabolique d’un jeûne à long terme ou d’un exercice prolongé, lorsque l’apport de glucose est insuffisant.9,10 Pendant les périodes de déficit en glucose, les corps cétoniques jouent un rôle clé pour économiser l’utilisation du glucose et réduire la protéolyse. Contrairement à la plupart des autres tissus, le cerveau ne peut pas utiliser les acides gras pour produire de l’énergie lorsque le glucose devient limité. Dans ce cas, les corps cétoniques sont une source d’énergie alternative pour le cerveau, s’élevant à près de 2/3 des besoins énergétiques du cerveau pendant les périodes de jeûne prolongé.
Chez une personne non diabétique, on peut observer des taux circulants de corps cétoniques entre 0,1 et 0,25mmol/l après une nuit sans manger par exemple, ainsi que des taux à 1mmol/l voir parfois au-dessus lors d’exercice prolongé ou >24h de jeûne. Durant une diète cétogène, les taux circulants de βOHB augmentent et restent généralement à 1,5–3,0mmol/l, ce qui est inférieure aux concentrations trouvées dans l’acidocétose diabétique (3–5mmol/l).8,10 À noter que parmi les causes physiologiques de cétose, on peut observer une élévation de 2 à 3 fois durant la grossesse.
Chez la personne diabétique insulinopénique, les taux sont considérés comme «normaux» si <0,6mmol/l. On parle ensuite d’hypercétonémie, puis d’acidocétose lors que le taux de βOHB est >3 mmol/l. L’acidocétose diabétique est la cause pathologique la plus fréquente d’acidocétose. Durant cet état pathologique, on peut observer un rapport βOHB/AcAc ≤10 (généralement à 1 après un repas), avec un taux de βOHB pouvant atteindre jusqu’à 20–25mmol/l. Ceci est expliqué par le manque d’insuline et l’augmentation concomitantes hormones contre-régulatrices, ce qui stimule la lipolyse et donc la cétogenèse. De nombreux facteurs favorisants existent, avec notamment: infection, trauma, chirurgie, stress, infarctus du myocarde, erreur de gestion (volontaire ou pas) de l’insuline, défaillance de pompe à insuline.
Effets métaboliques et sur les facteurs de risque cardiovasculaires
Sur le plan du contrôle glycémique, la majorité des études sont positives à court et moyen terme. Une baisse de l’HbA1c de 1–1,5% est rapportée selon les études,11 avec même parfois une rémission du diabète (HbA1c <5,7% sans traitement) après un an.12 Cette amélioration est aussi objectivée au niveau de la glycémie à jeun, de la variabilité glycémique et de la sensibilité à l’insuline. Cependant, une récente méta-analyse a démontré que ces effets encourageants semblent être limités sur le temps, avec un effet positif à 3 mois et 6 mois, diminuant et ne devenant plus statistiquement significatif à un an.13 Dans la majorité des études, cette amélioration de l’équilibre du diabète était associée à une réduction des traitements antidiabétiques préexistants, tant oraux que l’insuline, et même parfois leur arrêt.11
Concernant les effets au niveau pondéral, la diète cétogène est associée à une diminution de plusieurs kilos, jusqu’à 8–10kg selon les études, avec parfois une perte rapportée plus importante.11 Ceci est aussi présent au niveau du tour de taille, avec une baisse d’environ 9cm.14 Dans la méta-analyse citée précédemment, relevons un bénéfice pondéral qui se maintient à 3 et 6 mois, mais qui s’amende à 12 mois.13
De par leur composition riche en graisses, il est parfois redouté que la diète cétogène implique une péjoration du profil lipidique. Ceci a été infirmé par une méta-analyse récente rapport une stabilité du cholestérol, une baisse des triglycérides, une légère hausse du HDL-cholestérol, pas de changement du LDL-cholestérol.14
Concernant les effets rénaux, la diète cétogène ne cause pas de modification significative des paramètres biologiques standards (rapport albumine/créatinine urinaire, débit de filtration glomérulaire estimé, créatinine et urée sanguine) après 12 mois.15 Sur le plan hépatique, certaines études ont rapporté une réduction significative de l’alanine aminotransférase et l’aspartate aminotransférase après environ 2 mois.16
Enfin, au-delà du potentiel bénéfice sur le plan métabolique, la diète cétogène pourrait aussi avoir un bénéfice cardiovasculaire, de par le rôle protecteur des corps cétoniques dans les maladies cardiovasculaires. En effet, il a été démontré que les corps cétoniques influencent notamment l’inflammation et le stress oxydatif, la fonction endothéliale, le remodelage cardiaque.17 Ces potentiels effets restent à démontrer lors d’études cliniques, mais seraient très encourageant chez les patients avec un DT2, ayant souvent de multiples facteurs de risque cardiovasculaire.
Concernant le diabète de type 1, il n’y a que peu d’études avec vraies diètes cétogènes, en raison d’un risque très élevé d’acidocétose. Les études sont souvent moins sévèrement réduites en glucides («low carb»), diètes ayant démontré un bénéfice sur le contrôle glycémique dans ce type de diabète.
En pratique
Ces diètes ne peuvent pas être proposées à n’importe quel patient, notamment en cas de multiples comorbidités, de troubles cognitifs, d’un âge avancé. Il est important d’avoir une évaluation auprès d’une diététicienne au préalable, car l’implication du patient dans la gestion de son régime est impérative. Le suivi diététique spécialisée est à continuer durant toute la pratique de la diète. Avant de débuter une diète cétogène, il est nécessaire d’informer les patients que de nombreux effets indésirables peuvent survenir au début. Une «grippe cétogène» d’une durée de quelques jours à quelques semaines est souvent présente, mais aussi des symptômes digestifs (nausées, vomissements, constipation), des céphalées, une asthénie, des vertiges, une insomnie, des difficultés à tolérer l’exercice. Néanmoins, ces effets sont généralement temporaires et peuvent être diminué en assurant une hydratation suffisante. Il est aussi impossible d’anticiper le développement de carences en vitamines et minéraux en prescrivant une substitution systématiquement. De potentiels effets indésirables sous diète cétogène sur le long terme ne pas bien connu en raison d’une littérature limitée.
Il existe une risque d’hypoglycémie si le traitement hypoglycémiant n’est pas adapté. Dans tous les cas, une surveillance médicale stricte est nécessaire lors de la pratique de diète cétogène pour la personne diabétique en raison de sa capacité à abaisser considérablement la glycémie, surtout selon le traitement préalable ou le degré d’insulinopénie. Des recommandations pratiques existent: l’insuline, les sulfonylurées et les glinides doivent être progressivement réduits d’environ 50%; les biguanides, les inhibiteurs de la DPP-4 et les agonistes du GLP-1 doivent être considérés comme facultatifs. Les inhibiteurs du SGLT2 sont associés à un risque d’acidocétose chez certains patients DT2 présentant un déficit relatif en insuline et doivent donc être évités.18
Le régime cétogène exclut des aliments bon marché tels que les céréales ou les produits industriels et privilégie des aliments plus coûteux comme les viandes, les poissons ou les fruits à coques. Son suivi peut occasionner une augmentation du budget consacré à l’alimentation. Les compléments alimentaires tel que farines (amandes, noix de coco) ou produits sucrants (xylitol, erythritol) coutent également (très) cher.
Dans une étude ayant investigué le vécu des patients suivant cette diète, signalant notamment une certaine monotonie en lien avec une diversité alimentaire limitée, ainsi que l’absence d’écarts alimentaires permis (risque de «casser» la cétose), une difficulté à suivre ce régime, qui est peu compatible avec vie sociale.19
Conclusions
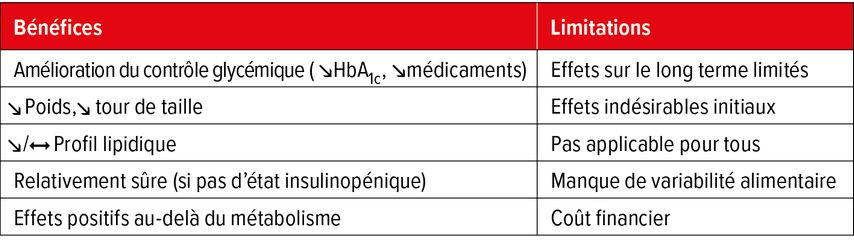
La diète cétogène peut induire de nombreux effets positifs métaboliques chez les personnes avec un DT2. Cependant, ce régime est contraignant et couteux, cause des symptômes désagréables lors de son initiation, et les bénéfices s’estompent probablement avec le temps (Tab. 1). À noter que ceci est possiblement expliqué par un taux d’adhérence diminuant lors des différentes études cliniques. Cependant, au vu de ces effets bénéfiques initiaux, cette diète peut être proposée afin d’initier des changements métaboliques, tant au niveau glycémique et pondéral, en cas de DT2 «non compliqué». Il est par contre impératif que cette diète soit initiée et suivie sous la supervision de professionnels de la santé. Enfin, de potentiels bénéfices sur la fonction cardiaque et de l’incidence d’événements cardiovasculaires restent encore à démontrer.
Littérature:
1 Atkins RC: Dr. Atkins‘ diet revolution; the high calorie way to stay thin forever. New York; D. McKay Co. Harvard, 1972 2 Bueno NB et al.: Very-low-carbohydrate ketogenic diet v. low-fat diet for long-term weight loss: a meta-analysis of randomised controlled trials. Br J Nutr 2013; 110: 1178-87 3 Paoli A et al.: Beyond weight loss: a review of the therapeutic uses of very-low-carbohydrate (ketogenic) diets. Eur J Clin Nutr 2013; 67: 789-96 4 Kessler SK et al.: Dietary therapies for epilepsy: future research. Epilepsy Behav 2011; 22: 17-22 5 Kosinski C, Jornayvaz FR: Effects of ketogenic diets on cardiovascular risk factors: evidence from animal and human studies. Nutrients 2017; 9: 517 6 Bhupathiraju SN, Hu FB: Epidemiology of obesity and diabetes and their cardiovascular complications. Circ Res 2016; 118: 1723-35 7 Blum CB, Levy RI: Role of dietary intervention in the primary prevention of coronary heart disease. Individuals with high-normal or elevated serum cholesterol levels should be placed on cholesterol-lowering diets. Cardiology 1987; 74: 2-21 8 Laffel L: Ketone bodies: a review of physiology, pathophysiology and application of monitoring to diabetes. Diabetes Metab Res Rev 1999; 15: 412-26 9 Krebs H: Biochemical aspects of ketosis. Proc R Soc Med 1960: 53: 71-80 10 Evans M et al.: Metabolism of ketone bodies during exercise and training: physiological basis for exogenous supplementation. J Physiol 2017; 595: 2857-71 11 Tinguely D et al.: Efficacy of ketogenic diets on type 2 diabetes: a systematic review. Curr Diab Rep 2021; 21: 32 12 Walton CM et al.: Improvement in glycemic and lipid profiles in type 2 diabetics with a 90-day ketogenic diet. J Diabetes Res 2019; 2019: 8681959 13 Rafiullah M et al.: Effect of a very low-carbohydrate ketogenic diet vs recommended diets in patients with type 2 diabetes: a meta-analysis. Nutr Rev 2022; 80: 488-502 14 Yuan X et al.: Effect of the ketogenic diet on glycemic control, insulin resistance, and lipid metabolism in patients with T2DM: a systematic review and meta-analysis. Nutr Diabetes 2020; 10: 38 15 Goldstein T et al.: The effect of a low carbohydrate energy-unrestricted diet on weight loss in obese type 2 diabetes patients – a randomized controlled trial. e-SPEN 2011; 6: e178-86 16 Hallberg SJ et al.: Effectiveness and Safety of a Novel Care model for the management of type 2 diabetes at 1 year: an open-label, non-randomized, controlled study. Diabetes Ther 2018; 9: 583-612 17 Yurista SR et al.: Therapeutic potential of ketone bodies for patients With cardiovascular disease: JACC State-of-the-Art Review. J Am Coll Cardiol 2021; 77: 1660-9 18 Murdoch C et al.: Adapting diabetes medication for low carbohydrate management of type 2 diabetes: a practical guide. Br J Gen Pract 2019; 69: 360-1 19 Webster CC et al.: Diet, diabetes status, and personal experiences of individuals with type 2 diabetes who self-selected and followed a low carbohydrate high fat diet. Diabetes Metab Syndr Obes 2019; 12: 2567-82
Das könnte Sie auch interessieren:
Modulateurs du récepteur de la sphingosine-1-phosphate dans le traitement de la SEP
Les modulateurs du récepteur de la sphingosine-1-phosphate représentent une classe de médicaments prometteurs pour le traitement de deuxième ligne de la sclérose en plaques (SEP). Deux ...
Présentation des données pertinentes pour la pratique sur le mavacamten dans la CMHO
Le mavacamten, un inhibiteur de la myosine, a été la première substance de cette classe à être autorisée en 2023 pour le traitement de la cardiomyopathie hypertrophique obstructive (CMHO ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...