Diagnostic visuel endoscopique: la clé des dysplasies et des cancers précoces
Auteure:
Dre méd. Rebecca Marion Trattnig
Clinique de chirurgie générale et viscérale
Clinique universitaire Kepler de Linz
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le diagnostic visuel est au cœur de l’évaluation endoscopique et requiert des compétences visuelles formées, de l’expérience et une approche méthodique. Malgré les avancées technologiques, l’expertise visuelle précise de l’endoscopiste reste irremplaçable. Une évaluation optique différenciée est essentielle pour un traitement précoce et ciblé, en particulier dans la détection des dysplasies et cancers précoces de l’œsophage et de l’estomac.
Keypoints
-
Malgré l’essor de l’IA et des techniques d’imagerie modernes, le diagnostic visuel reste incontournable pour la détection précoce des tumeurs du tractus gastro-intestinal supérieur.
-
Les classifications standardisées renforcent la fiabilité diagnostique et la communication interdisciplinaire.
-
L’IA constitue un appui, mais ne remplace pas l’expertise endoscopique – une formation structurée demeure indispensable.
Le diagnostic endoscopique évolue en permanence, porté par les innovations technologiques et les exigences croissantes en matière de précision diagnostique. L’interprétation visuelle des images endoscopiques – le «diagnostic visuel» – reste un élément central dans la détection des anomalies prénéoplasiques et néoplasiques, en particulier dans le tractus gastro-intestinal supérieur, malgré l’appui des techniques d’imagerie modernes et l’intégration de l’intelligence artificielle (IA).
La simple réalisation d’une gastroscopie ne suffit plus: on attend un examen structuré, adapté au profil de risque et morphologiquement précis. En particulier, la détection de lésions néoplasiques précoces dans l’œsophage et l’estomac exige une analyse visuelle différenciée. Les exigences en expertise endoscopique s’en trouvent accrues. L’imagerie haute résolution, la chromoendoscopie virtuelle et les classifications validées constituent aujourd’hui les fondements d’un diagnostic visuel structuré, notamment chez les patient·es à risque.
Face aux innovations technologiques et à l’émergence de modules de diagnostic basés sur l’IA, la compétence d’évaluation visuelle reste essentielle pour intégrer de façon responsable ces outils d’aide à la prise de décision clinique.1
De la macroscopie à la microscopie
Le diagnostic optique en endoscopie gastro-intestinale (GI) supérieure doit suivre une approche structurée et progressive – de l’évaluation macroscopique standard à l’analyse quasi microscopique d’images grâce aux procédés numériques modernes.2 L’endoscopie en lumière blanche demeure la première étape pour classifier les lésions superficiaires selon leur mode de croissance, avec un impact sur le risque d’invasion et la résécabilité.3 En complément, les techniques de chromoendoscopie virtuelle, telles que le «narrow-band imaging» (NBI) ou le i-Scan, affinent la visualisation des structures vasculaires et muqueuses, permettant une caractérisation plus précise des lésions suspectes.4 Associées à des systèmes de classification, elles améliorent significativement la précision du diagnostic des dysplasies et des cancers précoces.5 Une analyse structurée des images et l’utilisation de classifications favorisent non seulement le taux de détection, mais aussi une communication harmonisée entre endoscopistes et pathologistes – essentielle pour une prise de décision thérapeutique adéquate.6–8
La Société européenne d’endoscopie gastro-intestinale (ESGE) ainsi qu’un document de synthèse de la World Endoscopy Organization insistent sur l’importance des normes d’examen pour optimiser l’évaluation du tractus gastro-intestinal supérieur. On mentionne notamment comme exigences de qualité l’adoption d’une documentation et d’une terminologie standardisées ainsi que de temps d’inspection adéquats (au moins 7minutes par gastroscopie, au moins 1minute par centimètre pour l’œsophage de Barrett).2,9
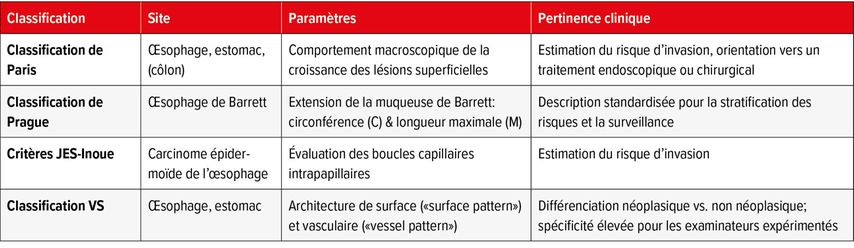
Parmi les classifications fréquemment utilisées pour décrire les lésions méta-, dys- et (pré-)néoplasiques de l’œsophage et de l’estomac figurent notamment la classification de Paris, la classification de Prague, les critères JES-Inoue et la classification VS (Tab.1).
Tab. 1: Aperçu des classifications validées pertinentes pour la dys-/néoplasie en endoscopie du tractus gastro-intestinal supérieur
Œsophage
Le diagnostic endoscopique précoce des lésions néoplasiques dans l’œsophage reste un défi clinique, malgré les progrès techniques. Dans l’œsophage de Barrett en particulier, la différenciation visuelle entre muqueuse non dysplasique, dysplasie de bas grade (LGD) et cancer précoce est particulièrement exigeante. Si le protocole de Seattle, basé sur des biopsies 4 quadrants, demeure la référence,10 des études récentes montrent que des biopsies ciblées basées sur des zones suspectes – identifiées grâce au NBI ou à des méthodes équivalentes – offrent un meilleur rendement diagnostique, tout en réduisant le nombre de prélèvements.
La surveillance de l’œsophage de Barrett doit reposer sur une endoscopie haute résolution, avec documentation photographique correspondante et utilisation systématique des classifications de Prague et de Paris (description du nombreet de l’emplacement en centimètres à partir de l’arcade dentaire pour toute zone suspecte). Des biopsies doivent être prélevées, dans des vaisseaux séparés, sur toutes les modifications circonscrites et conformément au protocole de Seattle. Chez les patient·es présentant une lésion visible suspecte ou une dysplasie confirmée, une relecture histologique par un centre de pathologie de référence et une orientation vers un centre spécialisé sont indiquées. Pour un œsophage de Barrett non dysplasique, les intervalles de surveillance dépendent de l’extension maximale proximale (1–3cm: tous les 5ans; 3–10cm: tous les 3ans; >10cm: suivi dans un centre spécialisé).11
Le diagnostic optique gagne aussi en importance pour les néoplasmes épidermoïdes de l’œsophage, surtout en zones endémiques. La chromoendoscopie au Lugol reste la méthode la plus sensible pour détecter les dysplasies. Le NBI, associé à des classifications avancées (p.ex. critères JES-Inoue), permet une évaluation morphologique différenciée. Les zones dysplasiques se caractérisent par des capillaires irréguliers, en forme de points ou de boucles, avec une dépression centrale et une démarcation nette vis-à-vis de la muqueuse adjacente.12 En raison de l’épidémiologie, le dépistage systématique n’est justifié que dans les régions asiatiques à haut risque.13
Estomac
La détection de l’atrophie gastrique et de la métaplasie intestinale – principaux facteurs de risque du cancer gastrique – revêt une importance clinique croissante grâce aux systèmes d’évaluation standardisés OLGA (Operative Link on Gastritis Assessment) et OLGIM (Operative Link on Gastric Intestinal Metaplasia Assessment).14,15 L’endoscopie haute résolution, associée à la chromoendoscopie virtuelle, constitue aujourd’hui la base d’une stadification endoscopique pour le traitement des lésions prénéoplasiques gastriques. En lumière blanche, ces anomalies apparaissent souvent sous forme de muqueuse plus pâles et translucides avec des vaisseaux sous-épithéliaux visibles. Le recours aux techniques de rehaussement d’image, comme le NBI, améliore significativement la détection de la métaplasie intestinale.16,17 Des signes spécifiques sous NBI, tels que le «light blue crest» ou la «white opaque substance», sont prédictifs de métaplasie intestinale et de néoplasies précoces associées.18,19 Les biopsies doivent suivre le protocole de Sydney.2, 20
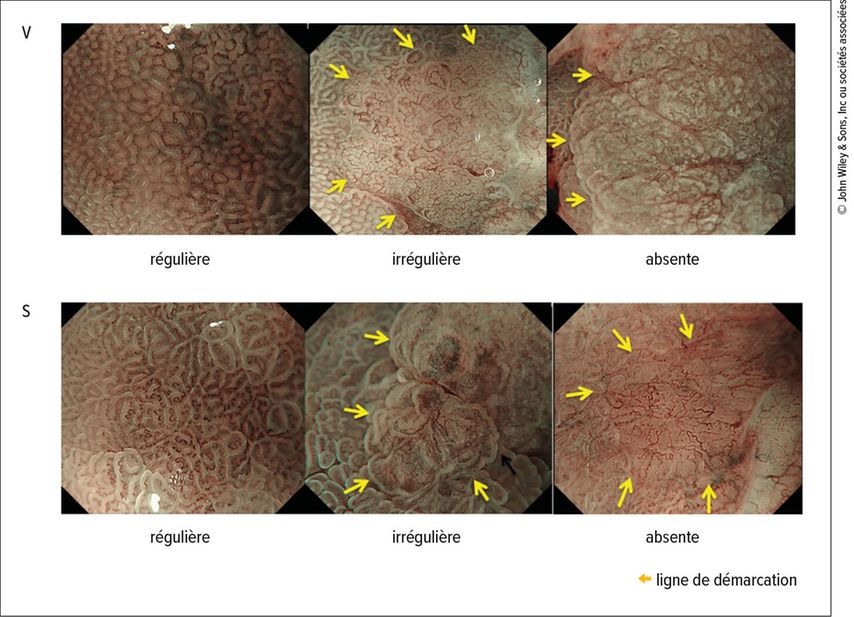
L’évaluation macroscopique selon la classification de Paris joue un rôle décisif dans la détection des cancers gastriques précoces. Les lésions planes (type 0–IIb) ou légèrement déprimées (type 0–IIc), souvent discrètes, nécessitent une vigilance accrue. Sous NBI, les algorithmes MESDA (Magnifying Endoscopy Simple Diagnostic Algorithm)21 et les critères de Yao22 permettent une analyse standardisée des zones suspectes, basée sur les modèles microvasculaires et microscopiques. Un réseau vasculaire irrégulier, une perte de structure de surface et une ligne de démarcation nette (Fig.1) sont considérés comme hautement évocateurs de néoplasie et doivent motiver une biopsie ou une résection ciblée. Dans la pratique, la qualité du diagnostic visuel conditionne donc de plus en plus la stratégie thérapeutique adéquate.8, 23
Fig. 1: Classification VS: l’architecture vasculaire (V) et la structure de surface (S) sont classées comme régulières/irrégulières/absentes; les flèches indiquent la ligne de démarcation (modifié d’après Yao K et al. 2020)22
Le diagnostic visuel en mutation? Expertise versus intelligence artificielle
L’intégration d’outils d’aide au diagnostic dans les applications cliniques est déjà une réalité dans le domaine de l’endoscopie. De nombreuses études s’intéressent déjà aux modèles d’apprentissage profond et aux systèmes d’assistance par IA pour la détection de dysplasies et (pré)cancers dans le tractus gastro-intestinal supérieur. Le rôle de ces programmes dans la pratique clinique quotidienne reste toutefois en cours d’évaluation. Les premiers résultats montrent une amélioration des taux de détection, y compris chez des endoscopistes expérimentés, grâce à des modèles programmés de plus en plus complexes et précis.24 À l’avenir, l’endoscopiste expérimenté devra jouer un rôle clé dans l’intégration optimale des innovations technologiques qui s’annoncent rapidement, notamment les systèmes basés sur l’IA, dans la pratique clinique quotidienne et la prise en charge des patient·es.
L’expertise humaine demeure donc la base incontournable pour l’évaluation professionnelle et le diagnostic visuel. Cette compétence endoscopique approfondie repose sur une formation solide, une maîtrise morphologique et un jugement clinique. Avec sa récente prise de position sur la formation en endoscopie25, ses offres de cours et son académie d’apprentissage en ligne, l’ESGE propose une plateforme soulignant l’importance d’un apprentissage structuré. Aujourd’hui, la capacité à établir un diagnostic visuel fiable – fruit de l’expérience, d’une analyse systématique et du soutien technologique – reste une compétence clé, avec un impact immédiat sur la prise en charge et le pronostic à long terme des patient·es.
Littérature:
1 Popovic D et al.: The importance of artificial intelligence in upper gastrointestinal endoscopy. Diagnostics (Basel). 2023; 13: 2862 2 Bisschops R et al.: Performance measures for upper gastrointestinal endoscopy: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy 2016; 48: 843-64 3 The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002. Gastrointest Endosc 2003; 58: 3-43 4 Yao K, Iwashita A: Diagnosis of early gastric cancer: endoscopic diagnosis and classification: VS classification system for the diagnosis of early gastric cancer by magnifying endoscopy. In: Chiu PWY (Hrsg.) et al.: Endoscopy in Early Gastrointestinal Cancers. Singapur: Springer, 2021 5 Hirai R et al.: Endoscopic evaluation by the Kyoto classification of gastritis combined with serum anti-Helicobacter pylori antibody testing reliably risk-stratifies subjects in a population-based gastric cancer screening program. J Gastroenterol 2023; 58: 848-55 6 Toyoshima O et al.: Endoscopy-based Kyoto classification score of gastritis related to pathological topography of neutrophil activity. World J Gastroenterol 2020; 26: 5146-55 7 Kawamura M et al.: Kyoto classification risk scoring system and endoscopic grading of gastric intestinal metaplasia for gastric cancer: multicenter observation study in Japan. Dig Endosc 2022; 34: 508-16 8 Yao K et al.: Diagnostic criteria for early gastric cancer: current consensus and future perspectives. Dig Endosc 2020; 32: 543-60 9 Emura F et al.: Principles and practice to facilitate complete photodocumentation of the upper gastrointestinal tract: World Endoscopy Organization position statement. Dig Endosc 2020; 32: 168-79 10 Wani S, Gaddam S: Editorial: best practices in surveilance of barrett’s esophagus. Am J Gastroenterol 2017; 112: 1056-60 11 Weusten B et al.: Endoscopic management of Barrett’s esophagus: European Society of Gastrointestinal Endoscopy (ESGE) Position Statement. Endoscopy 2017; 49: 191-8 12 Inoue H et al.: Magnification endoscopy in esophageal squamous cell carcinoma: a review of the intrapapillary capillary loop classification. Ann Gastroenterol 2015; 28: 41-8 13 Domper Arnal MJ et al.: Risk factors, screening and endoscopic treatment in Western and Eastern countries. World J Gastroenterol 2015; 21: 7933-43 14 Rugge M et al.: OLGA gastritis staging for the prediction of gastric cancer risk: a long-term follow-up study of 7436 patients. Am J Gastroenterol 2018; 113: 1621-8 15 Lee JWJ et al.: Severity of gastric intestinal metaplasia predicts the risk of gastric cancer: a prospective multicentre cohort study (GCEP). Gut 2022; 71: 854-63 16 Kaise M: Advanced endoscopic imaging for early gastric cancer. Best Pract Res Clin Gastroenterol 2015; 29: 575-87 17 Matsuo K et al.: Diagnosis of early gastric cancer using narrow band imaging and acetic acid. World J Gastroenterol 2015; 21: 1268-74 18 Miyaoka M et al.: Diagnosis of early gastric cancer using image enhanced endoscopy: a systematic approach. Transl Gastroenterol Hepatol 2020; 5: 50 19 Kawamura M et al.: Endoscopic and histological risk stratification for gastric cancer using gastric intestinal metaplasia. J Gastroenterol Hepatol 2024; 39: 1910-6 20 Banks M et al.: British Society of Gastroenterology guidelines on the diagnosis and management of patients at risk of gastric adenocarcinoma. Gut 2019; 68: 1545-75 21 Muto M et al.: Magnifying endoscopy simple diagnostic algorithm for early gastric cancer (MESDA-G). Dig Endosc 2016; 28: 379-93; Erratum in: Dig Endosc 2016; 28: 630 22 Yao K et al.: Guidelines for endoscopic diagnosis of early gastric cancer. Dig Endosc 2020; 32: 663-98 23 Tziatzios G et al.: Endoscopic grading and sampling of gastric precancerous lesions: a comprehensive literature review. Curr Oncol 2024; 31: 3923-38 24 Fockens KN et al.: A deep learning system for detection of early Barrett’s neoplasia: a model development and validation study. Lancet Digit Health 2023; 5: e905-e16 25 Antonelli G et al.: Training in basic gastrointestinal endoscopic procedures: a European Society of Gastrointestinal Endoscopy (ESGE) and European Society of Gastroenterology and Endoscopy Nurses and Associates (ESGENA) position statement. Endoscopy 2024; 56: 131-50
Das könnte Sie auch interessieren:
Thérapies physiques en cas d’arthrite – nécessaires et utiles?
Le traitement des maladies articulaires rhumatismales inflammatoires a profondément évolué au cours des deux dernières décennies grâce à l’introduction de médicaments innovants: ...
Cancer du rein – stratégies actuelles et perspectives thérapeutiques futures
Les carcinomes rénaux non à cellules claires (non-ccRCC) sont pris en charge selon les mêmes standards que les carcinomes rénaux à cellules claires (ccRCC), mais les résultats ...
Chutes chez les personnes âgées: elles sont d’issue potentiellement fatale, mais aussi évitables
Les chutes chez les personnes âgées sont fréquentes et peuvent avoir de graves conséquences, mais elles ne sont souvent pas signalées par les personnes concernées en raison d’un ...