Diagnostic par PCR des infections respiratoires aiguës
Auteurs:
Med. pract. Subhash Manguluri1
Dr méd. Jonathan Röcken2
Dr méd. Andrei Darie2
1Klinik für Pneumologie, Luzerner Kantonsspital
2Klinik für Pneumologie, Universitätsspital Basel
Correspondance:
E-mail: andrei.darie@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La pneumonie est l’une des principales causes de morbidité et de mortalité dans le monde. Cependant, un traitement précoce et adéquat permet souvent une évolution favorable. Pour pouvoir établir un traitement ciblé, il est nécessaire de poser un diagnostic microbiologique précis et rapide, les nouvelles méthodes de diagnostic, telles que le test PCR, pouvant compléter la culture microbiologique obtenue de manière conventionnelle.
Keypoints
-
La «pandémie silencieuse» de résistance aux antibiotiques est un problème de santé publique urgent à l’échelle mondiale, raison pour laquelle il convient de viser une adhésion plus rigoureuse aux directives.
-
Par rapport aux cultures (bactériennes) conventionnelles, la PCR multiplex offre une identification plus rapide et plus sensible des agents pathogènes.
-
Son intégration aux programmes de gestion des antibiotiques existants permet une réduction des antibiothérapies inadéquates et contribue ainsi à freiner le développement d’une résistance bactérienne.
Sur la base des données de l’Office fédéral de la statistique, près de 30000 patients ont été hospitalisés en Suisse en 2022 en raison d’une pneumonie. Outre une identification rapide des agents pathogènes sous-jacents, un traitement précoce améliore le pronostic, c’est pourquoi les directives internationales recommandent un traitement empirique initial. Il faut savoir que les agents pathogènes potentiels, qu’il s’agisse de bactéries, de virus ou de champignons, peuvent souvent entraîner des tableaux cliniques qui se chevauchent. Le choix du traitement doit tenir compte non seulement de la situation épidémiologique locale, mais aussi du statut immunitaire du patient. Les facteurs de risque, tels qu’une antibiothérapie récente ou des hospitalisations, augmentent le risque de pneumonie causée par des bactéries à Gram négatif et nécessitent la couverture d’un spectre antimicrobien plus large. Étant donné qu’un traitement inadéquat peut entraîner le développement croissant d’une résistance bactérienne, l’antibiothérapie empirique à large spectre doit, si possible, être adaptée de manière précoce sur la base d’un diagnostic microbiologique approfondi. Outre le Staphylococcus aureus résistant à la méticilline (MRSA), les bactéries à Gram négatif multirésistantes, telles que les entérobactéries, les Pseudomonas et les Acinetobacter, constituent une menace considérable pour la santé publique.
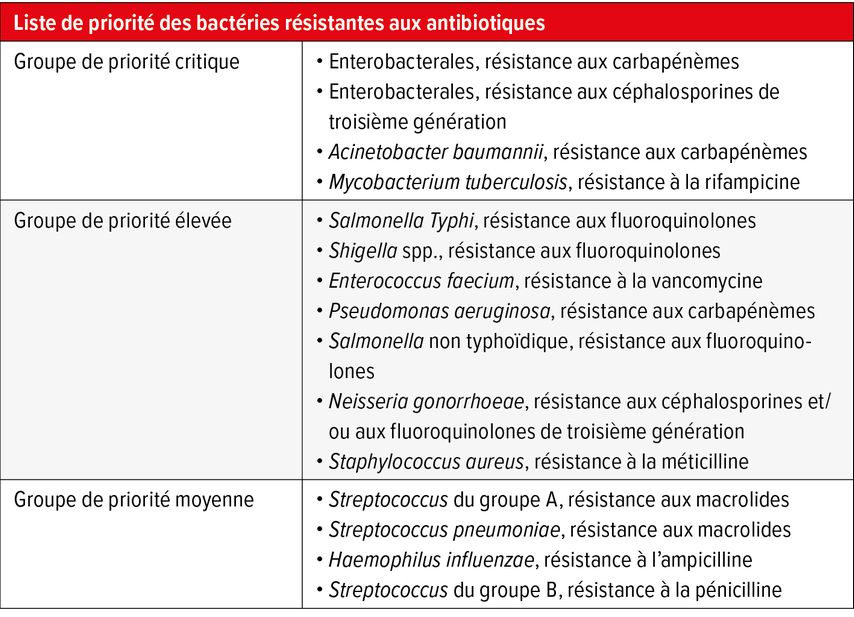
En mai 2024, l’Organisation mondiale de la santé (OMS) a présenté les défis posés par la résistance aux antimicrobiens et a montré la propagation mondiale des souches bactériennes résistantes ainsi que les conséquences qui en découlent pour la santé publique.1 En outre, les auteurs ont mis à jour la liste de priorité des souches bactériennes les plus dangereuses, en mettant particulièrement l’accent sur les bactéries à Gram négatif (Tab. 1). Le travail complémentaire des Antimicrobial Resistance Collaborators a mis en évidence le fardeau mondial de la résistance aux antimicrobiens. Selon ce rapport, 4,95 millions de décès dus à des bactéries résistantes ont été enregistrés dans le monde en 2019, dont 1,27 million de décès étaient exclusivement imputables à la résistance.2 Les infections des voies respiratoires inférieures arrivaient en tête avec 1,5 million.
Tab. 1: Liste de priorité des bactéries résistantes aux antibiotiques de l’OMS (adaptée de la WHO Bacterial Priority Pathogens List, 2024)1
En raison de sa pertinence clinique, de ses dimensions et de son impact socio-économique, on parle également de la «pandémie silencieuse» de la résistance aux antimicrobiens. Afin de prévenir la résistance et de préserver l’efficacité des antibiotiques, des programmes de gestion des antibiotiques (ASP) sont mis en œuvre. Outre l’adhésion aux directives, la désescalade thérapeutique en temps opportun est également centrale. Cependant, un traitement ciblé à spectre d’activité plus étroit est souvent uniquement possible lorsque le diagnostic microbiologique permet d’identifier l’agent pathogène.
Diagnostic conventionnel par rapport à par PCR
Dans une étude américaine, Jain et al. ont examiné la qualité diagnostique de différentes méthodes de diagnostic, y compris les cultures d’expectorations et de sang, les prélèvements PCR pour recherche virale et les tests d’antigènes urinaires, chez des patients hospitalisés souffrant de pneumonie acquise communautaire. Une classification étiologique de la pneumonie a été possible dans 38% des cas. Un agent pathogène bactérien a été détecté dans seulement 14% des cas.3 Il convient de mentionner qu’une bronchoscopie a été réalisée chez seulement 3% des patients. Dans leur étude, Ranzani et al. ont montré que, dans des situations spécifiques, notamment chez les patients souffrant de pneumonie sévère ou immunodéprimés, des méthodes plus invasives telles que la bronchoscopie peuvent améliorer considérablement l’identification des agents pathogènes (56% par rapport à 39%).4 Bien que la sensibilité de la culture microbiologique soit améliorée par un prélèvement plus invasif, aucun agent pathogène ne peut être identifié chez près de la moitié des patients. Un autre inconvénient de la culture est le temps de latence d’environ 48 heures avant l’obtention des résultats.
Les directives de l’American Thoracic Society (ATS) ainsi que la prise de position de l’Infectious Diseases Society of America (IDSA) ont souligné le besoin croissant de méthodes de diagnostic plus précises et plus rapides afin d’améliorer le résultat des patients souffrant de pneumonie et de réduire le risque de développement d’une résistance aux antibiotiques grâce à un traitement antimicrobien plus ciblé.5,6
La pandémie de COVID-19 a considérablement contribué à faire connaître et à utiliser la réaction en chaîne par polymérase (PCR). Depuis quelques années déjà, la PCR s’est établie comme méthode complémentaire pour le diagnostic des pneumonies bactériennes. Elle permet de détecter rapidement et de manière sensible des séquences d’ADN spécifiques d’agents pathogènes. Les méthodes d’analyse PCR multiplex permettent de détecter simultanément de multiples séquences spécifiques d’un agent pathogène avec une grande sensibilité à partir d’un prélèvement, tel qu’un lavage broncho-alvéolaire (BAL) en l’espace de 2 à 4 heures, et d’identifier ainsi différents agents pathogènes (y compris parfois des modèles de résistance).
Diagnostic par PCR et gestion des antibiotiques
Bien qu’elle puisse identifier des agents pathogènes spécifiques en quelques heures, la PCR ne conduit pas automatiquement à une antibiothérapie optimisée dans la pratique clinique quotidienne. Dans une cohorte de patients principalement immunodéprimés, Salina et al. ont examiné le BAL par culture conventionnelle et, dans deux tiers des cas, également par PCR.7 Malgré la disponibilité précoce des résultats de la PCR, aucune différence significative n’a été constatée en ce qui concerne la durée du traitement et le nombre d’antibiotiques prescrits. Dans une étude ultérieure menée chez des patients souffrant de pneumonie et présentant des facteurs de risque d’infection par des agents pathogènes à Gram négatif, le résultat de la PCR après BAL a été couplé à une recommandation thérapeutique. Cela s’est traduit par une réduction de 45% des antibiothérapies inadéquates (adaptation de l’éventail thérapeutique) et de 22% de l’ensemble des antibiothérapies.8 Cela souligne la complexité de la gestion des antibiotiques dans la pratique clinique quotidienne, qui va au-delà de la technologie PCR. Une interprétation minutieuse des résultats de la PCR dans le contexte clinique, des directives claires ainsi que des formations pour les professionnels de santé sont en outre nécessaires.
Diagnostic par PCR en soins intensifs
Les avantages du diagnostic par PCR pourraient être exploités de manière optimale, en particulier dans les unités de soins intensifs (USI), car les antibiothérapies combinées sont initiées de manière précoce chez les patients atteints de maladies critiques et les ressources sont généralement disponibles pour un diagnostic plus complexe et une mise en œuvre rapide des résultats.
Il a été estimé que le diagnostic par PCR pourrait conduire à une adaptation de l’antibiothérapie dans 40% des cas.9 Dans une étude ultérieure, 200 patients souffrant de pneumonie en USI ont été randomisés en vue d’une PCR ou d’un test microbiologique conventionnel.10 Les patients du groupe PCR ont reçu un traitement adapté aux résultats beaucoup plus tôt (2,3 par rapport à 46,1 heures). De plus, la désescalade de l’antibiothérapie a été plus rapide (4,8 par rapport à 46,5 heures) et plus fréquente (42% par rapport à 8%) dans le groupe PCR. Les directives des sociétés européennes de pneumologie, de soins intensifs, de microbiologie et d’infectiologie publiées en 2023 recommandent d’envoyer des échantillons prélevés dans les voies respiratoires inférieures pour un test PCR multiplex dès que des antibiotiques à large spectre sont prescrits ou envisagés pour une pneumonie sévère.11
En résumé, la PCR multiplex permet un diagnostic plus rapide et plus sensible des infections des voies respiratoires inférieures par rapport aux méthodes conventionnelles. Les résultats divergents entre le diagnostic par PCR et la culture bactérienne restent un défi, nécessitent une expertise clinique concernant l’interprétation et doivent être évalués en tenant compte des forces et des limites de chaque méthode. À l’avenir, il s’agira de continuer à optimiser la précision et l’éventail de la PCR multiplex, et de la combiner à un test de résistance immédiat afin de garantir les meilleurs soins possibles aux patients.
Littérature:
1 World Health Organization; Impact Initiatives and Research Coordination (IRC): WHO bacterial priority pathogens list, 2024: Bacterial pathogens of public health importance to guide research, development and strategies to prevent and control antimicrobial resistance. WHO 2024 2 Antimicrobial Resistance Collaborators: Lancet 2022; 399: 629-55 3 Jain S et al.: N Engl J Med 2015; 373: 415-27 4 Ranzani OT et al.: Crit Care 2019; 23: 51 5 Hanson KE et al.: Clin Infect Dis 2020; 71: 2744-51 6 Metlay JP et al.: Am J Respir Crit Care Med 2019; 200: e45-e67 7 Salina A et al.: ERJ Open Res 2022; 8: 00595-2021 8 Darie AM et al.: Lancet Respir Med 2022; 10: 877-87 9 Lee SH et al.: J Microbiol Immunol Infect 2019; 52: 920-8 10 Poole S et al.: J Infect 2022; 85: 625-33 11 Martin-Loeches I et al.: Intensive Care Med 2023; 49: 615-32
Das könnte Sie auch interessieren:
Revue de presse: L’importance d’objectifs thérapeutiques centrés sur les patient·es dans la SLA
Dans une revue récente, Chio et al., mettent en lumière la nécessité de repenser les critères d’évaluation dans les essais cliniques portant sur la sclérose latérale amyotrophique (SLA ...
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...