Créatinine élevée: quand et comment investiguer?
Auteur:
PD Dr méd. Andreas D. Kistler
Chefarzt Medizinische Klinik
Kantonsspital Frauenfeld
8501 Frauenfeld
E-mail: andreas.kistler@stgag.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La créatinine est probablement l’une des valeurs de laboratoire sanguines les plus fréquemment déterminées. Il est donc fréquent qu’une valeur élevée de créatinine soit détectée – et plusieurs questions se posent alors: y a-t-il maladie rénale pertinente ayant une importance pronostique et thérapeutique, ou la valeur peut-elle encore être tolérée? Un contrôle de suivi est-il suffisant ou faut-il procéder à des examens complémentaires dans un avenir proche? Dans ce dernier cas, quelles sont les analyses appropriées et quand une investigation néphrologique réalisée par un spécialiste est-elle indiquée?
Keypoints
-
Le DFG doit toujours être estimé à partir de la créatinine sérique, mais les limites de la formule d’estimation doivent être prises en compte.
-
Tenez compte de l’âge des patients: à un âge avancé, un certain déclin de la fonction rénale est normal et la pertinence pronostique de l’altération de la fonction rénale est moindre.
-
L’analyse d’urine (au moins le test de la bandelette, si nécessaire en plus les quotients albumine-créatinine et protéine-créatinine) fait partie de l’investigation initiale d’une insuffisance rénale.
-
Une cause (étiologie et schéma anatomopathologique) de l’insuffisance rénale doit toujours être recherchée. Dans la plupart des cas, une anamnèse de qualité, une analyse d’urine et une échographie des reins sont suffisantes.
La réponse à ces questions n’est pas facilitée par le fait que les patients sont généralement asymptomatiques lorsque les taux de créatinine sont élevés, c’est-à-dire qu’ils ne ressentent aucune souffrance. Ainsi donc, il est important d’être d’abord conscient de l’objectif d’une investigation supplémentaire – et de l’expliquer aux patients en conséquence. Une valeur élevée de créatinine indique généralement une altération de la fonction rénale. D’une part, elle est associée à un risque significativement accru d’insuffisance rénale terminale (nécessité de dialyse), d’autre part, elle est également associée à une morbidité cardiovasculaire accrue, à une augmentation de la mortalité globale ainsi qu’à diverses maladies secondaires (notamment métabolisme osseux, anémie). La pose d’un diagnostic précoce et correct est importante pour de nombreuses maladies rénales afin de stopper la progression au moyen d’une thérapie spécifique et de prévenir les complications susmentionnées. En revanche, pour les maladies rénales courantes (p.ex. néphropathie hypertensive), il n’existe malheureusement aucune option thérapeutique spécifique en dehors des mesures «non spécifiques» de réduction de la progression (p.ex. inhibiteurs de l’ECA). Enfin, une valeur de créatinine légèrement élevée n’est pas nécessairement le signe d’une maladie rénale pertinente. Un triage de qualité peut donc permettre d’éviter des examens inutiles. Les questions suivantes ont pour but de faciliter ce triage et de poser les jalons d’une investigation plus approfondie.
La créatinine reflète-t-elle correctement la fonction rénale?
Les reins remplissent plusieurs fonctions (excrétrices, endocriniennes, homéostatiques) et les effets d’un trouble de la fonction rénale sont tout aussi variés. Cependant, la fonction rénale globale est mieux reflétée par le débit de filtration glomérulaire (DFG) – la quantité d’urine primaire produite par la filtration glomérulaire par unité de temps. La créatinine sérique, au titre de marqueur de filtration endogène, reflète le DFG et est utilisée pour l’estimer. Aujourd’hui, lorsque la créatinine sérique est déterminée, le laboratoire calcule et communique également le DFG estimé (DFGe), en utilisant le plus souvent la formule CKD-EPI. Cette formule présente plusieurs avantages par rapport à la formule de Cockcroft-Gault, beaucoup plus ancienne: a) elle est beaucoup mieux validée; b) elle estime directement le DFG et non la clairance de la créatinine (cette dernière est un peu plus élevée que le DFG étant donné que la créatinine est excrétée non seulement par filtration glomérulaire mais aussi, dans une moindre mesure, par sécrétion tubulaire); c) elle indique le DFG normalisé par rapport à la surface corporelle (en ml/min/1,73m2). Cette approche présente à son tour deux avantages: d’une part, il est logique, sur le plan physiologique, de mettre en relation la fonction rénale et la taille corporelle étant donné que le risque de complications d’une maladie rénale est corrélé au DFG normalisé par rapport à la surface corporelle. D’autre part, le DFG normalisé peut être estimé sans connaissance du poids corporel (contrairement à la clairance de la créatinine de Cockcroft-Gault, dont le calcul nécessite la connaissance du poids). Par conséquent, le DFGe peut être calculé directement par le laboratoire en connaissant le sexe et l’âge.
Cependant, aussi pratiques que soient les formules d’estimation du DFG, elles ont aussi leurs pièges et leurs limites dont il convient de tenir compte. D’une part, leur précision est limitée; même la formule d’estimation de la CKD-EPI, très bien validée, est sujette à une inexactitude d’environ +/–30%. D’autre part, elles ne sont valables qu’à l’état d’équilibre. En cas d’insuffisance rénale aiguë avec une créatinine en hausse rapide, le DFG est surestimé et en cas de récupération de la fonction rénale avec une créatinine qui diminue, il est sous-estimé. Enfin, il existe des influences extrarénales sur la créatinine sérique:
-
La masse musculaire: les effets du sexe et de l’âge sur la masse musculaire sont pris en compte par la formule – mais pas les autres influences. Ainsi, chez les individus jeunes, sportifs et musclés, on constate souvent une créatinine un peu élevée et le DFG est sous-estimé. L’inverse est valable pour les personnes souffrant d’affections musculaires, de cachexie, etc. Si le DFG doit être calculé dans ce cas de figure, on peut soit déterminer la cystatine C comme marqueur de filtration endogène alternatif qui ne dépend pas de la masse musculaire et estimer le DFG à partir de cette dernière, soit effectuer un prélèvement d’urine sur 24 heures pour déterminer avec précision la clairance de la créatinine.
-
Apport exogène de créatine sous forme de préparations de musculation ou par une consommation excessive de viande
-
Certains médicaments (triméthoprime, cimétidine, dolutégravir) inhibent la sécrétion tubulaire de la créatinine et peuvent entraîner une augmentation de la créatinine indépendante du DFG allant jusqu’à environ 20%.
La fonction rénale correspond-elle à la norme de l’âge?
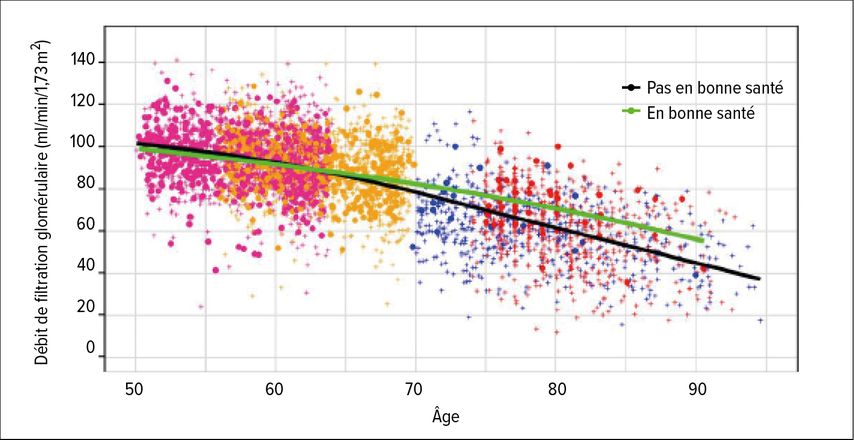
Chez les jeunes adultes en bonne santé, le DFG est généralement >90ml/min/1,73m2. Cependant, à partir de l’âge de 35–40 ans, le DFG diminue en moyenne de près de 1ml/min/1,73m2 par an. Comme cela a été récemment démontré, cette diminution se retrouve également chez les individus en bonne santé (Fig. 1).1 La diminution du DFG avec l’âge ne reflète donc pas simplement une prévalence plus élevée de maladies rénales chez le sujet âgé, mais probablement un processus de vieillissement des reins. Alors que chez les personnes plus jeunes, un DFG <75ml/min/1,73m2 est déjà pathologique et également associé à une mortalité accrue, des valeurs de DFG <60ml/min/1,73m2 se retrouvent chez une proportion considérable de personnes de plus de 75 ans, et seules les valeurs de DFG <45ml/min/1,73m2 sont clairement associées à une mortalité accrue dans ce groupe d’âge.2 Ce à quoi il convient d’ajouter que l’espérance de vie dans ce groupe d’âge est souvent si courte que la maladie rénale chronique n’est plus pertinente sur le plan pronostique à cette période.
Fig. 1: DFG mesuré en fonction de l’âge et de l’état de santé. Les différentes cohortes dans lesquelles les mesures ont été effectuées sont repérées par des couleurs. Les cercles remplis et la ligne noire (moyenne) se rapportent à des personnes atteintes de maladies chroniques (non rénales), les croix et la ligne verte à des personnes en bonne santé (d’après Eriksen et al.)1
La dynamique du déclin de la fonction rénale est-elle connue?
En plus de la valeur absolue par rapport à l’âge, la dynamique est bien entendu importante. D’une part, l’insuffisance rénale aiguë est révélée par un diagnostic différentiel différent de celui de l’insuffisance rénale chronique. D’autre part, une insuffisance rénale chronique à évolution rapide doit être prise plus au sérieux qu’une fonction rénale qui est altérée de façon stable depuis des années. Les valeurs préliminaires de créatinine sérique sont alors extrêmement utiles. Si elles ne sont pas connues, un suivi peut aider – à condition, bien sûr, que d’autres constatations (voir ci-dessous) n’imposent pas une action plus rapide.
Les antécédents médicaux révèlent-ils une cause probable de l’insuffisance rénale?
Une insuffisance rénale chronique ou aiguë ne constitue pas réellement un diagnostic, mais simplement une description du degré d’altération de la fonction rénale. Par conséquent, il est toujours important de réfléchir aux mécanismes qui conduisent à l’altération de la fonction rénale. À cette fin, il est utile de considérer chaque maladie rénale à trois niveaux:
-
Quelle est la cause sous-jacente (étiologie, agent nocif, maladie de base) de l’insuffisance rénale?
-
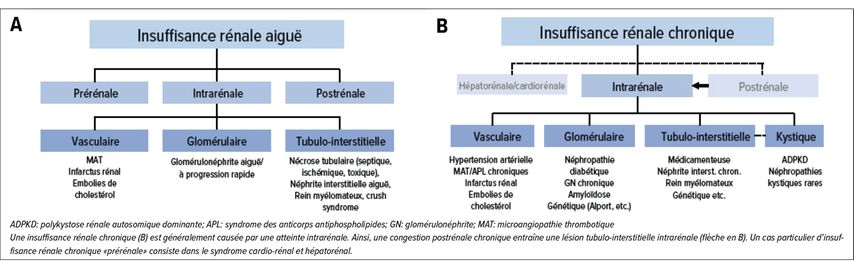
Quel est le schéma anatomopathologique (prérénal – rénal – postrénal; si rénal: vasculaire – glomérulaire – tubulo-interstitiel)? (Fig. 2)
-
Quel est le syndrome clinique, quels sont les symptômes, les résultats cliniques et de laboratoire? Ces informations permettent souvent de tirer des conclusions sur le schéma anatomopathologique.
Des indices importants sur l’étiologie (point 1 ci-dessus) peuvent souvent être obtenus par une anamnèse plus détaillée. Des causes très fréquentes de l’insuffisance rénale chronique sont le diabète et l’hypertension. Les antécédents familiaux peuvent fournir des indices sur les causes génétiques des maladies rénales (p.ex. reins kystiques). En cas d’insuffisance rénale aiguë, les antécédents médicamenteux sont particulièrement importants (médicaments néphrotoxiques tels que les anti-inflammatoires non stéroïdiens [AINS]? déclencheurs possibles de néphrite interstitielle tels que les antibiotiques, les AINS, les inhibiteurs de la pompe à protons?) ainsi que les preuves de perte de liquide ou d’apport réduit de liquide comme cause d’insuffisance rénale prérénale. Les troubles musculaires et articulaires et les symptômes d’autres systèmes organiques (p.ex. pulmonaires, ORL, oculaires) peuvent fournir des indices importants d’une maladie systémique auto-immune.
Quels sont les résultats des analyses d’urine?
Tout diagnostic initial d’insuffisance rénale comprend une analyse d’urine à titre de test de laboratoire indispensable. Elle fournit trois informations importantes:
-
Outre l’élévation de la créatinine/diminution du DFG, existe-t-il d’autres indices d’une maladie rénale? Comme mentionné plus haut, il existe également des influences extrarénales sur la créatinine, et la fonction rénale peut être altérée «physiologiquement» chez le sujet âgé. Cependant, les anomalies des résultats urinaires fournissent des indices importants quant à une maladie rénale pertinente.
-
L’albuminurie constitue un facteur pronostique tout à fait important. Plus l’albuminurie est élevée, plus le risque d’évolution vers une maladie rénale est important et plus la maladie rénale doit être prise au sérieux.
-
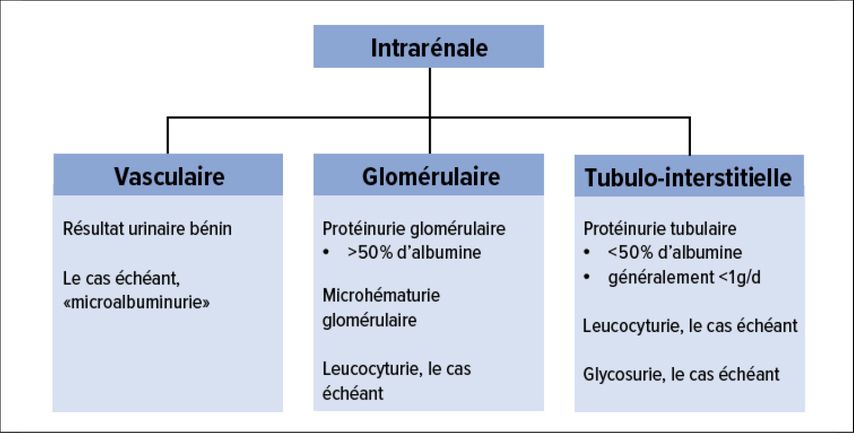
L’analyse des résultats urinaires permet souvent de tirer des conclusions sur le schéma anatomohistologique de l’atteinte rénale et donc sur des étiologies possibles (Fig. 3). Les lésions rénales vasculaires (néphropathie hypertensive) s’accompagnent généralement de résultats urinaires normaux ou, tout au plus, d’une albuminurie modérément accrue («microalbuminurie»). En cas d’atteinte rénale interstitielle, il y a souvent une légère protéinurie, mais <50% de celle-ci est constituée d’albumine (ce qui peut être déterminé en mesurant simultanément les quotients albumine-créatinine et protéine-créatinine). Une augmentation marquée du quotient protéines-créatinine en présence d’une albuminurie normale ou seulement légèrement élevée suggère un possible rein myélomateux (protéinurie de Bence-Jones). La néphrite interstitielle s’accompagne souvent d’une légère leucocyturie en plus de la protéinurie tubulaire. Enfin, une atteinte rénale glomérulaire se caractérise par une protéinurie glomérulaire (>50% d’albumine) et/ou une microhématurie. Si les résultats urinaires correspondent aux antécédents médicaux (p.ex. résultats urinaires bénins, années d’hypertension → néphropathie hypertensive; protéinurie glomérulaire et sédiment urinaire bénin en cas d’années de diabète → néphropathie diabétique), aucune investigation complémentaire n’est généralement nécessaire.
Fig. 3: Résultats urinaires typiques dans les maladies rénales vasculaires, glomérulaires et tubulo-interstitielles
En tant qu’examen informatif, un test de la bandelette urinaire fournit déjà des informations importantes. Si le test de la bandelette est positif pour le sang/les leucocytes, un sédiment urinaire doit être réalisé – d’une part pour confirmer la microhématurie ou la leucocyturie, et d’autre part pour rechercher des érythrocytes dysmorphiques. Si le test de la bandelette est positif pour l’albumine ou les protéines, une quantification au moyen des quotients albumine-créatinine et protéine-créatinine dans l’urine ponctuelle doit être réalisée. En règle générale, il est toutefois recommandé de déterminer les quotients albumine-créatinine et protéine-créatinine dans l’urine ponctuelle lors de l’investigation initiale de l’insuffisance rénale, indépendamment du résultat du test de la bandelette. D’une part, cela permet de détecter une albuminurie légèrement accrue (qui peut échapper à la détection au moyen du test de la bandelette) et, d’autre part, des protéines autres que l’albumine peuvent être détectées (en particulier la protéinurie de Bence-Jones), et le rapport entre l’albuminurie et la protéinurie totale permet une classification entre protéinurie glomérulaire et protéinurie tubulaire (voir ci-dessus et Fig. 4).
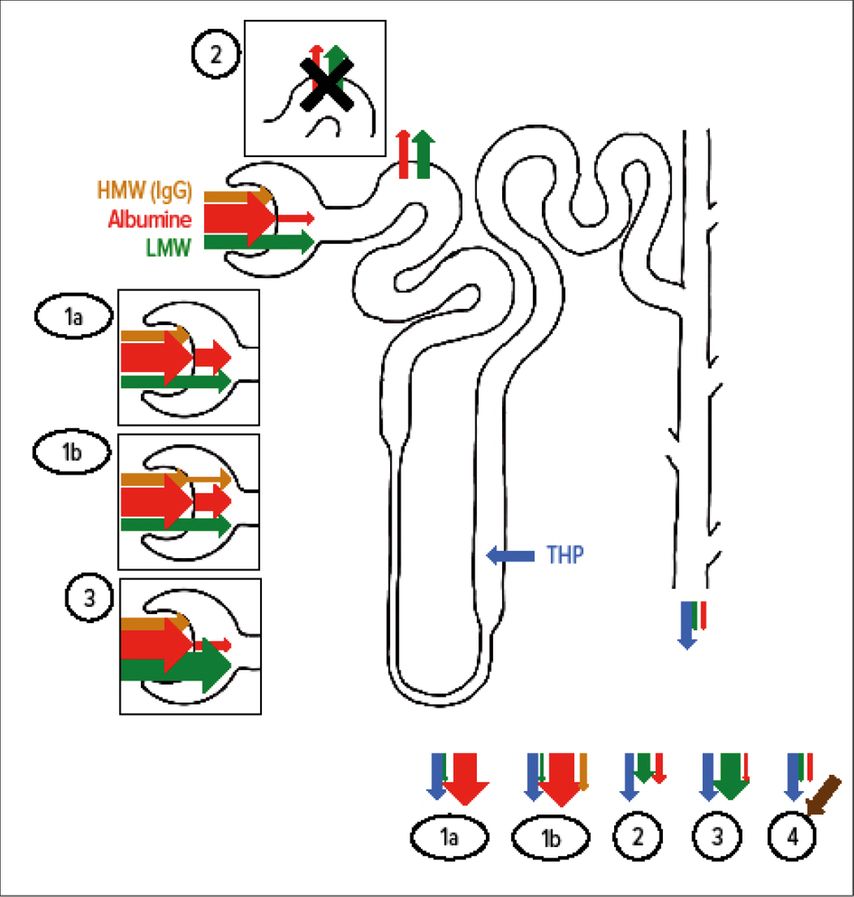
Fig. 4: Représentation schématique de la protéinurie physiologique et des différentes formes de protéinurie pathologique. Chez les sujets en bonne santé, les protéines de haut poids moléculaire («high molecular weight», HMW) (p.ex. immunoglobulines) ne sont pas du tout filtrées au niveau glomérulaire, l’albumine l’est seulement dans une faible mesure et les protéines de faible poids moléculaire («low molecular weight», LMW) sont filtrées librement. Les protéines filtrées sont presque entièrement réabsorbées dans le tubule proximal. D’un point de vue physiologique, jusqu’à 10mg d’albumine et jusqu’à 10mg de protéines LMW apparaissent dans l’urine par jour. La protéine de Tamm-Horsfall (THP, également appelée uromoduline), qui est sécrétée par les cellules des tubules du membre ascendant de l’anse de Henlé, représente la majeure partie de la protéinurie physiologique (jusqu’à 150mg/j). Dans la protéinurie glomérulaire, des quantités anormales d’albumine (et une quantité élevée de protéines HMW dans la protéinurie glomérulaire non sélective en cas de lésions graves) sont filtrées en raison d’une fuite du filtre glomérulaire. Dans les deux cas, la protéinurie qui en résulte est constituée à >50% d’albumine (1a et b; dans ce dernier cas, des IgG peuvent également se détecter dans les urines). En cas d’atteinte tubulaire, l’albumine et les protéines LMW filtrées physiologiquement ne sont pas réabsorbées de manière adéquate et apparaissent donc dans l’urine (protéinurie tubulaire, 2). L’albumine représente <50% et une protéinurie tubulaire dépasse rarement 1g/j, étant donné que la quantité de protéines qui sont normalement filtrées par voie glomérulaire n’augmente pas sensiblement. Si des concentrations massivement élevées de protéines de faible poids moléculaire sont trouvées dans le sang (p.ex. chaînes légères libres dans le myélome multiple ou myoglobine dans la rhabdomyolyse), la capacité de réabsorption tubulaire est dépassée et les protéines de faible poids moléculaire apparaissent dans l’urine (3). Dans ce cas – à condition qu’il n’y ait pas de dommages glomérulaires supplémentaires – il n’y a pas davantage d’albumine dans l’urine. Dans une certaine mesure, des pathologies postrénales (infections, tumeurs) entraînent également une protéinurie, qui consiste alors principalement dans des protéines HMW (4). La différenciation des protéines dans l’urine – le plus simplement sous la forme d’une détermination simultanée des quotients albumine-créatinine et protéine-créatinine – permet donc de tirer des conclusions sur la pathologie présente.
Quelle est la configuration des reins à l’échographie?
Tout comme l’analyse d’urine, une échographie des reins et des voies urinaires fait généralement partie du bilan initial d’une insuffisance rénale nouvellement diagnostiquée. Les informations pertinentes tirées de l’échographie sont: 1) exclusion d’une genèse postrénale (reins obstrués avec/sans uretères obstrués); 2) taille des reins et largeur du parenchyme (des reins réduits et/ou un parenchyme rétréci correspondent à des dommages chroniques avancés et généralement irréversibles); 3) reins kystiques ou autres anomalies anatomiques.
Des examens complémentaires sont-ils indiqués?
Si la cause probable de l’insuffisance rénale n’a pas pu être déterminée sur la base des examens ci-dessus (p.ex. néphropathie hypertensive; néphropathie diabétique; insuffisance rénale postrénale) et en particulier si les analyses d’urine font ressortir une atteinte rénale glomérulaire (protéinurie, sédiment urinaire marquant), des examens complémentaires sont indiqués. Il s’agit d’une part d’examens de laboratoire complémentaires concernant les étiologies possibles (sérologies de l’hépatite, déterminations des auto-anticorps, etc.) et d’autre part souvent d’une biopsie rénale. Au plus tard à ce stade, il est conseillé de diriger le sujet vers un néphrologue. Très souvent, cependant, les considérations et examens susmentionnés sont suffisants pour décider si un dysfonctionnement rénal pertinent est présent et pour en déterminer la cause probable (pour une description plus détaillée des examens susmentionnés, voir Seeger et Kistler, 20183). Pour vous aider, mémorisez les question suivantes:
-
DFG estimé de façon adéquate?
-
Fonction rénale conforme à l’âge?
-
Dynamique rapide?
-
Cause dans les antécédents?
-
Résultats urinaires?
-
Échographie?
Enfin, il convient de mentionner que l’exposé ci-dessus se limite à la question de savoir s’il y a insuffisance rénale pertinente et à la recherche de sa cause. En cas d’insuffisance rénale prononcée, il convient bien entendu toujours de rechercher ses conséquences et les traiter si nécessaire: troubles électrolytiques (en particulier hyperkaliémie et hyperphosphatémie), acidose rénale, anémie rénale, hyperparathyroïdie secondaire/ostéodystrophie rénale. Ces complications ne surviennent généralement pas avant un DFG <45ml/min/1,73m2 et sont fréquentes au-delà d’un DFG <30ml/min/1,73m2. De plus, leur traitement justifie ou nécessite généralement une consultation en néphrologie.
Littérature:
1 Eriksen BO et al.: GFR in healthy aging: an individual participant data meta-analysis of iohexol clearance in european population-based cohorts. J Am Soc Nephrol 2020; 31: 1602-15 2 Delanaye P et al.: CKD: a call for an age-adapted definition. J Am Soc Nephrol 2019; 30: 1785-805 3 Seeger H, Kistler AD: Nephrologische Diagnostik mit der Toolbox des Hausarztes. Ther Umsch 2018; 75: 335-43
Das könnte Sie auch interessieren:
Plus qu’un problème de sécheresse: gros plan sur la maladie de Sjögren
La maladie de Sjögren est une maladie auto-immune systémique inflammatoire chronique présentant une grande variabilité clinique. Elle fait partie de la famille des collagénoses, à ...
Prise en charge des acouphènes en 2025
Le traitement des acouphènes a évolué au cours des dernières années. Les directives de l’AWMF sur la prise en charge des acouphènes proposent des recommandations fondées sur des preuves ...
Traitement hormonal de réassignation sexuelle et santé cardiovasculaire
Un risque accru d’événements cardiovasculaires a été observé chez les personnes TGD («transgender and gender-diverse»), sans qu’il ne soit possible d’exclure que le traitement hormonal ...