Covid-19 et le rein: qu’avons-nous appris d’une année de pandémie?
Auteurs:
Prof. Dr méd. Michael Joannidis
Dr méd. Timo Mayerhöfer
Dr méd. Sebastian Klein
Internistische Intensiv- und Notfallmedizin
Department Innere Medizin
Medizinische Universität Innsbruck
E-mail: michael.joannidis@i-med.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Il est désormais largement reconnu que le SARS-CoV-2 ne se limite pas au système respiratoire, mais peut également affecter de nombreux autres organes. Dont le rein, qui est très fréquemment touché, chez les patients atteints de Covid-19 gravement malades, dans le cadre d’une insuffisance rénale aiguë. Outre la maladie elle-même, les effets secondaires des interventions de médecine intensive nécessaires sont également des facteurs déclenchants possibles.
Keypoints
-
L’incidence des insuffisances rénales aiguës (IRA) chez les patients atteints de Covid-19 recevant des soins intensifs peut atteindre 50%.
-
Le rein peut être affecté directement par l’infestation virale ou indirectement par la réponse à la réaction immunitaire déclenchée par le SARS-CoV-2.
-
D’autres facteurs affectant la fonction rénale sont la ventilation invasive, la thérapie volumique, mais aussi la néphrotoxicité des traitements médicamenteux utilisés.
-
La protéinurie et/ou l’hématurie suggèrent donc une atteinte rénale aiguë avant que les critères classiques de l’IRA ne soient remplis.
-
Actuellement, il n’existe pas de traitement spécifique contre l’IRA liée au Covid-19.
Épidémiologie
Depuis plus d’un an, le monde est en proie à une pandémie déclenchée par le «severe acute respiratory syndrome coronavirus 2» (SARS-CoV-2). Le nom ne laisse planer aucun doute sur la cible primaire du virus. Cependant, nombreuses ont été les spéculations, au départ, sur la mesure dans laquelle d’autres systèmes d’organes pouvaient également être affectés directement et indirectement par l’infection par ce virus. Selon les premiers comptes-rendus en provenance de Wuhan, le SARS-CoV-2 ne semblait pas constituer un problème majeur pour le rein. Cependant, ces premières observations ont été rapidement suivies d’études révélant des taux d’incidence beaucoup plus élevés d’insuffisances rénales aiguës (IRA), ce qui a finalement donné lieu à une fourchette de 1 à 46%.1 En outre, de grandes différences régionales sont apparues. Une méta-analyse a mis en évidence une incidence de 28,6% aux États-Unis et en Europe, tandis qu’en Asie, des incidences de 5,5% ont été observées pour les patients hospitalisés atteints de Covid-19.2 On peut supposer que les chiffres d’incidence sont encore plus élevés pour les patients atteints de Covid-19 gravement malades.3 Dans une grande étude multicentrique, Gupta et al. ont ainsi constaté une incidence de 42,8% pour les insuffisances rénales aiguës chez les patients atteints de Covid-19 dans les unités de soins intensifs. Dans une évaluation des patients de la première vague de Covid-19 provenant du registre de soins intensifs Covid-19 du Tyrol, nous avons observé un taux d’IRA de 48,6%. Une thérapie de remplacement rénal (TRR) a été nécessaire dans environ 20% des cas.4 À noter que l’analyse de la deuxième vague a montré que le taux d’IRA de 28% a diminué de manière significative au cours de l’évolution (Mayerhöfer T; en cours de soumission). Ces résultats sont corroborés par des observations similaires faites à New York, où l’on a également observé une diminution du taux d’IRA au cours de la pandémie.5 Les raisons possibles de ce développement seront examinées plus en détail ci-dessous. À une fréquence inhabituelle, l’insuffisance rénale aiguë associée au Covid-19 semble progresser jusqu’à rendre obligatoire une thérapie de remplacement rénal. Dans l’étude de Gupta et al. susmentionnée, elle a été décrite avec une incidence d’env. 21% chez les patients atteints de Covid-19 gravement malades.6 Elle était associée à une mortalité élevée de 63%, 34% des patients survivants demeurant dépendants d’une dialyse.
Pathophysiologie
La physiopathologie de l’insuffisance rénale aiguë nécessite la prise en compte de plusieurs mécanismes de déclenchement. On peut faire une distinction entre facteurs directs et indirects (Fig. 1).7 L’effet direct serait l’infection du rein par le SARS-CoV-2, également connue sous le nom de tropisme rénal. Les facteurs indirects comprennent la réaction du rein à la réponse immunitaire déclenchée par le SARS-CoV-2, avec une réaction inflammatoire locale et/ou systémique, l’hypercoagulabilité systémique, mais aussi les conséquences d’un traitement en unité de soins intensifs, comme les effets hémodynamiques d’une ventilation invasive, la déplétion volumique ou la surcharge volumique, la septicémie ou l’administration de médicaments néphrotoxiques.
Fig. 1: La pathogénèse de l’atteinte rénale aiguë chez les patients atteints de Covid-19 (IRA Covid-19) est multifactorielle, les effets directs du SARS-CoV-2 sur le rein et les mécanismes indirects tenant tous une place. Ceux-ci sont en partie le résultat d’influences systémiques de l’infection virale, d’effets du virus sur divers systèmes organiques tels que les poumons ou la conséquence de mesures de soins intensifs (modifié d’après Nadim et al.)7
Tropisme rénal du SARS-CoV-2
Le SARS-CoV-2 se lie à la cellule via les récepteurs ACE2. À l’aide de la protéase transmembranaire à sérine 2 (TMPRSS2), l’absorption dans la cellule a finalement lieu, avec une réplication intracellulaire ultérieure du virus. Les récepteurs ACE2 peuvent être détectés dans le rein, à la fois dans les cellules des tubules proximaux et dans les podocytes, ce qui semble rendre possible, en principe, un tropisme rénal avec une infection directe du rein.8 Plusieurs études d’autopsie ont permis de détecter l’ARN viral directement dans le rein.9 Une détection du virus était associée à l’apparition d’insuffisances rénales aiguës et à la gravité de la maladie, ce qui pourrait plaider en faveur d’une atteinte directe du rein par le SARS-CoV-2.10 Cependant, la protéase TMPRSS2, nécessaire à l’internalisation du SARS-CoV-2, est exprimée dans le tubule distal, mais quasiment pas dans le tubule proximal ou les podocytes.9 De surcroît, aucune détection directe du virus n’a encore été réalisée dans les biopsies rénales de patients atteints de Covid-19 souffrant d’IRA.11,12
Le spectre des changements histopathologiques détectés dans ces biopsies allait de précipitations de myoglobine dans les tubules rénaux, typiques de la rhabdomyolyse, à la glomérulosclérose avec collapsus, mais aussi à la microangiopathie thrombotique (MAT). Cependant, la nécrose tubulaire aiguë (NTA) était la manifestation la plus fréquente. Dans l’ensemble, ces résultats plaident en défaveur d’une infection virale du rein pertinente pour la physiopathologie et en faveur d’une étiologie multifactorielle déjà suspectée de l’insuffisance rénale aiguë en cas de Covid-19.7,11, 13, 14
Dysfonctionnement endothélial et rôle de la tempête de cytokines
De nombreuses cytokines inflammatoires sont libérées dans le cadre de la réponse immunitaire systémique, dont certaines, comme l’IL-6, sont directement liées aux IRA.15 On parle souvent d’une «tempête de cytokines».
Bien que les taux d’IL-6 soient élevés dans le cas du Covid-19, cette élévation semble plutôt faible par rapport à d’autres causes aussi bien de SDRA que de septicémie bactérienne.16,17 Ces observations sur le SARS-CoV-2 ont également pu être confirmées par une méta-analyse précoce, qui relègue au second plan l’importance de la soi-disant «tempête de cytokines» en ce qui concerne la physiopathologie de l’atteinte rénale aiguë dans le cas du Covid-19.18
Néanmoins, différentes autres cytokines et l’activation du complément sont susceptibles de jouer un rôle en tant que contributeurs au dysfonctionnement endothélial. Àcet égard, il est également prouvé que le SARS-CoV-2 entraîne des lésions des cellules endothéliales qui, associées à d’autres mécanismes dont certains ne sont pas encore élucidés, conduisent à une hypercoagulabilité.19 Ce phénomène favorise la formation de thromboses artérielles et veineuses, mais aussi de microthrombi, comme ceux que l’on trouve principalement dans le poumon, mais aussi dans d’autres organes.20 Au niveau des analyses de laboratoire, on le constate avant tout par l’augmentation des niveaux de D-dimères, qui sont associés à une mortalité accrue.21 Dans le rein, les microthrombi peuvent être considérés comme des contributeurs possibles à l’IRA en cas de Covid-19 en raison de troubles de la perfusion dans le cortex, mais surtout dans la médulla. Les résultats faisant état d’une microangiopathie thrombotique dans les biopsies rénales confirment cette hypothèse.
Le mécanisme exact des lésions des cellules endothéliales causées par le SARS-CoV-2 n’a pas encore été définitivement élucidé. Des données d’expériences animales suggèrent une lésion endothéliale directe due à la liaison de la protéine spiculaire au récepteur ACE2.22 Un autre mécanisme évoqué est la formation d’auto-anticorps contre le récepteur ACE2 dans le cadre de la réponse immunitaire contre la protéine spiculaire du SARS-CoV-2.23
Influence de la ventilation invasive
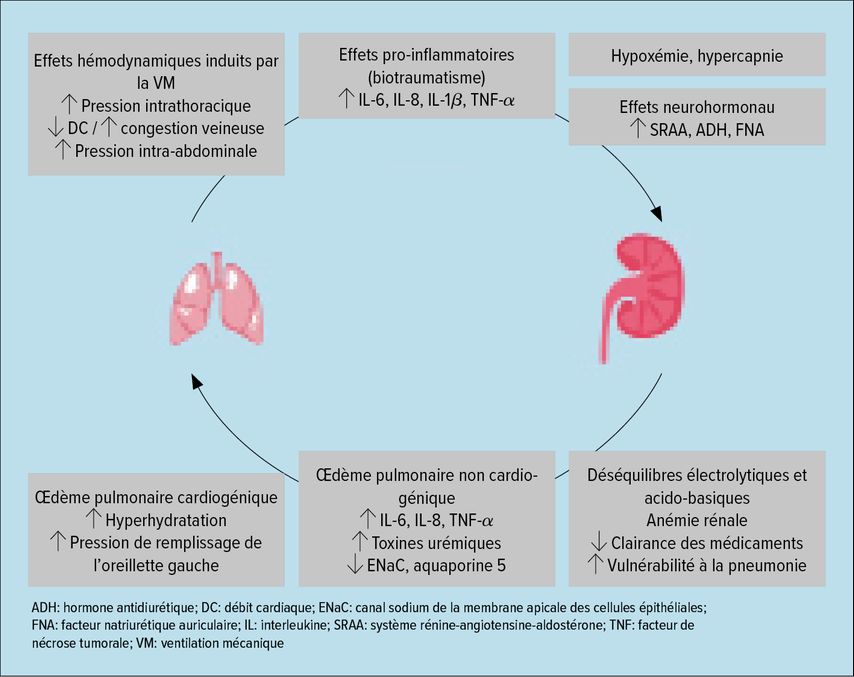
Outre les aspects physiopathologiques évoqués ci-dessus, les effets de la ventilation mécanique doivent également être pris en considération.24 La ventilation mécanique invasive peut déjà entraîner une altération de la fonction rénale indépendamment d’autres facteurs. Par exemple, des pressions de ventilation élevées entraînent une augmentation des pressions intrathoracique et abdominale, une sollicitation du cœur droit avec congestion veineuse et une diminution du débit cardiaque, ce qui a des effets hémodynamiques directs sur la perfusion rénale (Fig. 2).24 Ce à quoi il convient d’ajouter des effets neurohormonaux, notamment la libération de l’hormone antidiurétique (ADH) et la suppression du facteur natriurétique auriculaire (FNA). Dans cette configuration, on observe une diminution du débit sanguin rénal et du DFG ainsi qu’une augmentation de la rétention liquidienne. Pour compliquer les choses, les patients atteints de Covid-19 présentent une incidence anormalement élevée de syndrome de détresse respiratoire aiguë (SDRA), y compris chez des patients en soins intensifs. D’où la nécessité fréquente d’une ventilation avec une pression expiratoire finale positive (PEEP) élevée. Dans le même temps, la durée moyenne de la ventilation est très longue.4 Dans ce cas, les facteurs susmentionnés ont un impact beaucoup plus important que dans le cas de traitements de ventilation plus courts, comme chez les patients postopératoires, qui peuvent généralement être sevrés rapidement du respirateur. Selon ce concept, une IRA était nettement moins fréquente sous ventilation non invasive (VNI) au Tyrol que sous ventilation invasive (10,2% contre 50,9%), comme nous avons pu le montrer sur la base de l’analyse du registre tyrolien des soins intensifs du Covid-19 (Mayerhöfer T; en cours de soumission).
Fig. 2: Mécanismes pouvant entraîner une détérioration mutuelle de la fonction organique des poumons et des reins (modifié d’après Klein et al.)24
Influence de la thérapie volumique
Au début de la première vague, un régime liquidien restrictif était recommandé chez les patients présentant une septicémie et/ou un SDRA associés au Covid-19, sur la base des directives Covid-19 de la campagne «Surviving Sepsis».25 Un certain excès de zèle dans l’application de ces recommandations a pu conduire à un taux élevé de «déplétion volumique» iatrogène, qui a exacerbé l’hypovolémie déjà présente en raison d’une maladie virale aiguë et a ainsi contribué de manière significative à l’incidence élevée d’IRA chez les patients gravement malades. Par la suite, la stratégie générale a évolué vers une administration initiale de liquides plus généreuse jusqu’à la stabilisation hémodynamique des patients, tandis qu’un régime restrictif n’est recommandé que pour la phase ultérieure du SDRA.
Néphrotoxicité
Le traitement de l’incidence accrue de surinfections bactériennes/septicémie dans le cadre de la maladie à Covid-19 grave nécessite souvent l’utilisation d’antibiotiques ayant un potentiel néphrotoxique pertinent (aminoglycosides, vancomycine, colistine).
En outre, on ne peut exclure les effets néphrotoxiques des diverses thérapies expérimentales utilisées dans la phase initiale de la pandémie, parfois même en association. Bien que l’hydroxychloroquine n’ait plus sa place dans le traitement du Covid-19, elle était largement utilisée au début malgré des données médiocres, faute d’alternatives.26 En l’absence de données systématiques, il existe divers mécanismes par lesquels des dommages aux reins par l’hydroxychloroquine pourraient être concevables.27 Des comptes-rendus faisant état d’une possible augmentation du taux d’IRA sont également disponibles pour le ritonavir/lopinavir à partir de données de pharmacovigilance.28 Pour le remdésivir, malgré un risque accru d’IRA selon les données de pharmacovigilance de l’OMS, son utilisation dans l’insuffisance rénale aiguë et chronique semble sûre, du moins pour une utilisation à court terme, selon de premières données d’études.29, 30 En particulier pour les thérapies expérimentales sans base de données réelles, les interactions potentielles et la néphrotoxicité envisageable doivent toujours être incluses dans une analyse individuelle des risques et des bénéfices.
Un autre mécanisme d’IRA, largement indépendant des médicaments, est la rhabdomyolyse, fréquemment observée dans les maladies virales.31
Diagnostic de l’insuffisance rénale aiguë associée au Covid-19
En plus des paramètres permettant de diagnostiquer une insuffisance rénale aiguë selon les critères KDIGO (créatinine sérique ou oligurie), l’analyse d’urine semble être utile, notamment pour le diagnostic précoce de l’IRA. Dans une étude récente sur des patients hospitalisés présentant une insuffisance rénale aiguë et un Covid-19, une protéinurie a été détectée dans 84% des cas et une hématurie dans 81% des cas.32 Ces modifications étaient beaucoup plus fréquentes que le diagnostic d’insuffisance rénale aiguë (46%) posé selon les critères KDIGO. Les modifications urinaires suggèrent donc une atteinte rénale aiguë avant que les critères classiques de l’IRA ne soient remplis. Ceci est également pris en compte dans la déclaration de consensus récemment publiée sur la nouvelle stadification de l’IRA avec le stade 1S (biomarqueur positif, créatinine sérique et oligurie négative) et devrait également être pris en compte chez les patients atteints de Covid-19.33
Traitement de l’insuffisance rénale aiguë associée au Covid-19
Actuellement, il n’existe pas de traitement spécifique pour l’insuffisance rénale aiguë liée au Covid-19. On ne sait toujours pas dans quelle mesure les stratégies antivirales au cours de la phase précoce de la maladie, notamment en ce qui concerne le tropisme rénal potentiellement co-initiateur, jouent un rôle dans la thérapie et la prévention des IRA dans le contexte du Covid-19.34
La réponse immunitaire étant susceptible de jouer un rôle important dans la physiopathologie de l’IRA en cas de Covid-19, un traitement immunomodulateur pourrait être une cible appropriée. Il est intéressant de noter que l’étude RECOVERY a fait ressortir un taux réduit de thérapie de remplacement rénal (TRR) chez les patients traités par dexaméthasone (4,4% contre 7,5%).26 Une autre étude du groupe RECOVERY a examiné l’association de la dexaméthasone (D) et du tocilizumab (T) et a de nouveau montré une réduction du besoin de TRR (5% dans le groupe D+T contre 7% dans le groupe D).35 Toutefois, il convient de noter que dans ce dernier essai, l’incidence de la TRR dans le groupe dexaméthasone était aussi élevée que dans le groupe témoin du premier essai RECOVERY. Ainsi, la question de l’efficacité du tocilizumab en termes de néphroprotection ne peut donner lieu à une réponse concluante à l’heure actuelle.
Étant donné que la physiopathologie de l’IRA en cas de Covid-19 pourrait potentiellement également être provoquée par les microthrombi mentionnés en relation avec la coagulopathie, un traitement anticoagulant adéquat est important pour prévenir cette complication. Cependant, l’étude INSPIRATION récemment publiée, qui a comparé différentes stratégies d’anticoagulation, n’a fait ressortir aucune différence significative quant à l’incidence de la TRR.36 Ainsi, une anticoagulation adaptée aux facteurs de risque individuels est toujours recommandée.
Une grande importance doit être accordée à la prophylaxie de l’IRA. Celle-ci inclut une optimisation de la perfusion rénale par un contrôle adéquat du volume. Bien que l’hypovolémie doive être corrigée rapidement au début, il convient toutefois de viser un équilibre hydrique et d’éviter une surcharge volumique et la congestion veineuse qui s’ensuit au cours de l’évolution ultérieure.37 Ceci est d’une importance décisive, notamment en ce qui concerne le traitement adéquat du SDRA s’inscrivant dans le cadre du Covid-19. En outre, dans l’esprit d’une ventilation protectrice des poumons, les pressions de ventilation doivent être réduites – si possible – ce qui a également un effet positif sur les reins.38
Chez les patients qui développent une IRA sévère, il convient d’appliquer les critères actuellement en vigueur pour la thérapie de remplacement rénal.39
Résumé
Les insuffisances rénales associées au Covid-19 sont fréquentes. Plusieurs mécanismes ont été démontrés comme étant responsables de l’apparition d’insuffisances rénales aiguës dans le cadre du Covid-19. Outre un tropisme rénal potentiel du SARS-CoV-2, les effets systémiques de la maladie virale et, chez les patients gravement malades, les interventions en soins intensifs, la surinfection bactérienne, le traitement volumique et les néphrotoxines jouent un rôle crucial dans le développement de l’IRA.
Littérature:
1 Farouk SS et al.: J Nephrol 2020; 33: 1213-8 2 Fu EL et al.: Clin Kidney J 2020; 13: 550-63 3 Yang X et al.: Int Immunopharmacol 2021; 90: 107159 4 Klein SJ et al.: Wien Klin Wochenschr 2020; 132: 653-63 5 Charytan DM et al.: Kidney Int Rep 2021; 6: 916-27 6 Gupta S et al.: J Am Soc Nephrol 2021; 32: 161 7 Nadim MK et al.: Nat Rev Nephrol 2020; 16: 747-64 8 Pan X-W et al.: Intensive Care Med 2020; 46: 1114-6 9 Puelles VG et al.: N Engl J Med 2020; 383: 590-2 10 Braun F et al.: Lancet 2020; 396: 1881-2 11 Sharma P et al.: J Am Soc Nephrol 2020; 31: 1948 12 Kudose S et al.: J Am Soc Nephrol 2020; 31: 1959 13 Bradley BT et al.: Lancet 2020; 396: 320-32 14 Santoriello D et al.: J Am Soc Nephrol 2020; 31: 2158-67 15 Su H et al.: Front Immunol 2017; 8: 405 16 Sinha P et al.: JAMA Internal Medicine 2020; 180: 1152-4 17 Kox M et al.: JAMA 2020; 324: 1565-7 18 Leisman DE et al.: Lancet Respir Med 2020; 8: 1233-44 19 Lowenstein CJ, Solomon Scott D: Circulation 2020; 14: 1609-11 20 Menter T et al.: Histopathology 2020; 77: 198-209 21 Zhou F et al.: Lancet 2020; 395: 1054-62 22 Nuovo GJ et al.: Ann Diagn Pathol 2021; 51: 151682 23 Casciola-Rosen L et al.: medRxiv 2020; doi: 10.1101/2020.10.13. 20211664 24 Klein SJ et al.: Med Klin Intensivmed 2018; 113: 448-55 25 Alhazzani W et al.: Intensive Care Med 2020; 46: 854-87 26 Suleyman G et al.: JAMA Netw Open 2020; 3: e2012270 27 Edelstein CL et al.: Kidney Int 2020; 98: 234-5 28 Binois Y et al.: Kidney Int Rep 2020; 5: 1787-90 29 Gérard AO et al.: Clin Pharmacol Ther 2021; 109: 1021-4 30 Thakare S et al.: Kidney Int Rep 2020; 6: 206-10 31 Joannidis M, Forni LG: Intensive Care Med 2011; 37: 729-31 32 Chan L et al.: J Am Soc Nephrol 2021; 32: 151-60 33 Ostermann M et al.: JAMA Netw Open 2020; 3: e2019209 34 Beigel JH et al.: N Eng J Med 2020; 383: 1813-26 35 Group RC: Lancet 2021; 397: 1637-45 36 INSPIRATION Investigators: JAMA 2021; 325: 1620-30 37 Joannidis M et al.: Med Klin Intensivmed 2018: 113: 358-69 38 Ranieri VM et al.: JAMA 2000; 284: 43-4 39 Klein SJ, Joannidis M: Med Klin Intensivmed 2018; 112: 437-43
Das könnte Sie auch interessieren:
Revue de presse: L’importance d’objectifs thérapeutiques centrés sur les patient·es dans la SLA
Dans une revue récente, Chio et al., mettent en lumière la nécessité de repenser les critères d’évaluation dans les essais cliniques portant sur la sclérose latérale amyotrophique (SLA ...
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...