Asthma und der zirkadiane Rhythmus
Autorinnen:
Assoz. Prof. Mag. Dr. rer. nat. Eva Böhm
Julia Teppan, MSc
Lehrstuhl für Pharmakologie
Otto Loewi Forschungszentrum für Gefässbiologie, Immunologie und Entzündung
Medizinische Universität Graz
E-Mail: eva.boehm@medunigraz.at
E-Mail: julia.teppan@medunigraz.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der zirkadiane Rhythmus spielt nicht nur beim Schlafverhalten eine bedeutende Rolle, sondern hat auch einen erheblichen Einfluss auf Asthmaanfälle und die Lungenfunktion. Die gezielte pharmakologische Beeinflussung der zirkadianen Uhr könnte in Zukunft für neue Therapieansätze herangezogen werden.
Keypoints
-
Asthma ist eine chronisch-entzündliche Erkrankung, die einer starken zirkadianen Rhythmik unterliegt.
-
Aktuelle Daten weisen auf eine bidirektionale Kommunikation und Regulation zwischen dem zirkadianen System und dem Immunsystem bei Asthma hin.
-
Chronotherapeutische Ansätze und die pharmakologische Beeinflussung des zirkadianen Systems könnten die therapeutische Versorgung von Asthmatiker:innen mit nächtlichen Symptomen und therapierefraktärem Asthma verbessern.
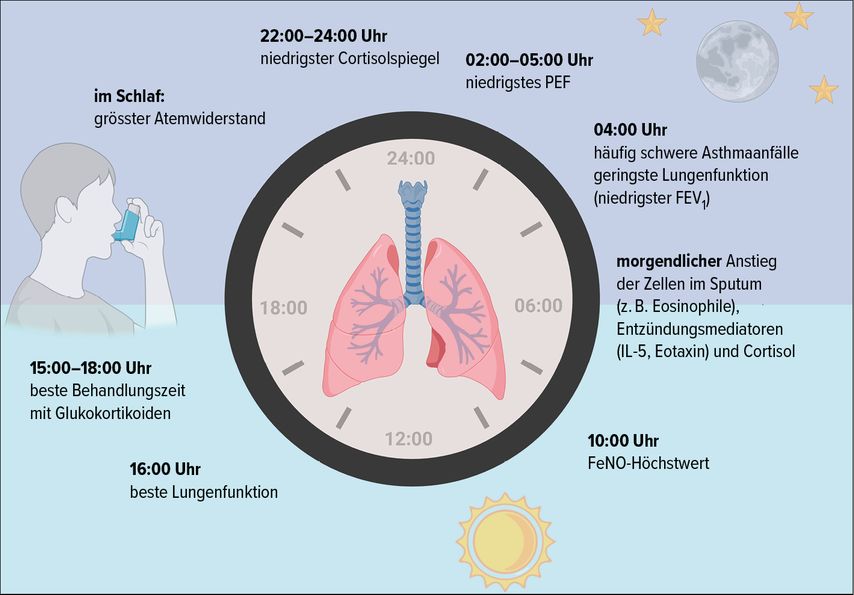
Asthma ist eine heterogene chronisch-entzündliche Erkrankung der Atemwege, die durch eine bronchiale Hyperreaktivität und eine variable Atemwegsobstruktion gekennzeichnet ist und einer zirkadianen Rhythmik unterliegt (Abb. 1).1Die klinischen Symptome der Bronchokonstriktion und der Mukusüberproduktion verschlimmern sich in der Regel nachts, etwa 90% der Asthmaanfälle treten zwischen den späten Abendstunden und dem frühen Morgen auf, was die Schlaf- und Lebensqualität von Asthmapatient:innen massiv beeinträchtigt.2 Mögliche Gründe dafür sind die Dominanz des parasympathischen Nervensystems während des Schlafs, die zu einer Verengung der Atemwege führt,3 und die Verringerung der Sekretion von Steroidhormonen in der Nacht, die möglicherweise die Entzündung der Atemwege verschlimmert.4–6 Neben den zirkadianen Schwankungen der Katecholamine,7 vieler Entzündungsmediatoren,8–10 der zirkadianen Hormone Cortisol und Melatonin11,12dürften auch Polymorphismen der Betarezeptoren13 und vor allem die sogenannte molekulare zirkadiane Uhr eine wichtige regulatorische Rolle spielen.14
Asthma und der zirkadiane Rhythmus
Eine repräsentative Umfrage unter Asthmapatient:innen hat ergeben, dass die Zeit um 4 Uhr morgens eine besonders kritische Phase für viele Betroffene darstellt. 74% der Befragten gaben an, mindestens einmal pro Woche, 40% sogar jede Nacht zu dieser Zeit durch Asthmaanfälle geweckt zu werden. Diese Erkenntnis deckt sich mit der Tatsache, dass auch viele asthmabedingte Todesfälle in den frühen Morgenstunden auftreten.15,16
Obwohl die Lungenfunktion bei gesunden Menschen nachweislich über einen Zeitraum von 24 Stunden schwankt – sie erreicht gegen 16 Uhr ihren Höhepunkt und gegen 4 Uhr morgens ihren Tiefpunkt – sind diese Schwankungen bei Patient:innen mit Asthma weitaus ausgeprägter.17,18 Es wird angenommen, dass die folgenden Faktoren zu den zirkadianen Schwankungen der Lungenfunktion beitragen:
Tägliche Schwankungen im Atemwegsdurchmesser, die sich in Atemwegswiderstandsindizes wie FEV1 oder PEF widerspiegeln.17 Der niedrigste PEF tritt typischerweise zwischen 2 und 5 Uhr morgens auf, die niedrigste FEV1 gegen 4 Uhr. Während des Schlafs kann der Atemwegswiderstand aufgrund der Aktivierung des parasympathischen Nervensystems erhöht sein.3
Während der Zeit des höchsten Atemwegswiderstands zeigt der Mensch eine relative Toleranz gegenüber der CO2-Akkumulation und minimiert die Atmungsanstrengung während des Schlafs.19,20
Neben der Lungenfunktion unterliegt auch das Entzündungsgeschehen bei Asthmatiker:innen tageszeitlichen Schwankungen. Vor allem nachts bis in die frühen Morgenstunden ist ein Anstieg der Eosinophilen- und Neutrophilenzahl und der CD4+-Lymphozyten im Sputum zu beobachten, der mit erhöhten Konzentrationen von Interleukin-5 und Eotaxin frühmorgens einhergeht.8,9,21,22 Messungen von gewebeschädigenden Sauerstoffradikalen ergaben bei Patient:innen mit nächtlichem Asthma signifikant höhere 4-Uhr-Werte als bei Patient:innen ohne nächtliche Symptome.23 Auch das fraktionierte exhalierte Stickstoffmonoxid (FeNO), das einen Biomarker für die eosinophile Entzündung darstellt, spiegelt diese zirkadianen Schwankungen wider. Interessanterweise ist ein rhythmischer Zyklus für FeNO nur bei Asthmatiker:innen zu beobachten, wobei die Höchstwerte um 10 Uhr morgens und die niedrigsten Werte in der Nacht gemessen werden.24,25
Die molekulare zirkadiane Uhr
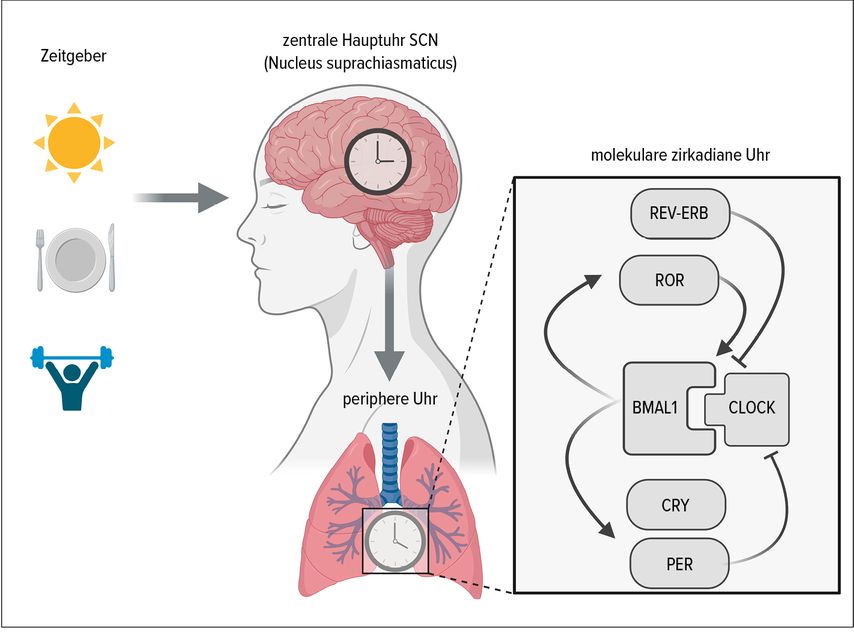
Der zirkadiane (circa diem=ungefähr ein Tag) Rhythmus ist der endogene Zeitgeber, der unsere physiologischen Prozesse auf eine Periodenlänge von etwa 24 Stunden synchronisiert. Die zentrale «Hauptuhr» für den zirkadianen Rhythmus ist der Nucleus suprachiasmaticus (SCN), eine kleine Gruppe von Nervenzellen im Hypothalamus.26,27 Der SCN empfängt Lichtsignale von der Netzhaut über den retinohypothalamischen Trakt und leitet diese Information über neuronale und humorale Faktoren an unabhängige «periphere Uhren», die prinzipiell in allen Organen und Zellen unseres Körpers vorhanden sind, weiter (Abb. 2).28 Auf diese Weise wird der innere Rhythmus an den Tag-Nacht-Zyklus angepasst. Der zirkadiane Rhythmus beeinflusst somit eine Vielzahl von physiologischen Prozessen, wie die Sekretion von Hormonen, Neurotransmittern und Entzündungsmediatoren. Störungen des zirkadianen Rhythmus können verschiedene Leiden wie metabolische, psychische, neurodegenerative und entzündliche Erkrankungen begünstigen.27 Einige Studien haben bestätigt, dass Personen, die jahrelang Schichtarbeit verrichten und unter einer Störung des zirkadianen Schlaf-wach-Rhythmus, dem sogenannten «Schichtarbeiter-Syndrom», leiden, unabhängig von ihrer genetischen Prädisposition ein erhöhtes Risiko haben, an Asthma zu erkranken.29,30
Der Nobelpreis für Medizin/Physiologie wurde im Jahr 2017 an die Chronobiologen Jeffrey C. Hall, Michael Rosbash und Michael W. Young verliehen, die bei Untersuchungen an der Fruchtfliege Drosophila melanogaster wichtige molekulare Mechanismen der zirkadianen Rhythmik entschlüsseln konnten.31 In miteinander gekoppelten Rückkopplungsschleifen steuern sogenannte Uhrengene beziehungsweise Uhrenproteine («clock genes» oder «clock proteins») ihre eigene Transkription in einem 24-Stunden-Rhythmus. Die positiven Elemente dieser Rückkopplungsschleife bilden die Transkriptionsfaktoren BMAL1 und CLOCK, die als Heterodimer selbst die Expression der Gene Period (PER) 1 und 2 und Cryptochrom (CRY) 1–3 des negativen «core loop» sowie die Transkriptions-Repressoren REV-ERBα und β und die Transkriptionsaktivatoren RORα–γ des «accessory loop» regulieren. PER und CRY wiederum unterdrücken die Aktivität von BMAL1; REV-ERBα ist der Repressor und RORα der wichtigste Aktivator der BMAL1-Transkription (Abb.2). In der Folge kommt es zu einer periodischen transkriptionellen Aktivierung und Deaktivierung der molekularen zirkadianen Uhr im 24-Stunden-Takt. Dieses Gleichgewicht ist für die Funktion des Immunsystems essenziell, da BMAL1 ein wichtiger Transkriptionsfaktor vieler pro- und antiinflammatorischer Gene ist und auch REV-ERBα und ROR regulatorisch in Entzündungsprozesse eingreifen.
Unsere aktuellen Forschungsergebnisse zeigen jedoch, dass die Proteinexpression der einzelnen Komponenten der molekularen zirkadianen Uhr vor allem in den Bluteosinophilen von Asthmatiker:innen stark reduziert ist und kaum zirkadiane Unterschiede erkennbar sind. Diese «Drosselung» scheint entzündungsbedingt zu sein und spiegelt den Schweregrad der Erkrankung, eine Atemwegsobstruktion und bestehende Allergien der Patient:innen wider.32
REV-ERBα und RORα
REV-ERBα (auch bekannt als NR1D1) und RORα (oder NR1F1) sind nukleäre Rezeptoren, die an dieselbe DNA-Sequenz im Promotor des Gens BMAL1 binden. REV-ERBα unterdrückt die BMAL1-Expression, während RORα sie aktiviert. Diese gegensätzliche Wirkung ermöglicht eine feine Regulation der BMAL1-Expression und somit des zirkadianen Rhythmus der Zelle. Diese Interaktion ist wichtig für die zeitliche Steuerung verschiedener physiologischer Prozesse, einschliesslich der Immunfunktion, und könnte eine bedeutende Rolle bei der Feinabstimmung der Entzündungsreaktionen in den Atemwegen spielen.
Als Transkriptionsrepressor von BMAL1 und anderen proinflammatorischen Genen wird REV-ERBα als Bindeglied zwischen dem zirkadianen System und dem Immunsystem angesehen. REV-ERBα unterdrückt zum Beispiel die Transkription vieler Zytokine und Chemokine33 und des TranskriptionsfaktorsNF-B,34 allesamt wichtige proinflammatorische Mediatoren in der Pathogenese von Asthma. Ferner kann REV-ERBα die Migration von Eosinophilen und Neutrophilen hemmen sowie die Polarisation von Makrophagen beeinflussen und somit die chronische Entzündung in den Atemwegen dämpfen.14,35 Studien haben gezeigt, dass die nächtliche Intensivierung der Asthmasymptome mit der Aktivität von REV-ERBα zusammenhängen könnte: Wird REV-ERBα experimentell unterdrückt, gehen die tageszeitlichen Unterschiede in der bronchialen Hyperreagibilität verloren.36
RORα, der Gegenspieler von REV-ERBα, fördert die Differenzierung und Funktion von Th2-37 und Th17-Zellen,38 die beide eine Schlüsselrolle bei der Typ-2-Entzündung und steroidresistenten Asthmaformen einnehmen. Die experimentelle Inaktivierung von RORα führt zu einer deutlichen Verbesserung der Atemwegsentzündung und hat einen positiven Effekt auf die bronchiale Hyperreagibilität.14,32,39 Ferner konnten wir zeigen, dass die pharmakologische Hemmung von RORα die Proteinexpression der einzelnen Komponenten der molekularen zirkadianen Uhr wieder normalisiert, die «innere Uhr» der Zellen wieder aktiviert und dabei zu einer Verbesserung der bronchialen Entzündung und der Lungenfunktion führt.32
Klinische Bedeutung
Die Berücksichtigung des zirkadianen Rhythmus könnte für die Asthmadiagnostik beispielsweise bei der Interpretation von Lungenfunktionstests und FeNO-Messungen von Bedeutung sein. Durrington et al. haben kürzlich gezeigt, dass die Durchführung am Morgen die Sensitivität der FeNO-Bestimmung und des Bronchospasmolysetests erhöht.25
Auch ein chronotherapeutischer Ansatz, bei dem versucht wird, Wirkstoffkonzentration und Einnahmezeitpunkt mit dem Rhythmus der Krankheitsaktivität zu synchronisieren, kann den Therapieerfolg erhöhen und Nebenwirkungen verringern. Beispielsweise ist der Cortisolspiegel physiologisch zwischen 6 und 8 Uhr morgens am höchsten und zwischen 22 und 24 Uhr am niedrigsten. Mehrere Studien haben bestätigt, dass die Einnahme von Glukokortikoiden (systemisch und inhalativ) gegen 15 Uhr am wirksamsten ist, um die Atemwegsentzündung und den frühmorgendlichen FEV1-Abfall bei Patient:innen mit nächtlichem Asthma zu vermindern, ohne dabei eine Nebenniereninsuffizienz hervorzurufen.18,40–44
Betamimetika können sich aufgrund ihres Nebenwirkungsprofils gelegentlich negativ auf den Schlaf auswirken; Studien haben hingegen bestätigt, dass vor allem lang wirksame Betamimetika einen positiven Einfluss auf die frühmorgendliche Lungenfunktion, die nächtlichen Symptome und somit auch auf die Schlafqualität der Patient:innen haben.45 Allerdings unterliegen ihre Pharmakokinetik und Pharmakodynamik stärkeren zirkadianen Schwankungen, was umfangreichere Untersuchungen zur Optimierung ihrer Anwendung in der Chronotherapie erforderlich macht.
Für den Leukotrienrezeptor-Antagonisten Montelukast wurde gezeigt, dass sich eine abendliche Einzeldosis positiver auf die Lungenfunktion auswirkt als eine morgendliche Gabe.46 Ferner könnte die gezielte pharmakologische Beeinflussung der molekularen zirkadianen Uhr in Zukunft eine entzündungshemmende und bronchoprotektive Therapieoption für Asthmatiker:innen darstellen.
Literatur:
1 Krakowiak K, Durrington HJ: Pulm Ther 2018; 4: 29-43 2 Janson C et al.: Eur Respir J 1996; 9: 2132-8 3 Lewis MJ et al.: Respir Med 2006; 100: 1688-705 4 Kraft M: Eur Respir J 1999; 14: 1403-17 5 Calhoun WJ et al.: Am Rev Respir Dis 1992; 145: 577-81 6 Kraft M et al.: Am J Respir Crit Care Med 1999; 159: 228-34 7 Dimitrov S et al.: Blood 2009; 113: 5134-43 8 Durrington HJ et al.: Am J Respir Crit Care Med 2018; 198: 1578-81 9 Kelly EAB et al.: Clin Exp Allergy 2004; 34: 227-33 10 Tang L et al.: Front Immunol 2022; 13: 947067 11 Sutherland ER et al.: J Allergy Clin Immunol 2003; 112: 513-7 12 Durrington HJ et al.: Am J Respir Crit Care Med 2019; 199: 392-4 13 Turki J et al.: J Clin Invest 1995; 95: 1635-41 14 Teppan J et al.: Front Immunol 2024; 15: 1408772 15 Turner-Warwick M: Am J Med 1988; 85: 6-8 16 Durrington HJ et al.: Thorax 2014; 69: 90-2 17 Spengler CM, Shea SA: Am J Respir Crit Care Med 2000; 162: 1038-46 18 Litinski M et a.: Sleep Med Clin 2009; 4: 143-63 19 Nosal C et al.: Annu Rev Physiol 2020; 82: 391-412 20 Spengler CM et al.: J Physiol 2000; 526: 683-94 21 Pick R et al.: Trends Immunol 2019; 40: 524-37 22 Martin RJ et al.: Am Rev Respir Dis 1991; 143: 351-7 23 Jarjour NN et al.: Am Rev Respir Dis 1992; 146: 905-11 24 Wilkinson M et al.: Eur Respir J 2019; 54: 1901068 25 Wang R et al.: ERJ Open Res 2024; 10: 00916-2023 26 Ueyama T et al.: Nat Neurosci 1999; 2: 1051-3 27 Fagiani F et al.: Signal Transduct Target Ther 2022; 7: 41 28 Zhang R et al.: Proc Natl Acad Sci USA 2014; 111: 16219-24 29 Hu B et al.: QJM 2024; 117: 631-7 30 Maidstone RJ et al.: Thorax 2021; 76: 53-60 31 Loudon AS et al.: Trends Genet 2000; 16: 477-81 32 Teppan J et al.: Molecular circadian clock of eosinophils: A potential therapeutic target for asthma. Manuskript eingereicht zur Publikation 33 Durrington HJ et al.: Eur Respir J 2020: 1902407 34 Roberts J et al.: J Immunol 2023; 211: 626-32 35 Wang R et al.: Nat Commun 2021; 12: 76 36 Jaradat M et al.: Am J Respir Crit Care Med 2006; 174: 1299-309 37 Reinberg A et al.: J Allergy Clin Immunol 1983; 71: 425-33 38 Beam WR et al.: Am Rev Respir Dis 1992; 146: 1524-30 39 Toogood JH et al.: J Allergy Clin Immunol 1982; 70: 288-98 40 Pincus DJ et al.: J Allergy Clin Immunol 1997; 100: 771-4 41 Kemp JP et al.: J Allergy Clin Immunol 2000; 106: 485-92 42 Masoli M et al.: Resp Med 2006; 100: 20-5 43 Gunn SD et al.: C Eur J Clin Pharmacol 1995; 48: 23-8 44 D’Alonzo GE et al.: Chest 1995; 107: 406-12 45 Konermann M et al.: Pneumologie 2000; 54: 104-9 46 Noonan MJ et al.: Eur Respir J 1998; 11: 1232-9
Das könnte Sie auch interessieren:
Wenig genützte Chance: COPD-Therapie abseits der Medikamente
Neben der medikamentösen Behandlung spielen im Management der COPD nicht-medikamentöse Maßnahmen eine wichtige Rolle. Dies betrifft vor allem die pulmonale Rehabilitation, die ...
Gewebeschädigung: Proteasen bahnen der Allergie den Weg
Warum entwickeln manche Menschen Allergien und andere nicht? Viele Aspekte dieser Frage sind nach wie vor ungeklärt. Auf der klinischen Seite zeigt sich zunehmend, dass die Behandlung ...