Déficit en alpha-1-antitrypsine: une tache aveugle aussi en pneumologie?
Auteur:
Dr méd. Alexander Rupp
Pneumologische Praxis im Zentrum, Stuttgart
E-mail: a.rupp@lunge-stuttgart.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le déficit en alpha-1-antitrypsine (DAAT) est considéré comme une maladie génétique rare, qui affecte principalement les poumons et le foie, mais avec une grande variabilité clinique. Pourtant, le DAAT n’est pas aussi rare qu’on pourrait le penser, il est plutôt sous-diagnostiqué.
Keypoints
-
Notre pratique actuelle en matière de DAAT néglige une grande partie des modifications génétiques et donc des personnes «à risque».
-
Dans les cliniques et les cabinets de pneumologie, (pratiquement) tous les patients devraient être évalués à la recherche d’un DAAT.
-
Plus le DAAT est détecté tôt, plus les dommages aux organes peuvent être évités par une modification du mode de vie, un suivi et un traitement adéquat et précoce.
-
Le seuil discriminatoire actuel ainsi que le résultat du génotypage doivent être évalués cliniquement dans leur contexte et, en cas de doute, un séquençage du gène SERPINA1 doit être effectué.
Il est fort probable que le déficit en alpha-1-antitrypsine (DAAT) n’est souvent pas diagnostiqué, car il n’est pas recherché de manière ciblée. Le DAAT serait donc une maladie «rare» souvent non reconnue et sa prévalence serait nettement plus élevée que ce que l’on pensait jusqu’à présent. Il est important de reconnaître tôt le DAAT afin de pouvoir prévenir des maladies irréversibles des poumons et du foie en modifiant les comportements et en amorçant un traitement. L’image du patient caractéristique du DAAT – un homme de 50 ans fumeur et atteint d’emphysème – doit être considérée comme obsolète.
Le déficit en alpha-1-antitrypsine
L’alpha-1-antitrypsine (AAT) est le principal inhibiteur des protéases dans les poumons. En présence de DAAT, des modifications génétiques (>200 variantes ont été décrites)1 sur l’un (forme hétérozygote) ou les deux gènes de l’alpha-1-antitrypsine (forme homozygote ou hétérozygote «composée», SERPINA1) entraînent une composition incorrecte de l’AAT dans les cellules hépatiques, le principal site de production. Il en résulte une diminution ou une absence d’élimination de l’AAT ou la libération d’une AAT dysfonctionnelle dans la circulation. Il se forme ainsi un excès d’AAT dans les cellules hépatiques, ce qui entraîne la perte et la destruction de la fonction cellulaire. Il en résulte une augmentation du risque de fibrose hépatique (chez 20 à 36% des patients présentant le génotype Pi*ZZ le plus fréquent),2 de cirrhose du foie et également de carcinome hépatocellulaire (CHC) à partir de l’âge de 50 ans environ.3
D’autres facteurs de risque, comme le sexe masculin, l’obésité, le diabète ou la consommation d’alcool, contribuent à augmenter le risque pour le foie.2,3 Un premier pic d’atteinte hépatique concerne déjà les nourrissons. Dans une cohorte suédoise, 120 nouveau-nés sur 200000 (0,06%) ont été trouvés porteurs du type homozygote Pi*ZZ, dont 12% présentant un ictère prolongé (cholestase néonatale) et 2 à 3% ayant nécessité une transplantation hépatique en cas d’insuffisance hépatique.4
Le déficit en AAT dans le sang, et ainsi, au niveau du principal site d’action, les poumons, entraîne une absence d’effet antiprotéolytique, notamment vis-à-vis de l’élastase neutrophile (NE), ce qui favorise la destruction des sacs alvéolaires et la formation d’un emphysème pulmonaire.5 Le tabagisme par inhalation, en particulier, constitue pour les patients atteints de DAAT un facteur de risque majeur d’apparition d’un emphysème pulmonaire (précoce, même avant l’âge de 40 ans).6 Le DAAT peut être à l’origine d’environ 1% des cas de BPCO et d’environ 2% des cas d’emphysème.5
Dans l’ensemble, le DAAT présente une grande variabilité en termes de présentation clinique, allant de porteurs de gènes homozygotes asymptomatiques à des porteurs de gènes hétérozygotes (fumeurs) gravement atteints.7 La valeur du VEMS s’est avérée être un mauvais paramètre de substitution; chez les patients atteints de DAAT, la diffusion devrait être particulièrement étudiée.7
Chiffres de prévalence actuels
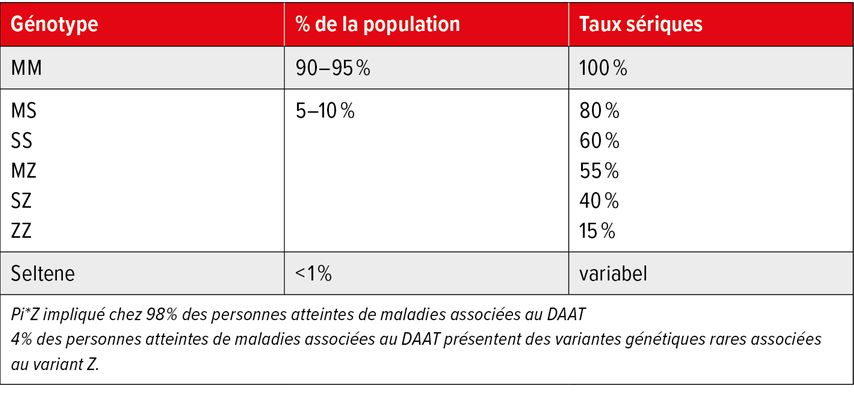
Il existe de nettes différences régionales dans la prévalence du DAAT dans le monde.8 Le variant M est le variant de type sauvage («normal»). Les variants cliniquement pertinents les plus fréquents dans le monde sont S et Z (entre 1 et 5% de la population; Tab. 1), suivis des variants plus rares (<1% de la population) F et I.1,3 La base de données ClinVar du National Center for Biotechnology Information (NCBI) répertorie aujourd’hui bien plus de 200 variants. Cependant, on estime que même dans les cas de DAAT graves, le nombre de cas non détectés est de 90%.1,2
Tab. 1: Fréquence et taux sériques des génotypes d’AAT les plus fréquents (modifié d’après Blanco I et al. 2017)8
La fréquence indiquée du gène Z (Pi*Z pour 1000 habitants) de 13 pour l’Europe centrale (DE, AT, CH, PL), de 20 pour l’Europe du Nord, de 17 pour l’Europe de l’Ouest, de 17 pour l’Europe du Sud et de 88 pour l’Europe de l’Est. La prévalence du DAAT grave (Pi*ZZ) et l’estimation du nombre de personnes touchées (entre parenthèses) pour les régions correspondantes sont de 1:5771 (Europe centrale; n=29903); 1:2041 (Europe du Nord; n=15553), 1:4992 (Europe occidentale; n=41046), 1:3785 (Europe du Sud; n=30118) et 1:35702 (Europe de l’Est; n=2954).
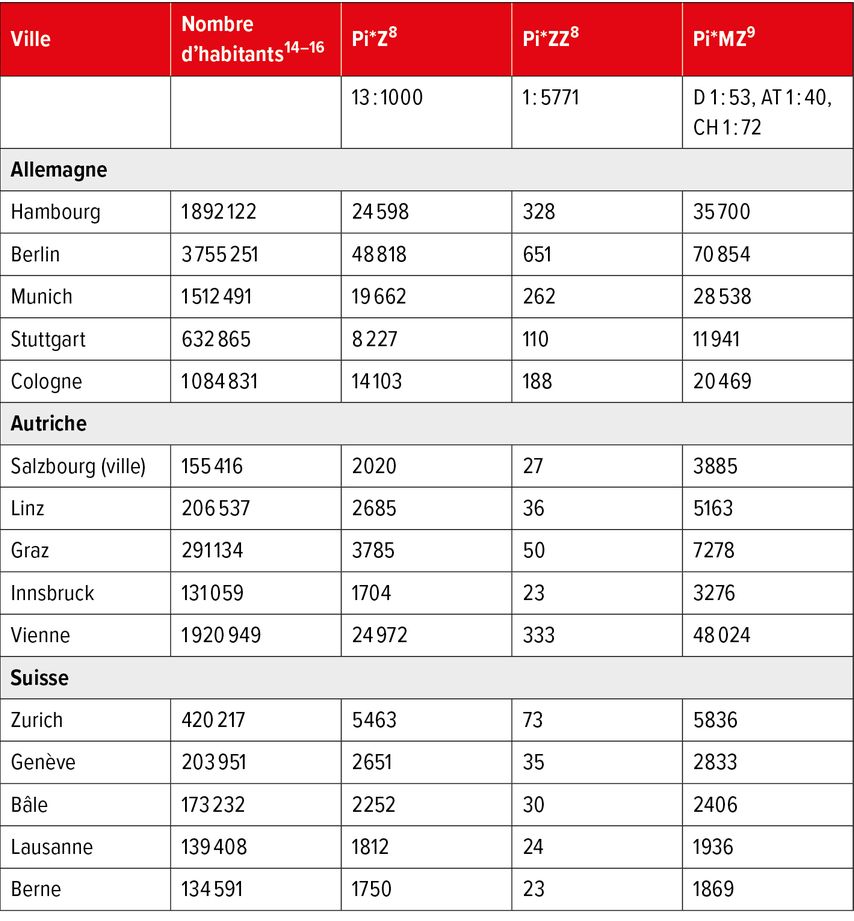
La fréquence du génotype Pi*MZ a été estimée à 1:58 habitants en Europe (1,1% de la population en Europe centrale). Dans les groupes de population d’origine européenne, 2 à 4% des personnes sont porteuses du génotype MZ. Dans les régions étudiées, on estime à plus de 35 millions le nombre de porteurs du génotype MZ. Le nombre élevé de porteurs de gènes hétérozygotes en Europe prend une importance particulière dans le contexte des taux de tabagisme toujours élevés dans les pays européens, car les patients fumeurs porteurs du génotype MZ présentent un risque accru d’emphysème pulmonaire et de BPCO par rapport aux patients non fumeurs porteurs du génotype MZ, et le risque hépatique9 semble également être plus élevé chez les patients adultes porteurs du génotype MZ. Le Tableau 2 montre les chiffres possibles pour Pi*Z, Pi*ZZ et Pi*MZ dans des villes représentatives d’Allemagne, d’Autriche et de Suisse.
Tab. 2: Chiffres pour Pi*Z, Pi*ZZ et Pi*MZ pour des villes représentatives d’Allemagne, d’Autriche et de Suisse
«Homme et 50 ans, fumeur et avec emphysème», on oublie!
En Allemagne, il existe actuellement, sous l’égide de l’Atemwegsliga e.V. 60 centres de références pour le DAAT pour adultes (42 cliniques, 18 cabinets médicaux) et 10 pour enfants (exclusivement des cliniques). Leur objectif est de fournir les meilleurs soins possibles aux patients atteints de DAAT.10
Notre propre cabinet fait partie des plus grands centres de référence pour le DAAT et suit actuellement plus de 300 patients atteints de DAAT, dont 52 (17%) avec un statut génétique homozygote Pi*ZZ, parmi lesquels 27 reçoivent un traitement de substitution. Chaque semaine, notre cabinet accueille en moyenne 1,6 nouveau patient atteint de DAAT – certains orientés par d’autres cabinets pour un suivi conjoint, d’autres se présentant personnellement pour un deuxième avis, mais la plupart sont liés à une détermination active du taux sérique d’AAT lors de chaque prise de sang au cabinet, qui a lieu indépendamment de l’indication de la prise de sang.
Cependant, nous sommes encore loin des chiffres calculés pour la seule ville de Stuttgart au tableau 2 (11941 Pi*MZ, 110 Pi*ZZ), ce qui souligne une fois de plus la problématique des cas non détectés et du sous-diagnostic.
Le portrait type que de nombreux collègues associent au DAAT est celui d’un patient répondant aux caractéristiques suivantes: «un homme de 50 ans, fumeur et avec emphysème». D’une part, cette image est erronée et, d’autre part, elle contribue au sous-diagnostic du DAAT. Dans notre collectif, 50% ont moins de 52 ans (âge médian), 59% sont de sexe féminin et plus de 55% ont reçu un diagnostic d’asthme. Le diagnostic «classique» de BPCO/emphysème n’est présent que chez 15% de nos patients atteints de DAAT.17
Dépistage du DAAT – Mission de prévention
Il existe deux approches différentes pour l’évaluation d’un DAAT. L’«équipe des cas graves» a pour objectif d’identifier les patients atteints de maladies pulmonaires attribuables à un DAAT grave (en règle générale, Pi*ZZ) et d’amorcer un traitement de substitution hebdomadaire par voie IV.
L’«équipe de prévention» souhaite détecter non seulement les maladies graves liées à la carence, mais aussi les altérations génétiques moins graves (comme Pi*MZ) – idéalement avant l’apparition de lésions pulmonaires ou hépatiques irréversibles, et traiter ces patients «à risque» de manière optimale en modifiant leur mode de vie (choix professionnel, abstinence du tabac, évitement/réduction des substances pneumotoxiques ou hépatotoxiques, régulation du poids, exercice physique, traitement de l’asthme et des allergies), en assurant un suivi régulier et en proposant un traitement adéquat, afin de réduire également le risque d’apparition future de lésions organiques. Les porteurs de gènes hétérozygotes présentent également un risque pulmonaire et hépatique, ainsi qu’un risque de maladie, comme la vascularite, les calculs biliaires ou la BPCO, en raison de facteurs génétiques concomitants ou d’influences environnementales.2 Ainsi, un odds ratio accru de 2,31 (1,60–3,35) a été trouvé pour l’apparition de BPCO chez les patients porteurs du génotype MZ par rapport aux patients porteurs du génotype MM.11
Si le DAAT n’est diagnostiqué que lorsque les poumons ou le foie présentent des lésions organiques, il est déjà trop tard. La «mission» de notre centre de référence pour le DAAT est de ne pas attendre pour détecter le DAAT qu’un patient de 47 ans avec un statut homozygote présentent un VEMS de 24% de la valeur théorique et une capacité de diffusion du monoxyde de carbone (DLCO) de 41% de la valeur théorique en raison du tabagisme par inhalation. Selon notre expérience, les avantages d’une détection précoce du DAAT l’emportent sur les inconvénients potentiels (Tab. 3). En présence d’un DAAT, les membres de la famille, le partenaire et les propres enfants devraient être inclus dans le conseil génétique (spécialisé) et, le cas échéant, être également testés.
Tab. 3: Avantages et inconvénients d’une détection précoce du DAAT (modifié d’après Miravitlles M et al. 2017 et Blanco I et al. 2017)7, 8
L’importance de la prévention est soulignée par les chiffres de la cohorte de naissance suédoise, dans laquelle un dépistage du DAAT a été effectué chez 200000 nouveau-nés entre 1972 et 1974. Parmi les nouveau-nés, 127 avaient le génotype Pi*ZZ, 2 le génotype Pi*ZQ0, 45 le génotype Pi*SZ et 1 le génotype Pi*SQ0. Les personnes touchées connaissaient donc leur risque dès la naissance, mais cette connaissance du risque ne les a pas toutes empêchées de commencer à fumer. Au suivi à l’âge de 37 à 40 ans, 4% des participants porteurs des génotypes ZZ et SZ étaient des fumeurs actifs et 18% et 11% étaient des ex-fumeurs,12 avec des limitations correspondantes des valeurs de la fonction pulmonaire chez les fumeurs actifs correspondant à une BPCO (indice de Tiffeneau <70%). Il n’y a malheureusement pas eu de mesure de la diffusion. De même, dans l’étude de Holm et al., les porteurs des génotypes MZ et SZ présentaient des taux de tabagisme plus élevés que les porteurs du génotype ZZ et des probabilités plus élevées d’adopter des comportements malsains comme la sédentarité et l’obésité.13
Les patients ayant une pneumopathie présentent déjà en soi un risque accru du DAAT que les personnes en bonne santé ou atteints de pathologies générales. C’est pourquoi les pneumologues en particulier devraient mesurer le taux sérique d’AAT chez leurs patients. Si le taux est inférieur au seuil dit discriminatif de 1,1g/l, il convient de procéder à un génotypage et, si le résultat est normal et que la suspicion clinique de DAAT d’origine génétique persiste, de procéder également au séquençage du gène SERPINA1.
Nous pensons que le seuil discriminatoire de 1,1g/l doit être considéré d’un œil critique, en particulier chez les jeunes patients, car 10% de nos patients avec un DAAT confirmé présentaient un taux sérique >1,1g/l. La sensibilité du seuil discriminatoire n’est que de 73,4% et la spécificité, de 88,5%.7 Le génotypage (qui comprend 14 génotypes dans notre laboratoire de référence de Marbourg et qui, en raison de la méthode, ne peut pas reconnaître les types Q0) n’est pas non plus la panacée, puisque dans 25% des cas pour lesquels un séquençage avait été demandé par nos soins alors que le génotypage était normal, un résultat positif avec une variante génétique «rare» a pu être trouvé. Dans de nombreux cas, la pertinence clinique des variantes génétiques rares n’est pas du tout claire en raison du faible nombre de cas dans le monde, mais les patients peuvent être surveillés après le diagnostic et devraient être inclus dans le registre européen (EARCO) afin d’obtenir des données d’observation longitudinales.
Littérature:
1 Ferrarotti I et al.: Orphanet J Rare Dis 2024; 19: 82 2 Strnad P et al.: N Engl J Med 2020; 382: 1443-55 3 Fromme M et al.: J Hepatol 2022; 76: 946-58 4 Sveger T: N Engl J Med. 1976; 294: 1316-21 5 Mornex JF et al.: Presse Médicale. 2023; 52: 104170 6 Mostafavi B et al.: Int J Chron Obstruct Pulmon Dis 2018; 13: 3689-98 7 Miravitlles M et al.: Eur Respir J 2017; 50: 1700610 8 Blanco I et al.: Int J Chron Obstruct Pulmon Dis 2017; 12: 561-9 9 Martinez-González C et al.: Int J Chron Obstruct Pulmon Dis 2021; 16: 2617-30 10 Atemwegsliga: Alpha-1-Center in Deutschland. https://www.alpha-1-center.org/alpha-1-center.html 11 Hersh CP: Thorax 2004; 59: 843-9 12 Piitulainen E et al.: Int J Chron Obstruct Pulmon Dis 2017; 12: 495-500 13 Holm KE et al.: Respir Med 2018; 143: 48-55 14 Statistische Ämter des Bundes und der Länder. Gemeindeverzeichnis Deutschland 2022 15 Statistik Austria: Gemeindeverzeichnis Österreich. 16 Bundesamt für Statistik Schweizerische Eidgenossenschaft: Regionalporträts 2021: Kennzahlen aller Gemeinden. 17 Rupp A et al.: Caractéristiques des patients atteints de déficit en alpha-1-antitrypsine au Alpha1-Center Pneumologische Praxis im Zentrum, Stuttgart; données personnelles. Mise à jour 6.3.2024
Das könnte Sie auch interessieren:
Revue de presse: L’importance d’objectifs thérapeutiques centrés sur les patient·es dans la SLA
Dans une revue récente, Chio et al., mettent en lumière la nécessité de repenser les critères d’évaluation dans les essais cliniques portant sur la sclérose latérale amyotrophique (SLA ...
L’asthme et le rythme circadien
Le rythme circadien ne joue pas seulement un rôle important dans le sommeil, il a également une influence considérable sur les crises d’asthme et la fonction pulmonaire. Le ciblage ...
Les défis du diabète de type 1
Dans le cas du diabète de type 1, surtout s’il ne se déclare qu’à l’âge adulte, la pose du diagnostic peut déjà constituer un défi. Le risque d’hypoglycémie, qu’il faut minimiser, et le ...