Actualités en hépatologie
Compte-rendu: Dre Katrin Spiesberger
Rédactrice
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Des travaux sur les risques après la mise en place d’un TIPS ont récemment été publiés et une nouvelle directive S3 sur les maladies auto-immunes du foie est désormais disponible. Il y a aussi des actualités sur la désinfection du virus de l’hépatite A, et une publication sur la fonction des cellules stellaires hépatiques a été publiée dans la revue Nature.
Risques après la mise en place d’un TIPS
Le shunt portosystémique intrahépatique transjugulaire (TIPS) est une procédure importante et innovante dans le traitement de la décompensation hépatique. Il fait baisser la pression portale et peut prévenir des complications telles que les hémorragies internes. Le pronostic après la mise en place d’un TIPS est toutefois difficile. Le German Cirrhosis Study Group vient de publier deux études sur l’évaluation du risque après la mise en place d’un TIPS, dont les conclusions pourraient aider à surveiller les patient·es ayant un TIPS de manière plus ciblée à l’avenir et à prendre des mesures précoces pour prévenir les complications.
FIPS pour l’évaluation du risque
L’objectif de la première étude était de caractériser l’évolution clinique après la mise en place d’un TIPS à l’aide du Freiburg Index of Post-TIPS Survival (FIPS).1 Le FIPS permet une très bonne stratification des patient·es en un groupe à haut risque avec une survie significativement réduite après la mise en place d’un TIPS et un groupe à faible risque.
Au total, 1359 patient·es atteint·es de cirrhose, qui avaient été programmé·es pour la mise en place d’un TIPS pour le traitement d’une ascite récidivante ou réfractaire, ou pour la prévention secondaire d’une hémorragie variqueuse, ont été inclus·es de manière rétrospective. L’évolution clinique des patient·es après la mise en place d’un TIPS a été analysée de manière stratifiée selon le FIPS. Le résultat primaire de l’étude était une autre décompensation dans les 90 jours suivant un TIPS; les résultats secondaires comprenaient une insuffisance hépatique aiguë sur chronique (ACLF) dans les 90 jours et une survie sans transplantation à 1 an.
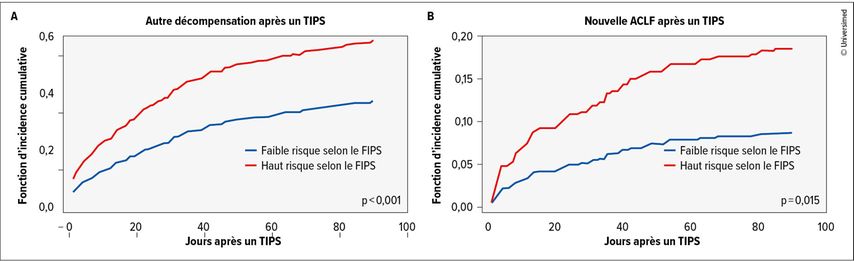
Une autre décompensation après la mise en place d’un TIPS est survenue significativement plus souvent dans les 90 jours chez les patient·es à haut risque selon le FIPS par rapport à chez les patient·es à faible risque (fonction d’incidence cumulative: 0,58 vs 0,38; p<0,001; Fig.1A). En outre, les patient·es à haut risque selon le FIPS étaient significativement plus susceptibles de développer une ACLF (0,18 vs 0,08; p=0,008; Fig.1B). Les analyses de régression uni- et multivariée du risque concurrent ont confirmé que les patient·es à haut risque selon le FIPS prédisaient de manière indépendante une autre décompensation (subdistribution HR: 1,974; IC à 95%: 1,531–2,544; p<0,001) et une ACLF (subdistribution HR: 2,586; IC à 95%: 1,449–4,616; p=0,001) après un TIPS.1 Il est important de noter qu’une décompensation supplémentaire et une ACLF après un TIPS étaient associées à une réduction significative de la survie sans transplantation.
Fig.1: Probabilité de survenue d’une autre décompensation (A) et d’une nouvelle ACLF (B) après un TIPS (en tenant compte du décès et de la transplantation hépatique comme risques concurrents) dans les 90 jours (fonction d’incidence cumulative) chez les patient·es à haut risque et à faible risque selon le FIPS (modifiée selon Sturm L et al. 2025)1
Les résultats montrent que le FIPS est approprié pour prédire la survenue d’une autre décompensation et d’une ACLF après la mise en place d’un TIPS.
Importance pronostique de l’encéphalopathie hépatique
L’encéphalopathie hépatique (EH) est une complication fréquente après la mise en place d’un TIPS, mais l’importance pronostique d’une EH après un TIPS reste controversée. Cette deuxième étude du German Cirrhosis Study Group a porté sur 2137 patient·es ayant eu un TIPS entre 2004 et 2021.2 Les patient·es ayant eu un TIPS préventif, ceux·lles atteint·es d’un carcinome hépatocellulaire, les données manquantes et les stents non couverts en PTFE ont été exclus. Les données de résultats ont été évaluées jusqu’à 30 mois après la mise en place d’un TIPS.
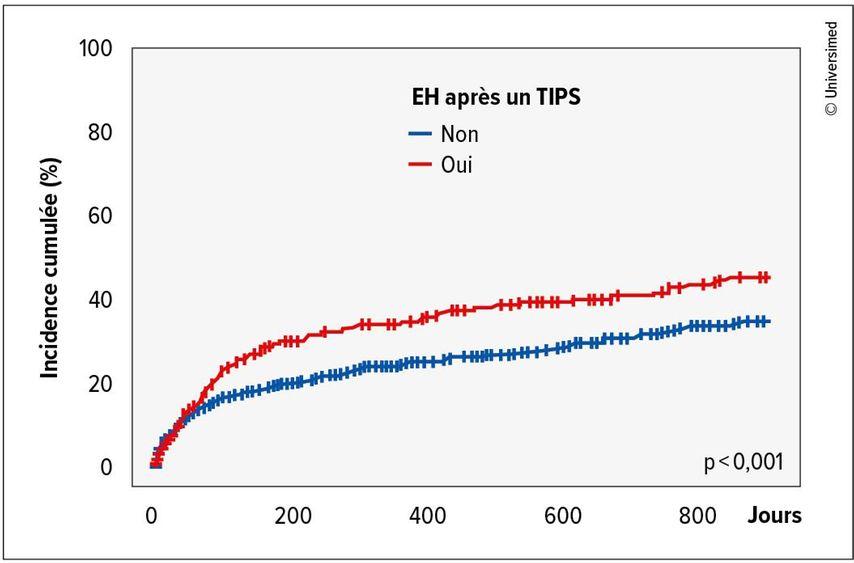
Au total, 1356 patient·es (score MELD moyen: 13, âge moyen: 60, 64% d’hommes, 12% d’EH avant un TIPS) ont été inclus·es. En général, une EH après un TIPS était associée à une survie plus courte (subdistribution [s]HR: 1,41; IC à 95%: 1,15–1,73; p<0,001; Fig.2). On a également examiné si le grade d’EH avait une influence sur la survie: aucune différence de survie n’a été constatée entre les patient·es présentant une EH de grade 2 et ceux·lles présentant une EH de grade 3/4.
Fig.2: Incidence cumulée des décès chez les patient·es avec/sans EH après un TIPS (modifiée selon Kabelitz MA et al. 2025)2
Le délai médian de survenue d’une EH était de 26 jours dans la cohorte, raison pour laquelle une classification en EH précoce (survenant dans les 30 jours suivant un TIPS) et tardive (survenant plus de 30 jours après un TIPS) a été effectuée. Dans l’analyse de la cohorte totale, les patient·es ayant connu une EH précoce après un TIPS ont présenté une survie significativement plus courte que ceux·lles n’ayant pas connu d’EH après un TIPS (EH précoce; sHR: 2,02; IC à 95%: 1,59–2,57; p<0,001). En revanche, des taux de survie similaires ont été observés entre les patient·es présentant une EH tardive après un TIPS et ceux·lles ne présentant pas d’EH.
En outre, les patient·es ayant des antécédents d’EH (sHR: 1,59; IC à 95%: 1,21–2,07; p<0,001) et ceux·lles ayant des antécédents d’EH et une EH précoce après un TIPS (sHR: 3,44; IC à 95%: 2,34–5,04; p<0,001) ont présenté une survie plus courte. Ces résultats ont été confirmés par les analyses de référence et celles multivariées.2
L’étude révèle qu’une EH précoce après un TIPS est associée à une survie significativement plus courte. Par conséquent, les patient·es qui présentent une EH précoce ou qui ont des antécédents d’EH doivent faire l’objet d’une surveillance étroite.
Directive S3 sur les maladies auto-immunes du foie
Les maladies auto-immunes du foie sont rares, pour autant les plus fréquentes parmi les maladies rares du foie. La directive récemment publiée par la Société allemande de gastroentérologie et des maladies digestives et métaboliques (DGVS) fournit pour la première fois des normes de diagnostic et de traitement de niveau S3 fondées sur des preuves.3 Sous la direction d’Ansgar W. Lohse, de Hambourg, le document aborde en particulier la transition des patient·es pédiatriques vers l’âge adulte. Alors que la cholangite biliaire primitive (CBP) se manifeste presque exclusivement à l’âge adulte, la cholangite sclérosante primitive (CSP) et l’hépatite auto-immune (HAI) surviennent parfois dès le début de l’enfance ou de l’adolescence.
Diagnostic général
Les principales recommandations concernant le diagnostic: en cas de suspicion clinique d’une HAI, il convient de procéder initialement à une détermination quantitative de l’immunoglobuline G ainsi que des anticorps anti-nucléaires (ANA), des anticorps anti-muscle lisse (SMA)/anti-actine et des anticorps anti-SLA/LP. Pour confirmer le diagnostic, une biopsie hépatique doit être effectuée aussi bien chez les enfants que chez les adultes. Pour évaluer le pronostic des patient·es adultes atteint·es d’une maladie auto-immune du foie, une élastographie transitoire est indiquée pour discriminer un stade précoce ou avancé de la maladie.
HAI
Dans le cas de l’HAI, la nouveauté est qu’il faut viser à la fois l’induction et le maintien d’une rémission complète afin d’éviter la progression. Le diagnostic et l’adhésion thérapeutique doivent être revus si une rémission biochimique complète n’est pas obtenue après 6 mois. Les corticoïdes doivent être utilisés pour induire la rémission. Contrairement aux recommandations antérieures, une dose ≤0,5mg/kgPC/j de prednisolone est généralement suffisante chez les adultes. À moyen et à long terme, il convient toutefois de viser l’azathioprine en monothérapie afin d’éviter les effets secondaires des corticoïdes.
CBP
Les recommandations concernant le diagnostic et le traitement de la CBP ont également été mises à jour. Pour diagnostiquer une CBP, 2 critères sur 3 doivent être remplis:
1. augmentation des paramètres de cholestase (notamment augmentation des phosphatases alcalines [AP])
2. détection d’anticorps anti-mitochondries (AMA), en particulier les AMA-M2, ou d’anticorps anti-nucléaires (ANA) spécifiques de la CBP
3. histologie typique avec cholangite destructrice, non suppurée, chronique
Le traitement de référence de la CBP est l’acide ursodésoxycholique (UDCA) à une dose de 13–15mg/kgPC/j à vie. En cas de prurit, la résine échangeuse d’ions colestyramine peut être utilisée en complément, à intervalles de 2 à 4 heures de la prise d’UDCA et, éventuellement, d’autres médicaments. Si les patient·es ne l’ont pas encore reçu dans le cadre de leur traitement, le bézafibrate peut être utilisé comme alternative («off-label use»).
La stratification du risque actualisée ainsi que la définition de nouveaux objectifs thérapeutiques n’ont pas encore été intégrées dans cette directive S3. Il convient de passer à un traitement de deuxième ligne si, après 6 à 12 mois de traitement par l’UDCA, aucune rémission biochimique n’est obtenue, au sens d’une normalisation des taux d’AP et de bilirubine. Les nouvelles options thérapeutiques autorisées en deuxième ligne sont seulement mentionnées dans la directive: dans les études d’autorisation, les agonistes du PPAR élafibranor et séladépar ont entraîné des réponses biochimiques et se sont en outre avérés efficaces contre le prurit et la fatigue associée à la CBP.
CSP
Les principales recommandations relatives à la CSP concernent notamment le diagnostic ainsi que la nomenclature et le traitement des sténoses des voies biliaires: la présence d’une CSP doit faire l’objet d’un diagnostic différentiel en premier lieu par IRM, y compris cholangio-pancréatographie par résonance magnétique (MRCP), en cas de paramètres de cholestase durablement élevés. Afin d’uniformiser la nomenclature, il est recommandé de qualifier de «haut grade» les sténoses des voies biliaires dans la CSP lorsque l’IRM/MRCP révèle une sténose détectable du conduit hépatocholédoque (DHC), du canal hépatique droit (DHD) ou du conduit hépatique gauche (DHS) avec une réduction >75% du diamètre du conduit. En présence d’une sténose de haut grade associée à des symptômes et/ou des signes de cholestase obstructive ou de cholangite bactérienne, il convient d’utiliser le terme «sténose cliniquement significative».
La procédure privilégiée pour le traitement interventionnel endoscopique des sténoses des voies biliaires doit être la dilatation au ballonnet (éventuellement après une dilatation préalable à la bougie). Dans des cas isolés ou en cas de réponse thérapeutique insuffisante, un stent peut être posé pendant moins de 6 semaines. Le bézafibrate ou la rifampicine doivent également être utilisés pour le traitement du prurit chez les patient·es atteint·es de CSP.
Grossesse
Pour les patientes atteintes d’HAI ayant un désir d’enfant, il est conseillé de consulter le médecin de premier recours, surtout en ce qui concerne les médicaments utilisés, car certains sont embryotoxiques. Il convient également de noter que l’HAI, par exemple, s’accompagne souvent d’une poussée post-partum. En principe, il n’est pas nécessaire de déconseiller une grossesse aux patientes atteintes de CSP sans fibrose hépatique avancée, hypertension portale ou complication. Il faut toutefois souligner que le taux d’accouchements prématurés et par césarienne peut être plus élevé.
Transplantation hépatique
Une transplantation hépatique doit être envisagée chez les patient·es atteint·es de CBP et d’HAI au stade de cirrhose du foie qui ne présentent pas de réponse biochimique suffisante au traitement de référence. Ceux·lles qui souffrent d’une HAI aiguë sévère doivent prendre contact avec un centre de transplantation sans tarder. Il en va de même pour les patient·es pédiatriques atteint·es de maladies auto-immunes du foie: si aucune réponse biochimique n’est observée après 12 mois de traitement de première ligne ou s’il·elles présentent une manifestation aiguë avec une synthèse altérée (INR ≥2,0 ou INR ≥1,5 et EH), il·elles doivent être présenté·es à un centre de transplantation hépatique pédiatrique. Le plus tôt sera le mieux.
Peu de désinfectants inactivent le virus de l’hépatite A
Le virus de l’hépatite A (VHA) est responsable d’environ 159millions d’infections et de 39000 décès par an dans le monde. Le mode de transmission primaire est féco-oral, par ingestion d’eau et d’aliments contaminés. En cas de nombre élevé d’infections, il est conseillé de désinfecter les surfaces, bien que les données sur la stabilité des surfaces et la sensibilité aux désinfectants de surface soient limitées. Il s’avère désormais que le VHA est plus résistant qu’on ne le pensait jusqu’à présent.
La stabilité du VHA sur des disques en acier inoxydable pendant une période de 60 jours et sa sensibilité à neuf désinfectants de surface commercialisés différents ont été étudiées.4 Les disques en acier ont été inoculés avec des particules de VHA et incubés pendant une période correspondante. En outre, la résistance du VHA à différents groupes de désinfectants a été testée à différentes concentrations et pendant différentes durées d’action, conformément aux directives du fabricant. Il s’est avéré que le VHA pouvait être retrouvé sur des disques en acier inoxydable pendant une durée allant jusqu’à 40 jours, avec une demi-vie estimée à 18,63 jours. À l’exception des produits à base d’aldéhyde, tous les produits étudiés n’inactivaient pas suffisamment le VHA.4
Les cellules stellaires hépatiques contrôlent la fonction et la régénération du foie
Les cellules stellaires hépatiques (CSH) jouent un rôle central dans la pathogenèse de la fibrose hépatique. Cependant, leurs fonctions indépendantes de la fibrose et homéostatiques restent encore trop peu connues. Dans la revue Nature, des scientifiques de la Faculté de médecine de Mannheim, de l’Université de Heidelberg et de l’Université de Columbia, New York, décrivent maintenant que les cellules stellaires sont essentielles à la régénération ainsi qu’au métabolisme du foie.5
À l’aide de souris déplétées en CSH, il·elles ont montré que l’absence de CSH modifie l’activité de la voie de signalisation Wnt et la zonation des hépatocytes, ce qui entraîne des changements significatifs dans la régénération du foie, le métabolisme du cytochrome P450 et les lésions. La R-Spondin 3 (RSPO3), qui est produite de préférence dans les cellules stellaires et qui contrôle l’importante voie de signalisation Wnt dans les cellules hépatiques, a été identifiée comme responsable de ces fonctions régulatrices des hépatocytes des CSH. La délétion sélective de RSPO3 par les CSH a eu les mêmes effets que la déplétion des CSH sur l’expression du gène des hépatocytes, la zonation, la taille du foie, la régénération et la détoxification médiée par le cytochrome P450, et aggrave la maladie hépatique stéatosique associée à l’alcool et à un dysfonctionnement métabolique.5
L’expression de RSPO3 diminue avec l’activation des CSH: de faibles niveaux de RSPO3 ont été associés à une évolution défavorable de la maladie chez les patient·es atteint·es de maladie hépatique stéatosique associée à l’alcool et à un dysfonctionnement métabolique. Les fonctions protectrices et régulatrices des hépatocytes des CSH sont donc médiées par RSPO3 et doivent être intégrées dans les concepts thérapeutiques actuels. Au lieu de se focaliser exclusivement sur l’inhibition des cellules stellaires pour empêcher le développement de la fibrose, les futurs traitements pourraient se concentrer sur les fonctions protectrices des CSH.
Littérature:
1 Sturm L et al.: J Hepatol 2025: S0168-8278(25)00067-4 2 Kabelitz MA et al.: Clin Gastroenterol Hepatol 2025: S1542-3565(25)00203-4 3 Lohse AW et al.: Seltene Lebererkrankungen (LeiSe LebEr) – autoimmune Lebererkrankungen von der Pädiatrie bis zum Erwachsenenalter. S3-Leitlinie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). 2025. AWMF-Registernummer: 021-027 4 Pottkämper L et al.: J Hosp Infect 2025; S0195-6701(25)00061-1 5 Sugimoto A et al.: Nature 2025; doi: 10.1038/s41586-025-08677-w
Das könnte Sie auch interessieren:
Thérapies physiques en cas d’arthrite – nécessaires et utiles?
Le traitement des maladies articulaires rhumatismales inflammatoires a profondément évolué au cours des deux dernières décennies grâce à l’introduction de médicaments innovants: ...
Cancer du rein – stratégies actuelles et perspectives thérapeutiques futures
Les carcinomes rénaux non à cellules claires (non-ccRCC) sont pris en charge selon les mêmes standards que les carcinomes rénaux à cellules claires (ccRCC), mais les résultats ...
Chutes chez les personnes âgées: elles sont d’issue potentiellement fatale, mais aussi évitables
Les chutes chez les personnes âgées sont fréquentes et peuvent avoir de graves conséquences, mais elles ne sont souvent pas signalées par les personnes concernées en raison d’un ...