Thérapie ciblée avec des inhibiteurs d’IDH: études et utilisation clinique
Auteur:
Prof. Dr méd. Andreas Hottinger,MD, PhD
Gründungsdirektor des Zentrums für Hirn- und Wirbelsäulentumore, CHUV
Leiter der Neuroonkologie
Centre Hospitalier Universitaire Vaudois, CHUV, Lausanne
E-mail: andreas.hottinger@chuv.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Les gliomes de bas grade (LGG) sont un groupe hétérogène de tumeurs cérébrales primaires, classées dans la catégorie de grade2 de l’OMS, comprenant les astrocytomes et les oligodendrogliomes. Ils surviennent principalement chez les jeunes adultes et représentent environ 17 à 22% de toutes les tumeurs cérébrales primaires. Avec une incidence de 0,15 à 0,5 pour 100000 habitants, environ 20 à 40 nouveaux cas sont diagnostiqués chaque année en Suisse. Malgré leur nature fondamentalement incurable, les LGG peuvent rester stables pendant des années, présenter une croissance lente ou se transformer en gliomes plus agressifs au cours de la maladie. La survie médiane des patient·es atteint·es de gliomes à mutation du gène IDH varie entre cinq et quinze ans, en fonction de facteurs tels que l’histologie, le grade, la localisation de la tumeur et les caractéristiques moléculaires.
LGG à mutation du gène IDH
La découverte de mutations dans le gène de l’isocitrate déshydrogénase (IDH) en tant que facteur clé de la formation de tumeurs a considérablement transformé la manière dont nous comprenons les gliomes de bas grade (LGG), leur pronostic et les approches thérapeutiques.
Depuis la classification de l’OMS de 2021, les mutations IDH sont une composante moléculaire nécessaire au diagnostic des oligodendrogliomes et des astrocytomes de grade2 ou 3 de l’OMS. Plus de 80% de ces mutations concernent l’échange d’acides aminés R132H dans le gène IDH1. Il est rare de trouver des mutations à d’autres endroits du gène IDH1 ou dans le gène IDH2. Les enzymes IDH mutées transforment l’α-cétoglutarate (α-KG) en oncométabolite D-2-hydroxyglutarate (D-2HG). L’accumulation de D-2HG perturbe le métabolisme cellulaire normal et la régulation épigénétique en inhibant les enzymes α-KG-dépendantes telles que les histones déméthylases et les enzymes de réparation de l’ADN. Cette reprogrammation épigénétique contribue au développement et à la progression des tumeurs.
Les mutations IDH ont des implications cliniques importantes:
-
Les patient·es atteint·es de LGG à mutation IDH ont un meilleur pronostic que ceux/celles atteint·es de gliomes de type sauvage IDH.
-
Les tumeurs sans mutations IDH sont classées comme des glioblastomes, indépendamment de leur aspect histopathologique.
-
Les mutations IDH sont associées à des modifications génétiques concomitantes caractéristiques telles que la codélétion 1p/19q (dans les oligodendrogliomes) ou les mutations TP53 (dans les astrocytomes).
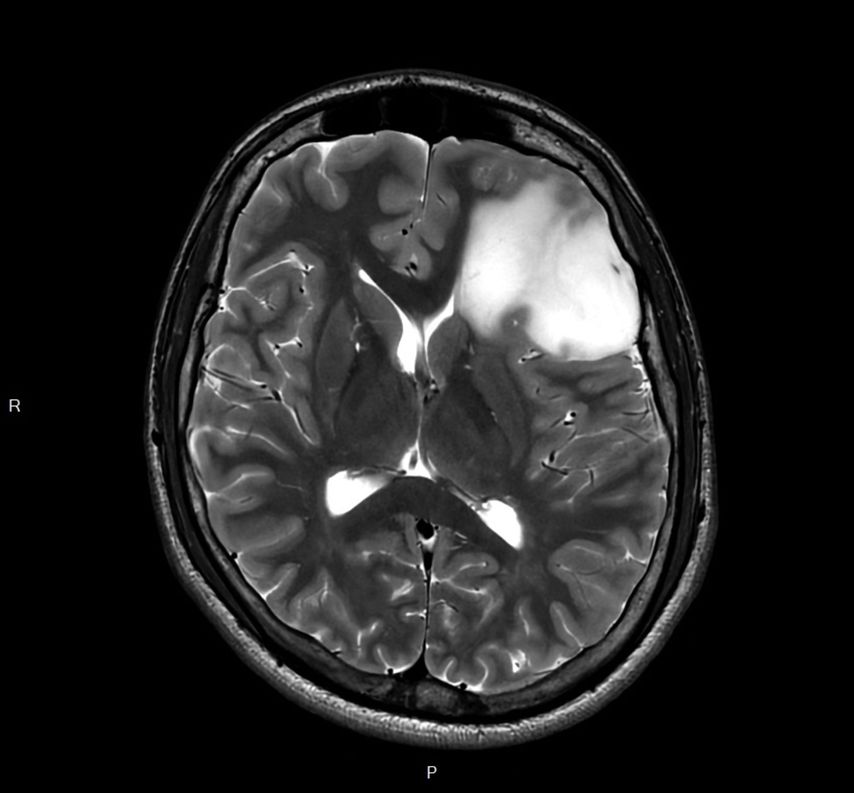
Fig.1: Image IRM d’un astrocytome de grade2 de l’OMS dans le lobe frontal gauche. Séquence T2
Inhibiteurs de l’IDH
La découverte du fait que les mutations IDH sont des moteurs centraux de l’apparition de LGG a permis de développer des thérapies ciblées comme celles utilisant des inhibiteurs IDH. Ces inhibiteurs inhibent l’activité anormale de l’enzyme IDH mutée, bloquent la production de D-2HG et rétablissent les fonctions cellulaires et épigénétiques normales.
Parmi les inhibiteurs de l’IDH développés figurent l’ivosidenib et l’enasidenib, déjà approuvés depuis des années pour le traitement de la leucémie myéloïde aiguë à mutation de l’IDH. Dans les études précliniques sur les LGG, les inhibiteurs d’IDH ont réduit les taux de D-2HG, amélioré l’activité enzymatique et influencé positivement la prolifération ainsi que la différenciation des cellules de gliome.
Études cliniques sur les inhibiteurs de l’IDH en cas de LGG
Le vorasidenib, un inhibiteur de l’IDH1/IDH2 spécialement conçu pour franchir la barrière hémato-encéphalique, est la substance active la plus étudiée dans le cas des LGG. Dans les premiers essais cliniques, le vorasidenib s’est avéré sûr et bien toléré, les troubles enzymatiques hépatiques étant l’effet secondaire le plus fréquent (chez environ 18% des patient·es).
L’étude de phaseIII INDIGO a étudié le vorasidenib chez 331patient·es atteint·es de LGG de grade2 de l’OMS qui n’avaient pas reçu de radiothérapie ou de chimiothérapie pendant au moins un an après l’intervention chirurgicale. Les résultats étaient les suivants:
-
survie sans progression: 27,7mois (vorasidenib) vs 11,1mois (placebo); HR: 0,39; IC à 95%: 0,27–0,56; p=0,000000067. Il faut souligner que la progression radiologique a été réalisée en aveugle par des neuroradiologues indépendants.
-
«time to next intervention» (TTNI): non atteint (vorasidenib) vs 17,4mois (placebo); HR: 0,26; IC à 95%: 0,15–0,43; p=0,000000019). Celle-ci représente l’évaluation de la progression par les médecins traitants.
Des études corrélatives ont également montré que la qualité de vie était identique dans les deux groupes et que les patient·es conservaient une fonctionnalité élevée. L’incidence des convulsions était également plus faible chez les patient·es recevant le vorasidenib. Il est important de souligner qu’aucune donnée sur la survie des patient·es n’est encore disponible.
Ces résultats ont conduit à l’autorisation du vorasidenib pour les patient·es atteint·es de LGG par la FDA américaine et par Swissmedic (décembre 2024). Il est maintenant important de comprendre comment cette nouvelle modalité de traitement peut être combinée avec les approches classiques. Cela est d’autant plus pertinent que les critères d’inclusion de l’étude INDIGO et des études antérieures sur les LGG couvraient différentes catégories de patient·es.
Traitement des patient·es atteint·es de gliomes de bas grade
Le traitement des LGG nécessite une approche multidisciplinaire. Le choix du traitement optimal dépend de la taille de la tumeur, de sa localisation, du profil moléculaire et de l’état général du/de la patient·e.
Une combinaison de radiothérapie et de chimiothérapie (PCV) s’est avérée supérieure à la radiothérapie seule dans une étude de phaseIII portant sur des patient·es atteint·es de LGG définis comme «à haut risque» (tous/toutes les patient·es avaient plus de 40ans ou avaient subi une résection incomplète). En conséquence, la majorité des patient·es ont été traité·es par radiothérapie et chimiothérapie combinées après une ablation neurochirurgicale de la tumeur, bien que le traitement soit associé à un risque d’effets secondaires à long terme, y compris des troubles neurocognitifs.
L’étude INDIGO a montré que le vorasidenib pouvait retarder l’utilisation de la radiothérapie et de la chimiothérapie chez certain·es patient·es. Il devrait être proposé en particulier aux patient·es atteint·es de LGG de grade2 de l’OMS dont les tumeurs ne nécessitent pas un traitement immédiat par radiothérapie et chimiothérapie. Il s’agit de patient·es présentant une tumeur à croissance lente et de patient·es dont les tumeurs sont grandes et ne croissent pas ou qui ne peuvent pas être enlevées complètement et qui pourraient provoquer des déficits neurologiques en cas de progression.
Les patient·es présentant des déficits neurologiques importants causés par les LGG doivent généralement être pris en considération pour une radiothérapie et une chimiothérapie immédiates, car des réactions lentes ont été observées sous vorasidenib et il existe un risque de détérioration neurologique supplémentaire. On ne sait pas non plus si les patient·es qui ne présentent pas de tumeur résiduelle après l’intervention chirurgicale doivent être traité·es par vorasidenib.
Conclusion
Les résultats de l’étude INDIGO marquent une avancée significative dans le traitement des gliomes de bas grade à mutation IDH. Le vorasidenib permet de retarder de manière significative les thérapies agressives chez certain·es patient·es et pourrait constituer un nouveau standard thérapeutique. Cependant, les études futures devront déterminer comment cette thérapie peut être combinée avec les approches existantes afin d’obtenir les meilleurs résultats possibles.
Littérature:
auprès de l’auteur
Das könnte Sie auch interessieren:
Options thérapeutiques pour la SLA
L’accumulation d’espèces réactives de l’oxygène (ROS) et le stress oxydatif qui en résulte favorisent la pathogenèse de maladies neuronales telles que la sclérose latérale amyotrophique ...
Études visant à modifier la pratique en cas de cancer de l’urothélium et de la prostate
Le paysage thérapeutique des tumeurs urologiques est en constante évolution. Les progrès les plus marquants concernent les premières lignes de traitement. Voici un aperçu des études qui ...
Nouvelles approches thérapeutiques et données modifiant les directives
Cette année, le congrès de l’ISTH s’est tenu du 21 au 25 juin à Washington D.C. Au cours des 115 sessions, les expert·es les plus renommé·es du monde ont présenté les dernières données ...