Wie der Darm die Nasennebenhöhlen beeinflusst
Autor:innen:
Priv.-Doz. Dr. Guido Mühlmeier
Kathrin Seifert
Prof. Dr. Matthias Tisch
Anna Carolin Antropov
Klinik für Hals-, Nasen- und Ohrenheilkunde
Bundeswehrkrankenhaus Ulm
Korrespondierender Autor:
Priv.-Doz. Dr. Guido Mühlmeier
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die verschobene intestinale Flora beeinflusst das Immunsystem nachteilhaft in seiner Arbeit und begünstigt Entzündungskrankheiten der Atemwege. Am Beispiel der chronischen Rhinosinusitis werden Fehlsteuerungen durch eine Dysbiose der Darmmikrobiota aufgezeigt.
Keypoints
-
Bei chronischer Sinusitis sind Veränderungen in der lokalen, aber auch der intestinalen Mikroflora nachweisbar.
-
Bei Typ-2-Entzündungen entsprechen die Floraveränderungen im Darm typischen Mustern mit Fehlen von anaeroben Keimen wie Bifidobakterien und Laktobazillen.
-
Die verschobene intestinale Flora beeinflusst das Immunsystem nachteilhaft und begünstigt u.a. Atemwegsentzündungen.
-
Die Ernährung und die Anwendung von Antibiotika üben einen Einfluss auf die Zusammensetzung der Mikrobiota aus und damit auch auf das Immunsystem und viele Stoffwechselvorgänge.
Einleitung
Die menschliche Mikrobiota des Darms ist ein komplexes System, das in der westlichen Welt aus über 1000 Keimarten in der Beta-Diversität, d.h. der Gesamtheit der Population, und 120 bis 200 Keimarten in der Alpha-Diversität, d.h. beim einzelnen Individuum, besteht.1 Überwiegend anaerobe Bakterien, Pilze und Viren sind Teil der Verdauung, stehen aber auch in engem Kontakt mit dem Immunsystem der Darmwand. Sie beeinflussen den Erhalt der Darmbarriere, unterstützen die Verdauung und die Nährstoffaufnahme, synthetisieren bioaktive Moleküle, u.a. kurzkettige Fettsäuren (Acetat, Butyrat und Propionat) sowie sekundäre Gallensäuren, und modulieren das Immunsystem.2,3
Fehlregulationen der Darmflora werden mit zahlreichen Erkrankungen im Körper in Verbindung gebracht. Dazu zählen Erkrankungen der Haut und der Schleimhäute, insbesondere der Atemwege. Während die Darm-Lungen-Achse bereits vor über 10 Jahren beschrieben wurde,4 sind die Erkenntnisse zur Auswirkung einer gestörten Darmflora auf die oberen Atemwege vergleichsweise jung.
Epidemiologie
Je nach Literaturquelle sind durchschnittlich 5% der Bevölkerung in Mitteleuropa von einer chronischen Sinusitis (CRS) betroffen, 80% ohne und 20% mit einer nasalen Polyposis in der Phänotypisierung. Endotypisch liegt eine eosinophile Entzündung häufiger bei einer Polyposis vor, neutrophile Entzündungen häufiger bei der CRS ohne Polypen. Einen erhöhten Leidensdruck weisen knapp 10% dieser Patient:innen auf, während mit Polypen jede/jeder Zweite verstärkt leidet.5 Nasenatmungsbehinderung, retronasaler Schleimfluss und ein gestörtes Riechvermögen sind klassische Symptome, häufig begleitet von Infektschüben oder frontalen bzw. infraorbitalen Zephalgien.
Therapie
Die Therapie erfolgt gemäß AWMF-Leitlinie6 symptomorientiert, in erster Liniemit topischen Steroidsprays, befeuchtenden Maßnahmen und Nasenspülungen. Allergien werden symptomatisch oder mit spezifischen Immuntherapien behandelt, purulente Entzündungsschübe bedingen oft auch eine Antibiotikagabe.
Reichen diese Therapien nicht aus, werden häufig operative Sanierungen der Nasennebenhöhlen durchgeführt und bieten vielen Betroffenen eine zum Teil über Jahre anhaltende Rekonvaleszenzphase. Bei Rezidiven der nasalen Polypen stehen bei hohem Leidensdruck seit etwa 5 Jahren Biologikatherapien zur Verfügung, die eine Blockierung von Signalwegen durch Bindung verschiedener Chemokine bzw. deren Rezeptoren bewirken, z.B. IgE, Interleukine 4, 5 und 13.
Begleiterkrankungen
Betrachtet man die Gesamtheit aller chronischen Rhinosinusitiden, sind diese vielfach nicht nur mit Allergien, sondern auch mit Intoleranzreaktionen v.a. gegen Salicylate bzw. NSAR und autoimmunen bzw. rheumatischen Inflammationen sowie Immundefekten, z.B. durch Immunglobulin-A-Mangel, koinzident. Zum Teil überlappen diese immunologischen Fehlsteuerungen. Nach der Frage der Ursache führen Hinweise immer wieder zu den aktiven immunkompetenten Zellen unseres Körpers, die sich mit Masse in der Darmwand befinden.
Die gesunde Darmflora
Für die gesunde Mischung der Darmbakterien gibt es aktuell nur vage Parameter, weil die Zusammensetzung nicht nur von Umgebungsbedingungen wie dem pH-Wert oder den zugeführten Nährstoffen abhängt, sondern auch durch die Genetik des Wirtsorganismus beeinflusst wird.3 Übereinstimmend wird angenommen, dass eine große Diversität im Sinne eines physiologischen Gleichgewichts zur Abwehr äußerer und innerer Störfaktoren beiträgt.
Zwei wesentliche Gruppen an Keimen sind für dieses physiologische Gleichgewicht mitbestimmend verantwortlich: Firmicutes (bzw. Bacillota) und Bacteroides. Die menschliche Darmflora wird von anaeroben Bakterienstämmen dominiert. Die Vertreter der Firmicutes werden in Clostridia und Bacilli eingeteilt und sind obligate bzw. fakultative Anaerobier, während Bacteroides im Wesentlichen obligate Anaerobier darstellen. Immunologisch wichtige und häufige Keimarten im Darm sind Laktobazillen und im labilen Gleichgewicht Enterokokken im Dünndarm und Bifidobakterien sowie Bacteroides im Dickdarm, unterstützt durch eine moderate Menge an Escherichia coli (E. coli).
Laktobazillen produzieren Acetat und Laktat, Verdauungsenzyme und Vitamine, Laktobazillen und Enterokokken Bakteriozine zur Abwehr pathogener Keime, E. coli u.a. Vitamin K2. Faecalibacterium prausnitzii, Akkermansia muciniphila, Bifidobacterium longum, Ruminococcus gravus und Prevotellen tragen wesentlich zu einer intakten, mehrschichtigen Schleimschicht bei. Über Aminosäuren und Tryptophanmetaboliten ergibt sich mit der Stärkung der Schleimschicht eine Verbesserung der Barrierefunktion und der Zelladhäsion als äußere Abwehrlinie.7
Die intakte Bakterienflora bewirkt eine Förderung der Aufnahme von Mikronährstoffen und von fettlöslichen Vitaminen durch Gallensäuren. Kurzkettige Fettsäuren regulieren den pH-Wert im Darmlumen und sorgen somit für optimierte Lebensbedingungen der Eubakterien. Kurzkettige Fettsäuren, Milchsäure und Gallensäuren reduzieren die Wachstumsmöglichkeiten pathogener Stämme und verhindern dadurch deren schädliche Wirkung auf die Integrität der Darmbarriere.8
Für eine intakte Darmepithelschicht ist insbesondere die kurzkettige Fettsäure Butyrat von zentraler Bedeutung. Gut dokumentiert sind nicht nur die antiinflammatorischen Eigenschaften, sondern auch die Oxidation von Butyrat, die zudem mit schätzungsweise 70 bis 80% als Hauptenergiesubstrat für Epithelzellen dient.9
Eine ausreichende Butyratbildung ist damit Voraussetzung für eine intakte Barrierefunktion sowie eine suffiziente Mucinproduktion durch Becherzellen. Neben einer ausreichenden Zufuhr von Ballaststoffen sind hierfür neben Butyratbildnern wie F. prausnitzii auch weitere Bakterienstämme notwendig, wie beispielsweise Bifidobakterien. Mittlerweile ist gut dokumentiert, dass ihre Stoffwechselprodukte wie Acetat von F. prausnitzii abgebaut und für die Butyratproduktion herangezogen werden. Dies wird als sogenanntes Cross-Feeding bezeichnet.10
Darüber hinaus nutzen intestinale Epithelzellen die Aminosäure Glutamin als Energiesubstrat. Glutamin vermittelt verschiedene protektive Effekte im Gastrointestinaltrakt, die insbesondere die Zellproliferation sowie Reparatur und Erhalt der Darmbarriere betreffen und damit essenziell für die Darmintegrität sind.11 In dieser In-vitro-Studie konnte Glutamin beispielsweise die Histamin-induzierte Barrierestörung in Kolon-Epithelzellen reduzieren. Zudem werden antiinflammatorische Eigenschaften sowie eine Reduktion proinflammatorischer Zytokine durch Glutamin beschrieben. Interessanterweise wird Glutamin auch in großer Menge von sichschnell teilenden Immunzellen zur Energiegewinnung herangezogen, sodass die Aminosäure eine besondere Rolle sowohl für intakte Schleimhäute als auch für die Immunfunktion einnimmt. In der Praxis hat sich eine diätetische Zufuhr im Rahmen der Behandlung einer Dysbiose etabliert.
Die verschobene Darmflora
Geraten Keimmengen aus dem Gleichgewicht, liegt dies an veränderten lokalen Lebensbedingungen der residualen Flora, die durch Antibiosen, Toxine und hochverarbeitete Lebensmittel mit zu vielen Einfachzuckern und veränderten Fetten getriggert werden. Durch die Verschiebung der Darmflora können Entzündungsvorgänge induziert werden. E. coli, Klebsiellen, Morganellen, Staphylokokken und Streptokokken sind beispielsweise Histaminbildner, zu den Lipopolysaccharid(Endotoxin)-tragenden Bakterien zählen E. coli, Citrobacter, Klebsiellen, Sutturellen, Enterobacter und Pseudomonaden.
Dysbiosen im Darm gehen häufig von Parabacteroides, hohen Mengen an E. coli und Prevotellen aus. Durch die Reduktion an Interferon gamma und eine Th2-Aktivierung wird eine allergieähnliche Inflammation ausgelöst.12 Hohe Mengen an proinflammatorischen Substanzen bewirken eine Schädigung der Barriere und können im Körper weitere Störungen auslösen. Histamin als ein wichtiger proinflammatorischer Vertreter wird im Darmlumen über die Diaminooxidase (DAO) und in der Darmwand durch die N-Methyltransferase (HNMT) degradiert, löst jedoch bei hoher Vorlast im Darm durch histaminbildende Keime in Spitzenbelastungen systemische Fehlregulationen auf.
Abzugrenzen sind hier die Mastzellaktivierung und die Mastozytose, die auf anderem Weg die Histaminlast erhöhen.
Gemeinsam ist der verschobenen Darmflora ein Rückgang der Alpha-Diversität, was in zeitlichem Zusammenhang mit einem Anstieg von immunologisch überschießenden Reaktionen wie Allergien, Intoleranzen und autoimmunen Erkrankungen einhergeht. Zu den beobachteten autoimmunen Störungen zählen chronisch-entzündliche Darmerkrankungen, Diabetes Typ 1, die multiple Sklerose und die Granulomatose mit Polyangiitis (früher M. Wegener).13 Neuere Arbeiten zeigen einen Zusammenhang zwischen einer Dysbiose im Darm und einer Suszeptibilität maligner Erkrankungen des Verdauungstraktes.14,15 Vergleichbar finden sich Hinweise auf eine erhöhte Onkogenität im Kopf-Hals-Bereich.16
Chronische Rhinosinusitis und Dysbiose
In der Betrachtung der Dysbiose bei chronischer Rhinosinusitis ist die lokale Flora von der intestinalen strikt zu trennen. Nach Gómez-Garcia et al.17 sind in der Auswertung von über 70 Originalarbeiten Einschränkungen der Diversität der nasalen Flora bedingt durch die Anwendung von Antibiosen vorherrschend. Lokal entzündungshemmend wirken Erythromycin und Tetracycline sowie intranasale Steroidsprays, auch Nasenspülungen tragen über die Reinigung zur Antiinflammation und Antiinfektion bei. Festzuhalten ist, dass die nasale Keimflora durch die zugrunde liegende Entzündung negativ beeinflusst wird und damit die Infektion mit pathogenen Keimen begünstigt.
In der intestinalen Flora werden verminderte Mengen an Bifido- und Faecali-Bakterien, insbesondere F. prausnitzii, beobachtet, die als funktionelle Leitkeime für eine gesunde Fermentationsflora betrachtet werden müssen.18 Im Zusammenwirken mit Akkermansia muciniphila und Laktobazillen wird nicht nur die Butyratbildung induziert, sondern auch eine funktionierende Muzinschicht als Korrelat für eine intakte Darmbarriere gebildet. Ist die Menge dieser Keimarten reduziert, ergeben sich Störungen im Stoffwechsel, die sich zum Beispiel in einer Infektanfälligkeit der Atemwege äußern.
Auswertung von Stuhlproben
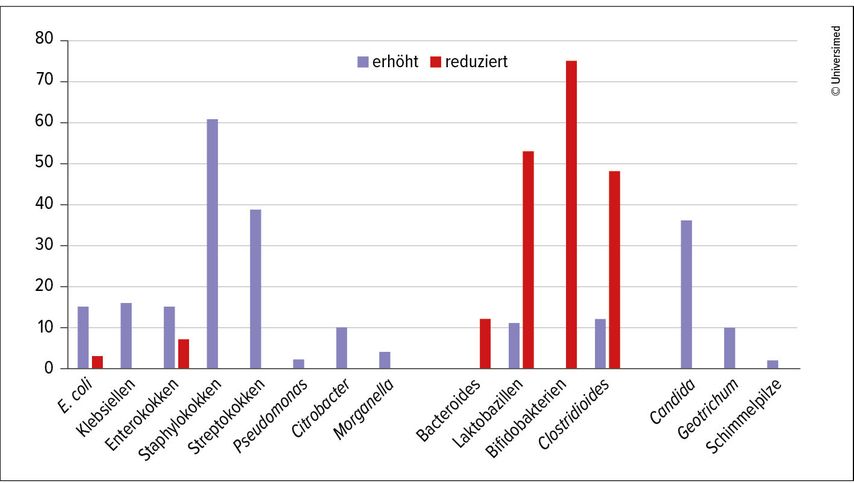
Inspiriert durch diese Daten haben die Autor:innen Stuhlproben im eigenen Patient:innenkollektiv ausgewertet und fanden ein charakteristisches Bild, das durch einen Mangel an anaeroben Leitkeimen wie Bifidobakterien, Laktobazillen, Bacteroides und Clostridoides dominiert wird (Abb.1).19 Die Lücken der anaeroben Flora geben Raum für die Überwucherung mit Pilzen und Fäulniskeimen. Candida-Spezies und seltener Schimmelpilze sind in etwa 50% der Proben nachweisbar, Staphylokokken und Streptokokken in erhöhter Menge in über 70% der Stuhlproben. Die pH-Werte bewegen sich im Normbereich oder sind leicht bis moderat basisch. Aktuell laufen weitere Datenauswertungen zur Korrelation mit dem Schweregrad und Einzelaspekten der chronischen Sinusitis.
Abb. 1: Veränderungen der Mikrobiota bei Patient:innen mit chronischer Sinusitis (n=218) im Bundeswehrkrankenhaus Ulm (modifiziert nach Mühlmeier G, Tisch M 2024)19
Pu et al.20 konnten durch Mendel’sche Randomisierung an fast 20000 Patient:innen den kausalen Nachweis der Erhöhung des Risikos für eine chronische Sinusitis durch Fehlen von Bacilli erbringen. Nach Liang et al.21 wird eine Verminderung von Faecalibakterien mit dem Lund-Mackay-Score, einem Wertungssystem für den Schweregrad der chronischen Sinusitis anhand der Veränderungen im CT-Bild, nachgewiesen. Zwischen dem Grad der Dysbiose und der Anzahl der Gewebseosinophilen konnte bei Fehlen der Bazillenart Turicibacter eine Korrelation mit dem Schweregrad der Sinusitis nachgewiesen werden. Während Tenericutes eine Erhöhung des Risikos für eine chronische Sinusitis darstellen, sind Bacilli und Delta-Proteobakterien protektiv agierende Darmkeime. Patient:innen mit eosinophiler Sinusitis weisen ein Metabolom auf, das für eine Typ-2-Entzündung charakteristisch ist. Nasal fehlen Moraxellen und Parvimonaden, in der intestinalen Mikrobiota Actinobakterien, u.a. Bifidobakterien.22 Nichteosinophile Sinusitiden waren häufiger mit Enterobakterien wie Proteus, Morganella und Enterobacter in der Darmflora assoziiert.
Entwicklung im Kindesalter
Bereits im jungen Kindesalter führen Fehlentwicklungen der intestinalen Flora zur Erhöhung des Risikos für eine atopische Erkrankung im Alter von 5 Jahren. Besonders betrifft dies die Erkrankungsbilder der atopischen Dermatitis, Asthma bronchiale, Nahrungsmittelallergie und der allergischen Rhinitis. Die CHILD-Arbeitsgruppe aus Kanada stellte dies in der longitudinalen Beobachtung von über 1100 Kindern fest und begründet dies mit metabolischen Imbalancen durch verminderte Mukusintegrität, erhöhte oxidative Aktivität, verminderte sekundäre Fermentation und erhöhte Mengen an Spurenaminen, die einen signifikanten Mediator zwischen der Ausreifung der Mikrobiota mit einem Jahr und der Allergiediagnose mit 5 Jahren darstellen.23
Pflege der funktionellen Diversität der Mikrobiota
Eine funktionell intakte Darmflora unterstützt unser Immunsystem in vielfältiger Weise. Die Produktion kurzkettiger Fettsäuren und von Vitaminen, der Beitrag zur Erneuerung der Schleimschicht und die Umwandlung von Saccharose in Laktat sind wesentliche Funktionen, die unser gesundes Leben stützen. Der Verbund der Eubakterien des menschlichen Darms bedarf der externen Zufuhr von pflanzlichen Ballaststoffen, von denen die Deutsche Gesellschaft für Ernährung (DGE) mindestens 30 Gramm täglich empfiehlt.24 Die Mehrheit der Menschen in Mitteleuropa nimmt jedoch unter 20 Gramm täglich auf. Neben faserreichem Gemüse dienen auch Flohsamenschalen, Inulinpulver und resistente Stärke als Quellen von Ballaststoffen. Der Umbau von Stärke zur resistenten Stärke lässt sich durch das Erkalten von Sättigungsbeilagen wie Kartoffeln, Nudeln und Reis erreichen, unabhängig davon, ob sie später nochmals zum Verzehr erhitzt werden.
Zur Steuerung des Arachidonsäurestoffwechsels ist eine Menge von 10 Gramm an mehrfach ungesättigten Fettsäuren (PUFA) erforderlich. Deren wichtigste Vertreter sind Omega-3-Fettsäuren, vor allem Docosapentaensäure (DHA) und Eicosatetraensäure (EPA), die in Pflanzenölen wie Leinöl (ca. 70%) oder Rapsöl (ca. 35%) neben anderen möglichen Quellen enthalten sind. Die ausreichende Zufuhr an Spurenelementen, Zink, Selen und Eisen, der Vitamine A, D und E und Phytochemikalien aus pflanzlicher Nahrung ist wichtig für einen ausgewogenen Stoffwechsel.
Zhang et al.3 zeigen den Zusammenhang einer Homöostase des Immunsystems und einer intakten, diversen Mikrobiota auf. Die meisten Menschen in Mitteleuropa führen in heutigen Zeiten nicht nur zu viele Kalorien zu, sondern auch eine erhöhte Menge an tierischen Proteinen, Einfachzuckern, ungünstigen Fettsäuren (Gesamtmenge, Omega-6, mittelkettige Fettsäuren und Transfette) und prozessierten Nahrungsmitteln. Frische Nahrungsmittel wie Gemüse und Obst, die Ballaststoffe, Spurenelemente und wichtige Vitamine enthalten, werden generell zu selten verzehrt.Durch eine überwiegend pflanzliche Ernährung und die Vermeidung von Noxen haben es die Menschen selbst in der Hand, einen Beitrag für das Immunsystem zu leisten, um chronische Entzündungen z.B. an den Atemwegen zu reduzieren und Medikamenten zu einem verbesserten Ansprechen zu verhelfen.
Literatur:
1 Liu YX et al.: Protein Cell 2021; 12(5): 315-30 2 Hou K et al.: Signal Transduct Target Ther 2022; 7(1): 135 3 Zhang P: Nutrients 2023; 15(17): 3683 4 Marsland BJ et al.: Ann Am Thorac Soc 2015; 12(Suppl 2): S150-56 5 Mullol J et al.: Rhinology 2024; 62(4): 421-31 6 Thomas AM et al.: Nat Rev Clin Oncol 2023; 20(9): 583-603 7 Sommer F, Bäckhed F: Nat Rev Microbiol 2013; 11(4): 227-38 8 Stuck BA, Popert U: https://register.awmf.org/de/leitlinien/detail/017-049 ; https://register.awmf.org/de/leitlinien/detail/053-012 ; zuletzt aufgerufen am 11. 9. 2025 9 Gasaly N et al.: Int J Mol Sci 2021; 22: 3061 10 Rios-Covian D et al.: FEMS Microbiol Lett 2015; 362: fnv176 11 Zhang X et al.: BMC Genomics 2025; 26: 195 12 Kaczynska A et al.: Nutrients 2022; 14(20): 4328 13 Haahtela T et al.: World Allergy Organ J 2013; 6(1): 3 14 Lam GA et al: Inflamm Bowel Dis 2023; 29(7): 1153-64 15 Yang W, Cong Y: Cell Mol Immunol 2021; 18(4): 866-77 16 Kavitha L et al.: J Appl Oral Sci 2025; 33: e20240392 17 Gómez-García M et al.: Int J Mol Sci 2024; 25 (15): 8223 18 Michalik M et al.: Immun Inflamm Dis 2023; 11(9): e996 19 Mühlmeier G, Tisch M: World Allergy Congress 2024; Poster #131 20 Pu K et al.: Immun Inflamm Dis 2024; 12(7): e1328 21 Liang Y et al.: Eur Arch Otorhinolaryngol 2024; 281(12): 6459-68 22 Abbas EE et al.: Laryngoscope 2021; 131(1): E34-E44 23 Hoskinson C et al.: Nat Commun 2023; 14(1): 4785 24 Deutsche Gesellschaft für Ernährung, Österreichische Gesellschaft für Ernährung, Schweizerische Gesellschaft für Ernährungsforschung, Schweizerische Vereinigung für Ernährung (Hrsg.): Referenzwerte für die Nährstoffzufuhr. Neustadt a.d. Weinstraße: Neuer Umschau Buchverlag, 2008; 1. Auflage, 3. vollständig durchgesehener und korrigierter Nachdruck
Das könnte Sie auch interessieren:
Morbus Menière – der Pathomechanismus des Hydrops
Schon im 19. Jahrhundert sah man einen Zusammenhang zwischen Schwindel, Hörverlust und Tinnitus, verursacht von pathologischen Vorgängen im Innenohr. Knapp 80 Jahre später wurde der ...
Wie Coaching den Fachärztemangel an medizinischen Abteilungen angehen kann
Hohe Arbeitsbelastung, Stress, schlechte Stimmung: An vielen Spitalskliniken ist das die tägliche Realität. Es ist daher nicht verwunderlich, dass viele Fachärzt:innen den Weg in die ...
Breaking News: die Gentherapie bei Otoferlin-Taubheit
Gentherapie stellt eine neue und innovative Therapieoption bei genetisch bedingter Schwerhörigkeit dar, die eine direkte kausale Behandlung der zugrunde liegenden Pathologie ermöglicht.