PNH: neue Komplement-Inhibitoren
Autor:
Prof. Dr. Jörg Schubert
Hämatologische Ambulanz
Universitätsklinikum Carl Gustav Carus
Dresden
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Der Fortschritt in der Behandlung der paroxysmalen nächtlichen Hämoglobinurie (PNH) durch den Einsatz von Eculizumab seit 2006 hat die Therapielandschaft grundlegend verändert, stößt jedoch bei Persistenz der hämolytischen Aktivität an seine Grenzen. Neue Therapieansätze, darunter modifizierte Antikörper und kleine Moleküle, erweitern die Behandlungsoptionen, verbessern die Lebensqualität der Patient:innen und adressieren bestehende Herausforderungen mit innovativen Strategien.
Keypoints
-
Terminale Komplement-Inhibitoren zur Behandlung der hämolytischen PNH haben zu einem deutlich verlängerten Überleben der Patient:innen geführt. Die proximalen Inhibitoren können die Anämie und Lebensqualität der Patient:innen mit klinisch signifikanter extravasaler Hämolyse verbessern.
-
Vor allem in Hinblick auf die anstehende Zulassung der neuen Substanzen zur Erstlinienbehandlung sind weitere Daten, vor allem Real-World-Daten, erforderlich, um den Langzeiteffekt dieser Substanzen für die Patient:innen mit hämolytischer PNH einschätzen zu können und ggf. auch einen Patient:innen-orientierten Therapiealgorithmus zu etablieren.
Seit 2006 konnten durch die Einführung einer ersten gezielten Therapie mit dem anti-C5-terminalen Komplement-Inhibitor (C5I) Eculizumab die intravasale Hämolyse und damit ein Großteil der klinischen Symptome einschließlich der gefürchteten Thrombophilie kontrolliert werden, was zu einer deutlichen Verlängerung des Überlebens der Patient:innen mit hämolytischer paroxysmaler nächtlicher Hämoglobinurie (PNH) geführt hatte.1
Im Gegensatz zur Hämolyse hat die Komplement-Inhibition auf das mit der PNH assoziierte Knochenmarkversagen keinen Einfluss. Daher ist der therapeutische Einsatz bei Patient:innen mit Markinsuffizienz und kleinem Klon (<60%) zumeist nicht sinnvoll.2
Terminale Inhibitoren
Monoklonale Antikörper
Ravulizumab
Eine Modifikation der pH-abhängigen Bindung an den neonatalen Fc-Rezeptor sowie an das Zielantigen und die daraus resultierende Recycling-Funktion des Epitop-freien Antikörpers führten bei dem monoklonalen Antikörper Ravulizumab zu einer äquivalenten Hämolysekontrolle, dabei aber zu einer deutlich verlängerten Halbwertszeit bei äquivalenter Hämolysekontrolle. Damit konnten eine deutliche Intervallverlängerung von zwei auf acht Wochen sowie eine Verringerung der pharmakokinetisch bedingten Durchbruchhämolysen (BTH) erreicht werden.3
Crovalimab
Eine Weiterentwicklung von Ravulizumab ist Crovalimab, ein Anti-C5-Antikörper, der durch Anheben des isoelektrischen Punkts zu einer vermehrten Aufnahme des Immunkomplexes durch Pinozytose führt. Damit wird die Clearance-Leistung des einzelnen Antikörpermoleküls bei identischem Recycling-Mechanismus weiter gesteigert, sodass ein deutlich niedrigerer Spiegel im Serum der Patient:innen zu einer suffizienten Effektivität führt. Crovalimab kann daher in der Erhaltungsphase mit geringen Volumina subkutan appliziert werden. Diese Applikation können betroffene Patient:innen selbst durchführen. Damit entfällt die regelmäßige Vorstellung in der Praxis oder Klinik zur intravenösen Applikation des Medikamentes ohne Wirkungsverlust.4
Inaktivierende RNA-Moleküle
Eine Alternative zu monoklonalen Antikörpern auf der terminalen Seite der Komplementkaskade ist der Einsatz von kurzen inaktivierenden RNA-Molekülen (siRNA). Die Kopplung von Cemdisiran an N-Acetylgalactosamin führt zur leberspezifischen Aufnahme über den auf Hepatozyten exprimierten Asialoglycoprotein-Rezeptor. In den Hepatozyten wird die Produktion von C5 vollständig supprimiert. Da C5 auch zu geringem Anteil in Endothelzellen produziert wird, muss die supprimierende Therapie durch durch Pozelimab in niedrigen Antikörperspiegeln ergänzt werden.
Erste Phase-II-Studien zu der Kombination wurden bereits bei PNH-Patient:innen durchgeführt.5 Darin zeigt sich, dass die kontinuierliche Suppression der C5-Aktivität und die damit verbundene Vermeidung von BTH sowohl pharmakokinetisch als auch pharmakodynamisch erreicht werden könnte.
Proximale Inhibitoren
Wahrscheinlich bedingt durch genetische Varianten bei den Komponenten der alternativen Kaskade wie Komplement-Rezeptor 1 auf den Erythrozyten sowie der Komplement-Komponente C3 kommt es bei rund einem Drittel der Patient:innen trotz suffizienter Kontrolle der terminalen Kaskade zu einer weiter bestehenden signifikanten Hämolyse.6 Diese ist bedingt durch die fehlende Regulierung auf der proximalen Seite der Komplementkaskade über das CD55-Molekül.
Daraus resultiert eine Akkumulation von C3-Fragmenten auf den GPI-defizienten Erythrozyten. Durch Komplement-Rezeptor-tragende Phagozyten in Leber und Milz bedeutet diese Akkumulation von C3-Fragmenten einen Opsonisierungsprozess, der zur Phagozytose der betroffenen Erythrozyten und damit zu einer neuen Entstehung einer extravasalen Hämolyse (EVH) bei PNH führt. Klinisch zeigen sich eine fortbestehende Anämie sowie eine erhöhte Retikulozytenzahl (ARC).7 Damit verbunden ist eine ausgeprägte Fatigue der Patient:innen, die nicht allein durch den Grad der Anämie erklärbar ist.
Um diese Symptome zu behandeln, sind Inhibitoren auf der proximalen Seite der alternativen Komplementkaskade entwickelt worden.
Pegcetacoplan
Die erste zugelassene Substanz ist Pegcetacoplan, ein pegylierter Abkömmling des Compstatins, der als direkter Inhibitor von C3 eingesetzt wird. In der PEGASUS-Zulassungsstudie wurde bei mit Eculizumab vorbehandelten Patient:innen mit signifikanter Anämie und erhöhten ARC nach einer gemeinsamen Run-in-Phase von vier Wochen randomisiert Pegcetacoplan für 16 Wochen mit Eculizumab verglichen.8
Dabei erreichten die mit Pegcetacoplan behandelten Patient:innen im Gegensatz zu jenen, die Eculizumab erhielten, einen nahezu normalisierten Hämoglobinwert sowie eine deutlich gesteigerte Lebensqualität.
Danicopan & Iptacopan
Weitere Substanzen sind als Inhibitoren des Amplifikationswegs der C3-Aktivierung identifiziert worden. Dazu zählen Danicopan, das als Faktor-B-Inhibitor oral eingesetzt werden kann, sowie Iptacopan als Faktor-D-Inhibitor.
Faktor B unterliegt einem ausgeprägten molekularen Turn-over. Danicopan muss dreimal am Tag eingenommen werden. Es wurde als Add-on zur bestehenden terminalen Komplement-Inhibition eingesetzt. Daraus ergab sich in der randomisierten Phase-III-Alpha-Studie bei mit Eculizumab oder Ravulizumab vorbehandelten Patient:innen mit extravasaler Hämolyse und resultierender Anämie durch die Hinzunahme von Danicopan eine signifikante Steigerung des Hb-Wertes um durchschnittlich mehr als 2,5g/dl sowie eine Verminderung des ARC und eine Steigerung der Lebensqualität im Beobachtungszeitraum von zwölf Wochen.9
Iptacopan, ein Inhibitor des Faktors D aus dem Amplifikationsweg der proximalen Komplementkaskade, ist ein kleines Molekül, das oral eingenommen werden kann. Dabei lässt sich die Aktivierung der Komplementkaskade suffizient auf der proximalen wie auch der terminalen Seite unterbinden.
APPLY als zulassungsrelevante Phase-III-Studie bei PNH-Patient:innen unter stabiler Therapie, jedoch mit signifikanter Anämie und Retikulozytose im Sinne der extravasalen Hämolyse erbrachte eine deutliche Steigerung des Hb-Werts auf im Mittel normale Werte, eine Normalisierung des ARC sowie eine signifikante Verbesserung der erreichten Lebensqualität.10
Iptacopan ist die einzige orale Substanz, die allein, also ohne terminalen Inhibitor, eine suffiziente Inhibition der Hämolyse bei PNH-Patient:innen erreichen kann. Bei Patient:innen mit einer ausreichenden Adhärenz zur Therapie bedeutet Iptacopan eine besondere Erleichterung hinsichtlich Lebensqualität und persönlicher Freiheiten.
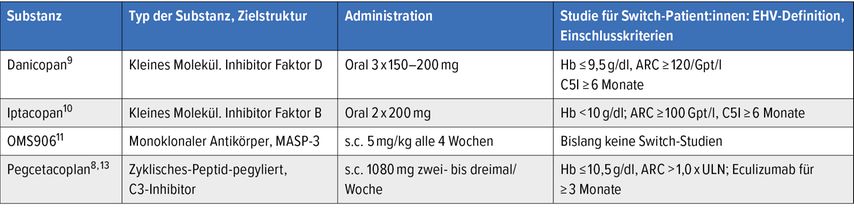
Wie der Tabelle 1 zu entnehmen ist, sind für die Definition einer klinisch signifikanten Hämolyse unter C5I für jede Substanz bei der jeweils durchgeführten klinischen Studie andere Einschlusskriterien gewählt worden. Somit ist eine einheitliche und evidenzbasierte Definition der EVH aktuell nicht vorhanden.
Tab. 1: Proximale Komplement-Inhibitoren (alphabetische Reihenfolge) und die zugehörige Studienlage für Patient:innen zum Wechsel von C5I sowie die zugehörige Definition einer klinisch signifikanten extravasalen Hämolyse (EVH)
OMS906
Eine weitere Substanz auf der Seite der proximalen Inhibitoren ist OMS906, ein monoklonaler Antikörper, der die Aktivität von MASP 3 (Mannan-bindende Lektin-Serinprotease) inhibiert und somit die Aktivierung von Pro-Faktor D in Faktor D unterbindet.
Da MASP3 der einzige Aktivator von Pro-Faktor D ist, ist die Unterbindung des Amplifikationsweges von C3 damit erreicht. Erste klinische Studien zeigen eine beeindruckende Komplement-Inhibition und damit verbundene Hämolysekontrolle durch OMS906 zunächst bei therapienaiven Patient:innen.11 Auf die Ergebnisse der weiteren Entwicklung sind wir gespannt.
Fazit: über ein Register zur Empfehlung
Die terminalen Komplement-Inhibitoren haben bei PNH-Patient:innen entscheidend zu einem verlängerten Überleben geführt. Die proximalen Inhibitoren sind nun in der Lage, insbesondere bei klinisch signifikanter extravasaler Hämolyse unter terminaler Inhibition eine deutliche Verbesserung der Lebensqualität für die Patient:innen zu erreichen.
Allerdings ist die proximale Inhibition ein verstärkter Eingriff in das Gleichgewicht und die Reaktionsfähigkeit des Immunsystems, für den noch keine langjährige Erfahrung vorliegt. So können Durchbruchhämolysen unter proximaler Inhibition deutlich intensiver ausfallen, weil einerseits der Anteil der PNH-Erythrozyten signifikant angestiegen ist, andererseits bei unvollständiger Inhibition der C3-Konvertase die Zahl der aktiven C5-Konvertasen und damit der Membran-Angriffskomplexe deutlich gesteigert ist.12
Für Pegcetacoplan gibt es bereits ein Konzept der Dosisintensivierung, das beim größten Teil der Duchbruchhämolysen eine Kontrolle der Situation bewirkt.13 Daneben muss auch beachtet werden, dass die proximale Inhibition zu einer höheren Infektionsneigung führt. Sind es bei der terminalen Komplement-Inhibition vor allem Meningokokken, die bei den betroffenen Patient:innen schwere Infektionen hervorrufen können, müssen bei proximalen Inhibitoren alle weiteren kapselbildenden Bakterien wie Pneumokokken und Haemophilus-Spezies mit einbezogen werden. Entsprechende Impfprogramme sind dafür bereits verpflichtend angesetzt.
Nun steht für alle neuen proximalen Komplement-Inhibitoren jeweils eine Zulassung bei der EMA bereits in Erstlinie bevor. Der Studienhintergrund dazu ist für jede Substanz unterschiedlich. So gibt es für Pegcetacoplan eine Phase-III-Studie, allerdings ist im Vergleichsarm keine Komplement-Inhibition im Sinne des aktuellen Standards als C5I, sondern ausschließlich symptomatische Behandlung enthalten.14
Bei Iptacopan und Danicopan gibt es für die Erstlinientherapie nur eine Phase-II-Studie, also eine Studie komplett ohne Vergleichsarm. Daher ist im Hinblick auf eine solche Zulassung für die proximalen Inhibitoren in Erstlinientherapie eine fortbestehende Unklarheit für die Behandelnden vorhanden. Aktuell gibt es leider keinen etablierten Algorithmus und auch keine allgemein verfügbaren Biomarker, um hier eine evidenzbasierte Therapieentscheidung empfehlen zu können.15
Daher ist es aktuell von besonderer Bedeutung, möglichst alle Patient:innen mit hämolytischer PNH im Rahmen eines Registers zu verfolgen. Dafür wurde unter der Führung der Internationalen PNH-Interessengemeinschaft (IPIG) das PNH-Register etabliert. Mithilfe solcher Real-World-Daten könnte eine Grundlage für Empfehlungen zur Therapieentscheidung erarbeitet werden.
Literatur:
1 KellyRJ et al.: Treatment outcomes of complement protein C5 inhibition in 509 UK patients with paroxysmal nocturnal hemoglobinuria. Blood 2023 2 Babushok DV: When does a PNH clone have clinical significance? Hematology Am Soc Hematol Educ Program 2021; 2021(1): 143-52 3 Lee JW et al.: Ravulizumab (ALXN1210) vs eculizumab in adult patients with PNH naive to complement inhibitors: the 301 study. Blood 2019; 133(6): 530-9 4 Röth A et al.: The complement C5 inhibitor crovalimab in paroxysmal nocturnal hemoglobinuria. Blood 2020; 135(12): 912-20 5 Kelly R et al.: A phase 2 open-label study evaluating the safety and efficacy of combination Pozelimab and Cemdisiran therapy in patients with Paroxysmal Nocturnal Hemoglobinuria who switch from Eculizumab. Hemasphere 2023; 7(Suppl.): e6873083 6 Pouw RB et al.: Tipping the balance: intricate roles of the complement system in disease and therapy. Semin Immunopathol 2021; 43(6): 757-71 7 Debureaux BE et al.: Categorizing hematological response to Eculizumab in paroxysmal nocturnal hemoglobinuria: a multicenter real-life study. Bone Marrow Transplant 2021; 56(10): 2600-2 8 Hillmen P et al.: Pegcetacoplan versus eculizumab in paroxysmal nocturnal hemoglobinuria. N Engl J Med 2021; 384(11): 1028-37 9 Lee JW et al.: Addition of danicopan to ravulizumab or eculizumab in patients with paroxysmal nocturnal haemoglobinuria and clinically significant exteravascular haemolysis (ALPHA): a double-blind, randomized phase 3 trial. Lancet Haematol 2023; 10(12): e955-65 10 Peffault de Latour R et al.: Oral iptacopan monotherapy in paroxysmal nocturnal hemoglobinuria. N Engl J Med 2024; 390: 994-1008 11 Panse-JP et al.: OMS906, a novel alternative pathway MASP-3 inhibitor normalizes hemoglobin levels and increases clone ssize in treatment naïve PNH patients. Blood 2023; 142 (Suppl. 1): 573 12 Notaro R, Luzzatto L: Breakthrough hemolysis in PNH with proximal or terminal complement inhibition. N Engl J Med 2022; 387(2): 160-6 13 Griffin M et al.: Management of acute breakthrough hemolysis with intensive pegcetacoplan dosing in patients with PNH. Blood Adv 2024 14 Wong RSM et al.: Pegcetacoplan controls hemolysis in complement inhibitor-naive patients with paroxysmal nocturnal hemoglobinuria. Blood Adv 2023; 7(11): 2468-78 15 Risitano AM et al.: Anti-complement treatment for paroxysmal nocturnal hemoglobinuria: time for proximal complement inhibition? A position paper from the SAAWP of the EBMT. Front Immunol 2019; 10: 1157