Beeinflusst hepatische Inflammation den Pfortaderdruck auch nach ätiologischer Therapie?
Autoren:
Dr. Benedikt Silvester Hofer
Assoc. Prof. Priv.-Doz. Dr. Thomas Reiberger
Klinische Abteilung für Gastroenterologie und Hepatologie
Universitätsklinik für Innere Medizin III Medizinische Universität Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Ausmaß der portalen Hypertension stellt bei Patient:innen mit Leberzirrhose auch nach erfolgreicher ätiologischer Therapie einen der Hauptrisikofaktoren für hepatische Komplikationen dar. Jene Mechanismen, die den Pfortaderdruck während der Rückbildung der Lebererkrankung beeinflussen können, sind jedoch noch unzureichend untersucht. In dieser Studie liefern wir Belege dafür, dass das proinflammatorische Milieu trotz signifikanter Besserungen nach ätiologischer Therapie auch weiterhin den intrahepatischen Gefäßwiderstand und damit den Pfortaderdruck erhöhen kann.
Keypoints
-
Eine erfolgreiche Therapie der zugrundeliegenden Ätiologie der Leberzirrhose ermöglicht eine deutliche Reduktion des Schweregrads der Lebererkrankung und des proinflammatorischen hepatischen Milieus.
-
Dennoch kann persistierende Inflammation auch nach ätiologischer Therapie den intrahepatischen Gefäßwiderstand und damit die portale Hypertension weiterhin erhöhen.
-
Somit stellen proinflammatorische Veränderungen auch im Setting der Erkrankungsregression ein vielversprechendes therapeutisches Ziel dar.
Bedeutung und Entstehung der portalen Hypertension
Portale Hypertension bezeichnet eine Druckerhöhung in der Pfortader, also jenem Gefäß, welches Blut aus den splanchnischen Organen zur Leber leitet.1 Prognostisch betrachtet stellt die Entstehung der portalen Hypertension einen Wendepunkt im Krankheitsverlauf von Patient:innen mit Leberzirrhose dar und repräsentiert den wichtigsten pathophysiologischen Faktor für das Auftreten von hepatischen Dekompensationsereignissen, wie Aszites, hepatischer Enzephalopathie oder einer Ösophagusvarizenblutung.1, 2 Selbst nach erfolgreicher Therapie der zugrundeliegenden Ätiologie der Zirrhose, welche zu einer erheblichen Verbesserung der Leberfunktion und des Pfortaderdrucks führt, bleibt das Ausmaß der portalen Hypertension prognostisch von hoher Relevanz.3, 4
Mechanistisch sind an der Entwicklung der portalen Hypertension sowohl strukturelle als auch funktionelle Veränderungen innerhalb des Leberparenchyms verantwortlich, welche den intrahepatischen Gefäßwiderstand erhöhen und somit den Blutfluss durch die Leber behindern.1 Strukturelle Veränderungen, also die statische Komponente der portalen Hypertension, sind die Folge fibrotischer Veränderungen des Lebergewebes und der Leberarchitektur und für etwa 70% des intrahepatischen Widerstandes verantwortlich.1, 5 Traditionell war zur Bewertung des Ausmaßes der Fibrosierung eine Leberbiopsie erforderlich. Heutzutage kann der Fibrosegrad jedoch mittels einer nichtinvasiven Lebersteifigkeitsmessung erfolgen, welche signifikant mit der histologischen Fibrose korreliert.6
Die dynamische Komponente der portalen Hypertension
Die verbleibenden 30% des Anstiegs des intrahepatischen Gefäßwiderstands bei Patient:innen mit Leberzirrhose werden durch dynamische Änderungen auf Ebene der Lebersinusoide verursacht – konkret durch eine vermehrte Freisetzung von Vasokonstriktoren, eine Kontraktion der hepatischen Stellatzellen und endotheliale Dysfunktion.1, 7
Ein Faktor, für den in vorhergegangenen Studien im Setting der Erkrankungsprogression ein Einfluss auf die dynamische Komponente der portalen Hypertension gezeigt werden konnte, ist hepatische Inflammation.7–9 Allgemein ist das proinflammatorische Milieu bei Leberzirrhose eine Konsequenz der erhöhten Translokation bakterieller Produkte aus dem Darm in die Leber.10 Einerseits beeinflusst dieser proinflammatorische Zustand dabei das Ausmaß der portalen Hypertension aufgrund der profibrotischen Wirkung und damit einer Verstärkung der statischen Komponente. Andererseits führt Inflammation auch zu einer endothelialen Dysfunktion und einem Ungleichgewicht zwischen Vasokonstriktoren und Vasodilatatoren und kann somit den intrahepatischen Gefäßwiderstand beeinflussen.5, 9 Der Einfluss von Inflammation auf den Pfortaderdruck im Setting der Erkrankungsregression, bei der hepatische und systemische Entzündungswerte auf ein normales Niveau zurückkehren können, ist jedoch noch unzureichend untersucht.
Daher war es das Ziel unserer Studie, zu klären, inwieweit eine erfolgreiche ätiologische Therapie die systemische und hepatische Inflammation verbessern kann, und darüber hinaus, ob eine fortbestehende,geringgradige Inflammation die dynamische Komponente der portalen Hypertension immer noch beeinflussen kann. Um diese Fragen zu beantworten, wurden einerseits Mausmodelle der Zirrhoseregression sowie andererseits Patient:innen mit alkoholbedingter Leberzirrhose und Alkoholabstinenz untersucht.
Zirrhoseregression im Tiermodell
Um den Rückgang der hepatischen Inflammation während der Erkrankungsregression und eventuell weiterbestehende Auswirkungen auf die dynamische Komponente der portalen Hypertension in einem experimentellen Setting zu untersuchen, wurden insgesamt 44 Mäuse in drei Gruppen 12 Wochen lang einer hepatotoxischen Substanz ausgesetzt, um eine Leberzirrhose zu induzieren. Nach Abschluss der 12-wöchigen Induktionsphase wurde die Applikation der toxischen Substanz in zwei Tiergruppen gestoppt, um eine Rückbildung der Erkrankung über einen Zeitraum von einer (n=15) und zwei (n=15) Wochen zu ermöglichen. Die dritte Gruppe wurde direkt am Ende der 12-wöchigen Induktionsphase, also zum Zeitpunkt der ausgeprägtesten Erkrankungsschwere, untersucht. Am Ende der jeweiligen Timeline wurde der Pfortaderdruck mittels einer direkten Kanülierung der Pfortader gemessen. Fibrotische Veränderungen wurden histologisch anhand der Kollagenmenge evaluiert. Veränderungen in der intrahepatischen Genexpression von proinflammatorischen Markern wurden mittels PCR-Analyse evaluiert.
Einfluss hepatischer Inflammation auf den Pfortaderdruck im Tiermodell
Verglichen mit gesunden Kontrolltieren kam es am Ende der 12-wöchigen Zirrhoseinduktion zu einem signifikanten Anstieg des Pfortaderdrucks, der Leberfibrose und der Transaminasen bei den kranken Tieren. Die intrahepatische Expression von proinflammatorischen Markern stieg bei den kranken Tieren ebenfalls deutlich an.
Nach dem Absetzen des toxischen Stimulus zeigten sich im Verlauf der Erkrankungsregression im Zeitraum von einer oder zwei Wochen eine Normalisierung der Transaminasen sowie eine deutliche Reduktion des Pfortaderdrucks und der Leberfibrose.
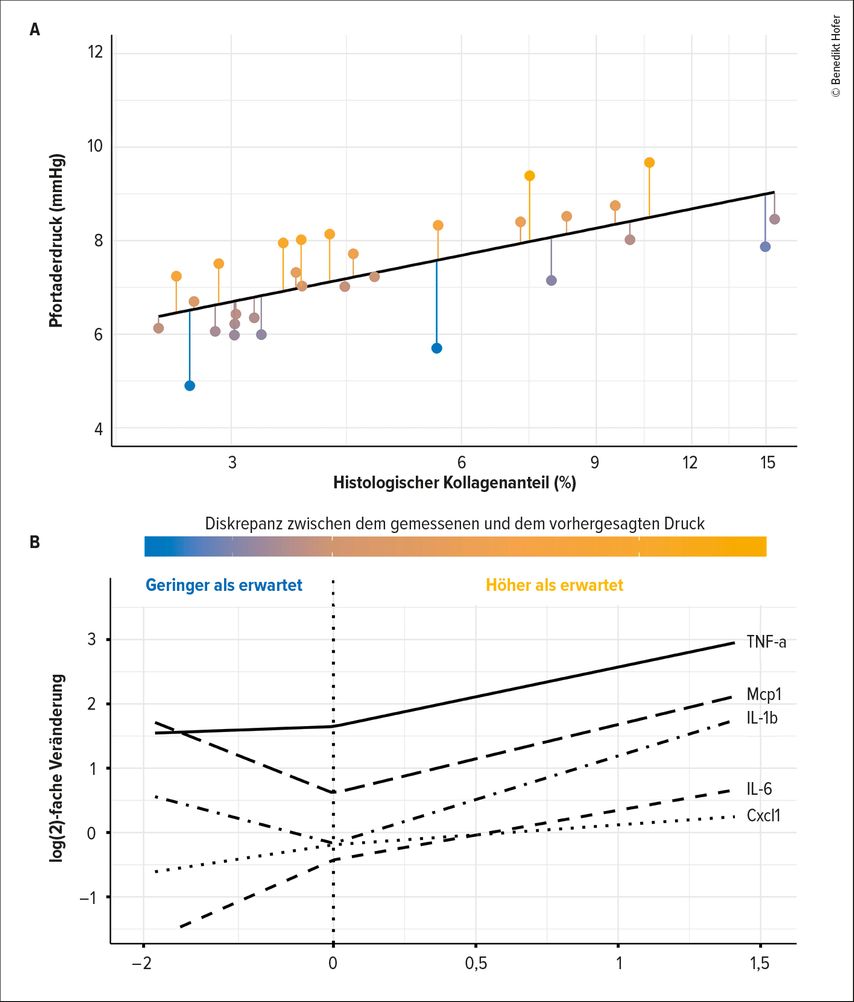
Um nun zu evaluieren, ob hepatische Inflammation trotz dieser signifikanten Verbesserungen den intrahepatischen Gefäßwiderstand und damit die dynamische Komponente der portalen Hypertension im Setting der Erkrankungsregression beeinflusst, wurde zuerst der Zusammenhang zwischen der histologischen Fibrose, also der statischen Komponente, und dem tatsächlichen Pfortaderdruck mittels linearer Modelle analysiert. Wie in Abb. 1A gezeigt, gab es einen signifikanten Zusammenhang zwischen histologischer Fibrose und dem Pfortaderdruck. Dennoch war der Pfortaderdruck bei einigen Tieren signifikant höher, als dies allein aufgrund der statischen Veränderungen zu erwarten wäre. Ebendiese Diskrepanzen zwischen dem vorhergesagten und dem direkt gemessenen Pfortaderdruck, also die Residuen des linearen Modells, sind die Folge dynamischer intrahepatischer Veränderungen.
In unserer Studie zeigte sich beiden Tieren mit einem Pfortaderdruck, der höher als erwartet war, auch eine signifikant erhöhte intrahepatische Expression von proinflammatorischen Genen (Abb. 1B). Insbesondere TNF-α, IL-6 und IL-1b wiesen eine signifikante positive Korrelation zu den Residuen des Modells auf. Ein ähnlich positiver Zusammenhang wurde für die Chemokine Cxcl1 („chemokine C-X-C motif ligand 1“) und Mcp1 („monocyte chemoattractant protein-1“) beobachtet.
Abb. 1: Einfluss der hepatischen Inflammation auf die dynamische Komponente der portalen Hypertension während der Krankheitsregression im Mausmodell. (A) Lineares Regressionsmodell basierend auf dem Zusammenhang zwischen dem hepatischen Kollagengehalt (logarithmisch) und dem Pfortaderdruck inklusive der Residuen des Modells, also der Diskrepanz zwischen dem gemessenen und dem vorhergesagtem Pfortaderdruck. (B) Korrelation zwischen den Residuen des Modells (x-Achse) und der intrahepatischen proinflammatorischen Genexpression (y-Achse)
Alkoholbedingte Leberzirrhose und Alkoholabstinenz
Um eine translationale Verbindung herzustellen, wurden zusätzlich zu den Mausmodellen auch Patient:innen mit alkoholbedingter Zirrhose inkludiert, die am selben Tag eine Messung des „hepatic venous pressure gradient“ (HVPG) und der Lebersteifigkeit im Labor für hepatische Hämodynamik der Medizinischen Universität Wien hatten. Die direkte Messung des HVPG stellt dabei die Goldstandardmethode dar, um das Ausmaß der portalen Hypertension zu evaluieren. Insgesamt wurden 128 Patient:innen mit anhaltender Abstinenz als primäre Studienkohorte inkludiert.
Einfluss systemischer Inflammation auf den Pfortaderdruck
Zusätzlich zu einer signifikanten Reduktion der Transaminasen, des HVPG und der Lebersteifigkeit zeigte sich mit anhaltender Abstinenz auch eine Verbesserung der systemischen Inflammation. Genauer gesagt kam es zu einer signifikanten Reduktion der Leukozytenzahl sowie der Serumspiegel von CRP, IL-6, Procalcitonin und der Immunglobuline IgA, IgM und IgG. Lediglich für die Komplementfaktoren C3c und C4 konnte kein Zusammenhang mit der Abstinenzdauer nachgewiesen werden.
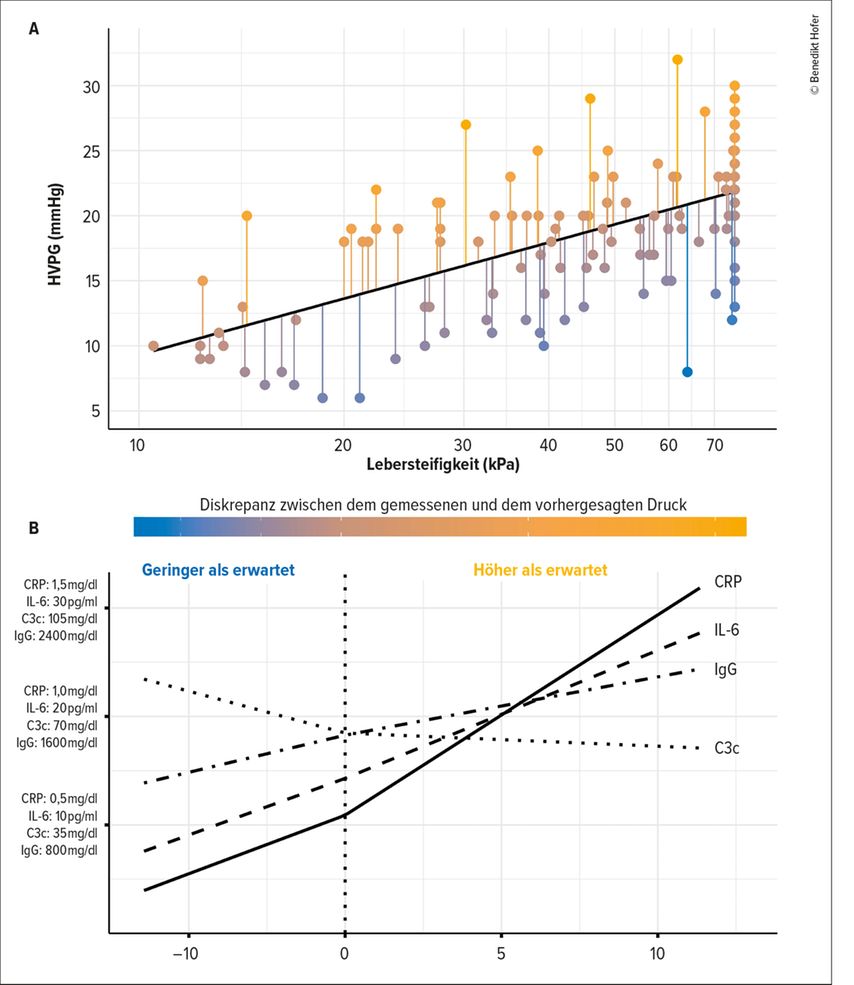
Um nun herauszufinden, ob systemische Inflammation die dynamische Komponente der portalen Hypertension beeinflusst, wurde – analog zu den Mausmodellen – zuerst der Zusammenhang zwischen der Lebersteifigkeit, also der statischen Komponente, und dem HVPG analysiert (Abb. 2A). Wie bereits in den Mausmodellen beobachtet, zeigte sich auch hier, dass manche Patient:innen einen deutlich höheren HVPG aufwiesen, als man dies rein aufgrund der Lebersteifigkeit erwarten würde. Wie in Abbildung 2B verdeutlicht, zeigte sich, dass bei den Patient:innen mit einem HVPG, der höher als erwartet war, auch eine signifikant ausgeprägtere systemische Inflammation nachgewiesen werden konnte. Im Detail bestand ein signifikanter Zusammenhang mit erhöhtem CRP, erhöhtem IL-6 und erhöhten Immunglobulin-Leveln. Zusätzlich zeigte sich ein Zusammenhang mit erniedrigtem Komplementfaktor C3c, was als Hinweis auf anhaltenden Komplementverbrauch gesehen werden kann.
Abb. 2: Einfluss der systemischen Inflammation auf die dynamische Komponente der portalen Hypertension bei abstinenten Patient:innen mit alkoholbedingter Leberzirrhose. (A) Lineares Regressionsmodell basierend auf dem Zusammenhang zwischen der Lebersteifigkeit (logarithmisch) und dem HVPG inklusive der Residuen des Modells, also der Diskrepanz zwischen dem gemessenen und dem vorhergesagten HVPG. (B) Korrelation zwischen den Residuen des Modells (x-Achse) und Biomarkern der systemischen Inflammation (y-Achse)
Fazit
Zusammengefasst hat unsere Studie ergeben, dass das Beenden der Verabreichung des Toxins im Mausmodell sowie anhaltende Alkoholabstinenz bei alkoholbedingter Zirrhose das Ausmaß der hepatischen und systemischen Inflammation signifikant verringern. Jedoch scheint persistierende geringgradige Inflammation auch während der Krankheitsregression den intrahepatischen Gefäßwiderstand und damit die dynamische Komponente der portalen Hypertension signifikant zu beeinflussen.
Literatur:
1 Bosch J et al.: Evolution in the understanding of the pathophysiological basis of portal hypertension: How changes in paradigm are leading to successful new treatments. J Hepatol 2015; 62: 121-30 2 Ripoll C et al.: Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis.Gastroenterology 2007; 133: 481-8 3 Hofer BS et al.: Alcohol abstinence improves prognosis across all stages of portal hypertension in alcohol-related cirrhosis. Clin Gastroenterol Hepatol 2023; 21(9): 2308-17.e7 4 Mandorfer M et al.: Changes in hepatic venous pressure gradient predict hepatic decompensation in patients who achieved sustained virologic response to Interferon-free therapy. Hepatology 2020; 71: 1023-36 5 Königshofer P et al.: Distinct structural and dynamic components of portal hypertension in different animal models and human liver disease etiologies. Hepatology 2022; 75: 610-22 6 Schwabl P et al.: New reliability criteria for transient elastography increase the number of accurate measurements for screening of cirrhosis and portal hypertension. Liver International 2015; 35: 381-90 7 Mehta G et al.: Systemic inflammation is associated with increased intrahepatic resistance and mortality in alcohol-related acute-on-chronic liver failure. Liver International 2015; 35: 724-34 8 Simbrunner B et al.: Dysregulated biomarkers of innate and adaptive immunity predict infections and disease progression in cirrhosis. JHEP Rep 2023; 5:100712 9 Mehta G et al.: Inflammation and portal hypertension - The undiscovered country. J Hepatol 2014; 61: 155-63 10 Simbrunner B et al.: Gut-liver axis signaling in portal hypertension. World J Gastroenterol 2019; 25: 5897-917
Das könnte Sie auch interessieren:
HBV-Reaktivierung unter Immunsuppression
Durch aktuelle Migrationsdynamiken befindet sich auch in Österreich die Prävalenz der Infektion mit dem Hepatitis-B-Virus (HBV) im Steigen. Besonders bei Patient:innen unter ...
Hepatitis-A-Ausbrüche in den USA
Zwischen 2016 und 2022 kam es in den USA zu einer unerwarteten Häufung von Hepatitis-A-Ausbrüchen. Besonders betroffen waren sozioökonomisch benachteiligte Bevölkerungsgruppen mit ...
Neues aus der Welt der Hepatologie
Kürzlich wurden Arbeiten zu den Risiken nach TIPS-Implantation veröffentlicht und eine neue S3-Leitlinie zu autoimmunen Lebererkrankungen steht nun zur Verfügung. Aktuelles gibt es aber ...