Hepatozelluläres Karzinom: Müssen wir die Guidelines neu schreiben?
Autorin:
Dr. med. Christina Fricke
Klinische Abteilung für Innere Medizin 2
Universitätsklinikum St. Pölten
Karl Landsteiner Privatuniversität für Gesundheitswissenschaften
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das hepatozelluläre Karzinom (HCC) ist ein «interdisziplinäres Karzinom». Aufgrund der vielen Therapieoptionen ist ein enger Austausch zwischen Hepato-(Gastroentero-)logen/Onkologen, Chirurgen und Radiologen unverzichtbar. Das spiegelt sich auch in den Neuerungen wider.
Keypoints
-
Das engmaschige HCC-Screening bei chronischen Lebererkrankungen ist wichtig für die Früherkennung und rechtzeitige Transplantation.
-
Durch das Downstaging mittels interventioneller Therapien soll die Transplantierbarkeit erreicht werden.
-
Bei LTX-gelisteten Patienten kommt die Bridging-Therapie mit interventioneller Behandlung zum Einsatz.
-
RFA und MWA sind nun gleichwertige Therapien.
-
TACE und SIRT/TARE weisen gleichwertige Wirksamkeit auf.
-
Systemische Erstlinientherapie ist ein PD-L1-Inhibitor plus Bevacizumab, bei Kontraindikationen ein Multikinasehemmer.
Die Zahl der HCC-bedingten Todesfälle hat in den letzten drei Dekaden drastisch zugenommen. Während 1990 eine Inzidenz von 26 000 HCC weltweit gemeldet wurden, waren es 2019 bereits circa 50 000.1,2 Dies wird primär auf eine alternde Bevölkerung mit einer wachsenden Prävalenz von chronischen Lebererkrankungen zurückgeführt.
In 80–90% der Fälle entsteht das HCC aus einer fortgeschrittenen Leberfibrose bzw. Leberzirrhose. Zugrunde liegende Erkrankungen sind typischerweise virale Hepatitiden B oder C, Fettlebererkrankungen bei erhöhtem Alkoholkonsum oder metabolisch assoziierte Fettlebererkrankungen (MAFLD) und Eisenspeicherkrankheiten (Hämochromatose). Bei Patienten mit Leberzirrhose durch Autoimmunerkrankungen (primär biliäre Zirrhose [PBC], autoimmune Hepatitis [AIH]) oder Alpha-1-Antitrypsin-Mangel wird eine geringere HCC-Inzidenz beschrieben.
Durch die Prävention und Behandlung der chronischen Lebererkrankungen kann die Inzidenz von Leberzellkrebs reduziert werden. Neben den krankheitsspezifischen Therapien stehen bei der Fettlebererkrankung die Alkoholabstinenz sowie die Ernährung und Ausdauersport zur Gewichtsreduktion im Vordergrund.3 Bei Typ-2-Diabetikern ist eine Optimierung des HbA1c eine wichtige Massnahme. Besonders Patienten mit einem HCC im BCLC-A- und -B-Stadium sollten in Bezug auf ihren Diabetes gut eingestellt sein.
HCC-Screening
Bei chronischen Lebererkrankungen empfiehlt die European Association for the Study of the Liver (EASL) ein HCC-Screening mittels qualitativ hochwertiger Abdomensonografie alle sechs Monate. Bei eingeschränkter Schallqualität wird alternativ eine Leber-MRT mit Primovist oder eine 3- oder 4-Phasen-CT der Leber empfohlen. Die MRT hat eine hohe Sensitivität und Spezifität für das HCC-Screening.4 Ziel des engmaschigen Screenings ist, das HCC im Frühstadium zu erkennen und einen möglichst kurativen Therapieansatz (Lebertransplantation) anzustreben.
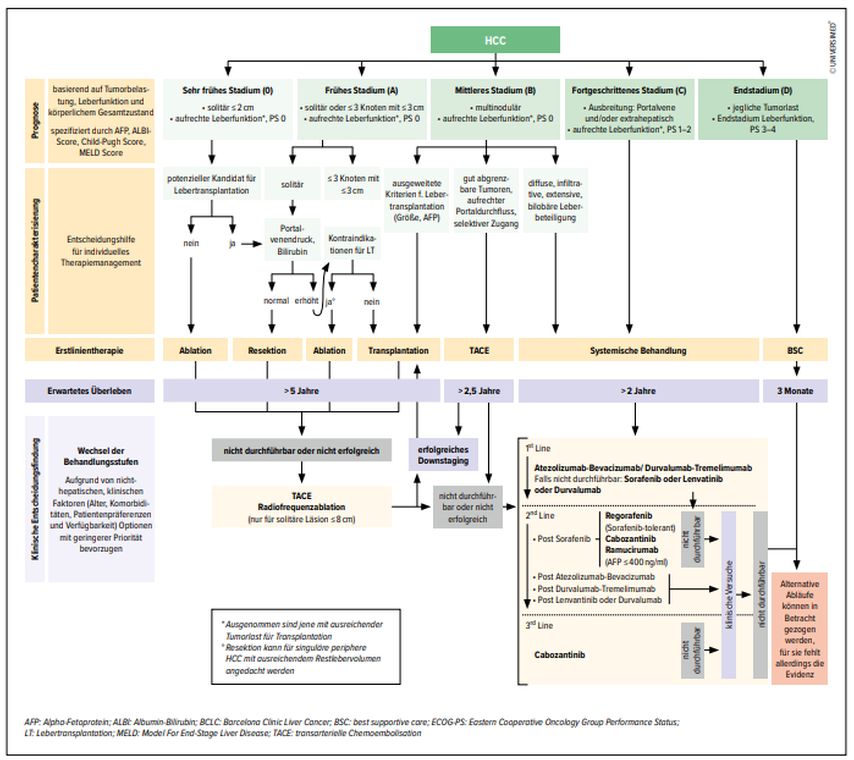
Das Tumorstadium des HCC sollte vor einer Therapie nach den BCLC(Barcelona Clinic Liver Cancer)-Kriterien definiert werden (Abb. 1). Neben der Anzahl und der Grösse der HCC-Herde sind das Vorliegen oder Nichtvorhandensein einer Tumor-Pfortaderthrombose, die Einschätzung der Leberfunktion und der ECOG-Performance-Status (PS) von essenzieller Bedeutung. Die Leberfunktion kann mittels Child-Pugh-Score (CPS) und «Model for End-Stage Liver Disease (MELD)»-Score berechnet werden. Im Zuge der Therapien sollten ECOG-PS, CPS und MELD regelmässig reevaluiert werden, da es unter Therapie oder auch im Verlauf zu Dekompensationen der Leberzirrhose kommen kann.
Abb. 1: BCLC-Staging- und Behandlungsstrategie 2022 (modifiziert nach Reig M et al.: J Hepatol 2022; 76: 681-93)
Chirurgische und radiologisch interventionelle Therapien
Voraussetzung für eine Lebertransplantation (LTX) bei Patienten mit HCC ist ein Stadium innerhalb der Mailand-Kriterien (solitärer Tumor ≤5 cm oder maximal drei Läsionen ≤3 cm, Abb. 1).
Eine Neuerung in der Therapiekaskade ist das «Downstaging». Hierfür qualifizieren sich Patienten ausserhalb der Mailand-Kriterien, jedoch noch innerhalb der UCSF(University of California San Francisco)-Kriterien (solitärer Tumor ≤6,5cm oder maximal drei Läsionen ≤4,5cm und maximale Summe der addierten Tumordurchmesser von ≤8cm).
Das Downstaging kann mittels atypischer Leberresektionen, Ablationen wie Radiofrequenz (RFA), Mikrowellenablationen (MWA) oder einer transarterieller Chemoembolisation (TACE) erfolgen. Leberresektion und Ablation sollten favorisiert werden. Das Langzeitüberleben nach LTX bei Patienten nach Downstaging ist ähnlich gut wie bei Patienten, die primär innerhalb der Mailandkriterien transplantiert wurden.5, 6 Die oben genannten Verfahren sollten als Bridging-Therapie bis zur LTX angewendet werden.
Bei Patienten mit HCC und einem Serum-Alpha-Fetoprotein (AFP) >1000ng/nl wird von einer LTX abgeraten, da laut Literatur eine hohe Rezidivrate des HCC nach LTX beobachtet wurde.
Bei den lokal interventionellen radiologischen Therapien wird nun neben der bereits etablierten Radiofrequenzablation (RFA) die Mikrowellenablation (MWA) als gleichwertige Standardtherapie in der HCC-Behandlung angesehen. Die MWA erreicht eine ausgedehntere Tumornekrose als die RFA und ist möglicherweise die beste Option für Patienten mit einem HCC ≤4cm. Bei HCC-Herden ≤2cm wird eine Resektion empfohlen, da die Ablation weniger effektiv ist und eine höhere Rate an Lokalrezidiven beschrieben wird.7–9
Bei Kontraindikationen für eine Transplantations-, eine RFA/MWA-Therapie oder eine Resektion ist die TACE die Therapie der Wahl. Aktuelle Studien haben eine vergleichbare Wirksamkeit von transarterieller Radioembolisation/selektiver interner Radiotherapie (TARE/SIRT) im Vergleich zur TACE nachgewiesen.10 Die TARE sollte vor allem bei Patienten mit einzelnen Knoten ≤8cm in Erwägung gezogen werden. Diese neue BCLC-Empfehlung beruht auf der LEGACY-Studie.10
Systemische Therapien
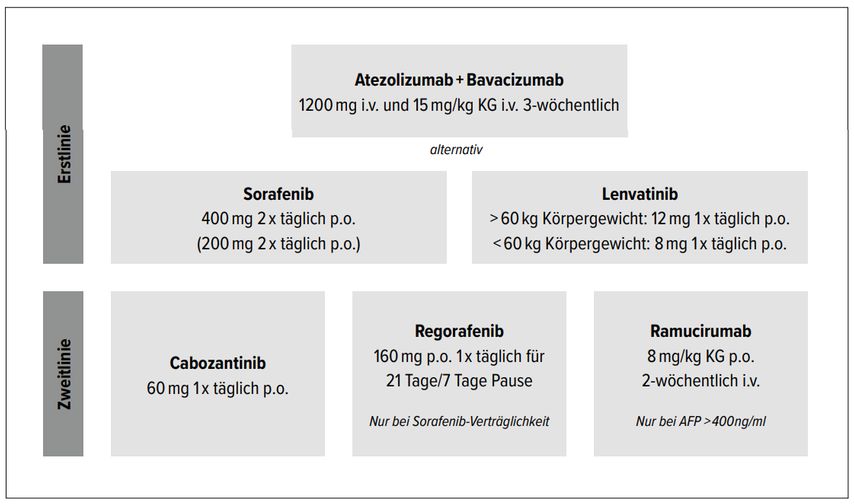
Im Jahr 2008 wurde der erste Tyrosinkinasehemmer (Sorafenib) zur Behandlung von Patienten mit einem HCC im BCLC-C-Stadium zugelassen. Erst 2017 folgten nach positiven Phase-III-Studien weitere Substanzen, wie der Multikinaseinhibitor Lenvantinib mit der REFLECT-Studie. Mit der Phase-III-Studie IMbrave150 kam es zu einer bahnbrechenden Therapieoption mit der Kombination des PD-L1(«programmed death ligand 1»)-Inhibitors Atezolizumab und des VEGF-Inhibitor Bevacizumab (Abb. 2).
Die Kombinationstherapie zeigte einerseits einen Überlebensvorteil (medianes Gesamtüberleben 19,2 vs. 13,4 Monate), andererseits erbrachte sie neben einer guten Verträglichkeit auch eine hohe Ansprechrate im Vergleich zu Sorafenib.11, 12 Seit Ende 2020 ist diese Kombinationstherapie als Erstlinientherapie für das fortgeschrittene nicht resektable HCC zugelassen.
Weitere immunologische Kombinationstherapien wurden in Phase-III-Studien geprüft, so z.B. in der HIMALAYA-Studie (PD-L1-Inhibitor Durvalumab und Tremelimumab). Auch in dieser Studie zeigten sich positive Daten.
Fazit
In naher Zukunft wird es wohl weitere Zulassungen von immunologischen Therapien geben. Erfreulicherweise ist in der letzten Dekade sowohl in der interventionellen als auch in der systemischen Therapie des HCC eine beachtliche Entwicklung zu verzeichnen. In Anbetracht der eindrücklichen Ansprechraten und der Möglichkeit eines Downstagings zur Transplantierbarkeit ist ein Paradigmenwechsel in der zukünftigen Therapiekaskade durchaus vorstellbar.
Beim Leberzellkrebs besteht eine sehr hohe Dynamik in der Therapielandschaft, die auf eine weiterhin spannende Entwicklung hoffen lässt.
Literatur:
1 Murray C et al.: Global burden of 369 diseases and injuries in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet 2020; 396: 1204-22 2 Global Health Data Exchange (GHDx). GBD results tool. https://ghdx.healthdata.org/gbd-results-tool (aufgerufen am 4.5.2022) 3 European Association for the Study of the Liver: EASL Policy Statement on food, obesity and non-alcoholic fatty liver disease (NAFLD). https://easl.eu/wp-content/uploads/2019/04/EASL-Policy-statement-on-Food-obesity-and-Non-Alcoholic-Fatty-Liver-Disease.pdf (aufgerufen am 4.5.2022) 4 GuptaP et al.: Abbreviated MRI for hepatocellular carcinoma screening: a systematic review and meta-analysis. J Hepatol 2021; 75: 108-19 5 EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol 2018; 69: 182-236 6 Yao FY et al.: Downstaging of hepatocellular cancer before liver transplant: long-term outcome compared to tumors within Milan criteria. Hepatology 2015; 61: 1968-77 7 Yu J et al.: Percutaneous cooled-probe microwave versus radiofrequency ablation in early-stage hepatocellular carcinoma: a phase III randomised controlled trial. Gut 2017; 66: 1172-83 8 Vietti Violi N et al.: Efficacy of microwave ablation versus radiofrequency ablation for the treatment of hepatocellular carcinoma in patients with chronic liver disease: a randomised controlled phase 2 trial. Lancet Gastroenterol Hepatol 2018; 3: 317-25 9 Han J et al.: Radiofrequency ablation versus microwave ablation for early stage hepatocellular carcinoma: a PRISMA-compliant systematic review and meta-analysis. Medicine (Baltimore) 2020; 99: e22703 10 Salem R et al.: Yttrium-90 radioembolization for the treatment of solitary, unresectable hepatocellular carcinoma: the LEGACY study. Hepatology 2021; 74: 2342-52 11 Finn RS et al.: Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. N Engl J Med 2020; 382: 1894-905 12 Finn RS et al.: IMbrave150: Updated overall survival (OS) data from a global, randomized, open-label phase III study of atezolizumab (atezo) + bevacizumab (bev) versus sorafenib (sor) in patients (pts) with unresectable hepatocellular carcinoma (HCC). J Clin Oncol 2021; 39: 267
Das könnte Sie auch interessieren:
HBV-Reaktivierung unter Immunsuppression
Durch aktuelle Migrationsdynamiken befindet sich auch in Österreich die Prävalenz der Infektion mit dem Hepatitis-B-Virus (HBV) im Steigen. Besonders bei Patient:innen unter ...
Hepatitis-A-Ausbrüche in den USA
Zwischen 2016 und 2022 kam es in den USA zu einer unerwarteten Häufung von Hepatitis-A-Ausbrüchen. Besonders betroffen waren sozioökonomisch benachteiligte Bevölkerungsgruppen mit ...
Neues aus der Welt der Hepatologie
Kürzlich wurden Arbeiten zu den Risiken nach TIPS-Implantation veröffentlicht und eine neue S3-Leitlinie zu autoimmunen Lebererkrankungen steht nun zur Verfügung. Aktuelles gibt es aber ...