Mise à jour sur le syndrome de Sjögren
Compte-rendu:
Mag. pharm. Irene Senn, PhD
Journaliste médicale
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Dans le cadre d’un webinaire organisé par Rheuma Schweiz, le Pr Stephan Gadola, MD, PhD, Bâle, a donné un aperçu des critères actuels de diagnostic et de classification du syndrome de Sjögren, des pièges fréquents et des nouveaux résultats de recherche passionnants.
Le syndrome de Sjögren primaire («Sjögren’s syndrome, SjS) est une sialadénite chronique auto-immune des grandes glandes salivaires. Par rapport à la forme primaire du SjS, la forme secondaire accompagne une autre maladie auto-immune du tissu conjonctif (connectivite, collagénose), par exemple un lupus érythémateux disséminé (LED) ou une polyarthrite rhumatoïde (PR).
Manifestationscliniques variées
Le phénotype du SjS primaire peut se présenter de manière très variable. Le plus souvent, on observe une sécheresse pathologique des yeux, des muqueuses buccales et vaginales, ou syndrome sec, ainsi qu’une fatigue chronique sévère. Cependant, ni la fatigue ni le syndrome sec ne sont spécifiques au SjS. Ces deux symptômes sont très répandus et sont généralement attribuables à des processus non auto-immuns. Ainsi, environ 12% des personnes de plus de 50 ans souffrent de sécheresse oculaire1 et la xérostomie touche environ 22% des adultes.2
«Le SjS primaire est plus rare qu’on a tendance à le penser et n’a en fait qu’une prévalence de 0,1 à 0,2%», a précisé S.Gadola. Par conséquent, seule une très petite portion des patients présentant des symptômes de syndrome sec sont également atteints de SjS. Des manifestations extra-glandulaires apparaissent chez environ la moitié des patients atteints de SjS, mais on estime qu’elles ne sont pertinentes que dans 10 à 15% des cas. Les arthralgies et autres syndromes douloureux musculosquelettiques sont très fréquents, mais non spécifiques; une véritable synovite apparaît dans environ 10% des cas. Des cytopénies sont également souvent rapportées, et des manifestations systémiques au niveau des organes, comme une atteinte pulmonaire et rénale, sont décrites avec une fréquence variable, tandis que les myosites sont plutôt rares.3 Cependant, la proportion des différentes manifestations cliniques varie considérablement selon la cohorte étudiée.
Critères de classification avec des points faibles
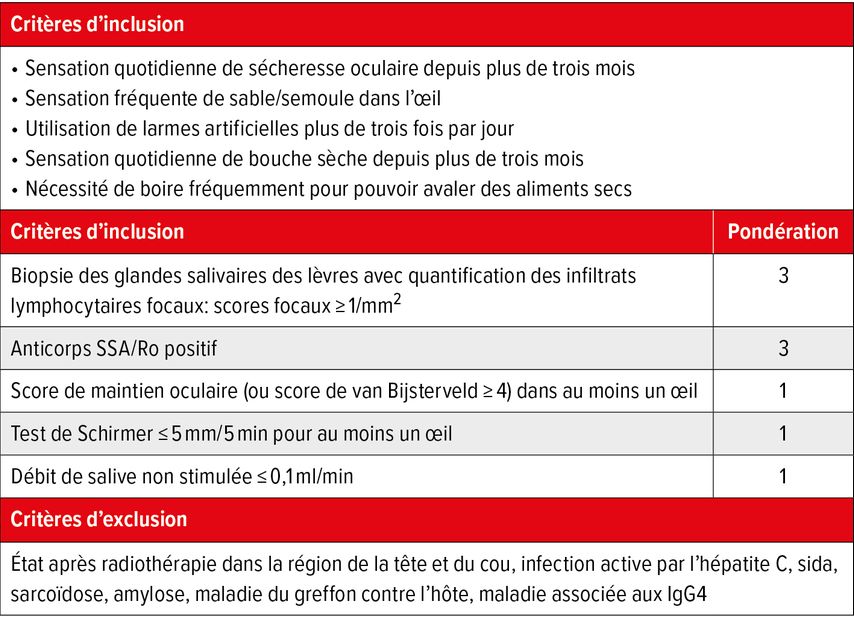
Bien qu’ils ne constituent pas des critères diagnostiques à proprement parler, les critères de classification de l’American College of Rheumatology (ACR) et de l’European League Against Rheumatism (EULAR) de 2016 sont aujourd’hui utilisés pour établir le diagnostic, tant dans la pratique que dans les études cliniques.4 Le diagnostic de SjS primaire est posé si l’un des critères d’inclusion sont remplis (symptômes subjectifs de syndrome sec depuis au moins 3 mois sans autre explication), si les diagnostics d’exclusion ne s’appliquent pas et si un total de points ≥4 est atteint pour les critères de classification (Tab. 1). Avec une pondération de 3 points chacun, une importance particulière est accordée aux résultats histopathologiques de la biopsie labiale et à la détection des anticorps (Ac) anti-SSA/Ro. D’autre part, les résultats de l’imagerie ou de l’histopathologie des grandes glandes salivaires, véritables organes cibles dans le SjS, ne sont malheureusement pas évalués.
Tab. 1: Critères de classification ACR/EULAR 2016 pour le syndrome de Sjögren primaire (adaptés de Shiboski CH et al. 2017)4
La biopsie des glandes salivaires des lèvres est surestimée
«La biopsie des lèvres est très souvent effectuée dans la pratique, mais elle est surestimée», a clairement expliqué S.Gadola. En effet, un «véritable» SjS primaire pourrait très bien être diagnostiqué sans cet examen, et donne en outre souvent des résultats faux positifs, probablement en raison de la position exposée de la muqueuse buccale. Une étude autopsique a ainsi révélé que 15% des personnes examinées présentaient une infiltration lymphocytaire focale des petites glandes salivaires – et même une infiltration de plus haut grade chez 8% d’entre elles – et ce, bien entendu, sans présence d’auto-immunité.5 «Cela mène à des erreurs de diagnostic. Les marqueurs des centres germinaux, qui sont rarement rapportés dans les résultats des biopsies, sont considérés comme des indicateurs valables d’un SjS primaire dans la biopsie des lèvres.» Selon son expérience, l’échographie des grandes glandes salivaires pour détecter la sialadénite chronique dans le SjS est sensible, d’autant plus que la plupart des patients consultent pas un rhumatologue avant plusieurs mois, voire des années.
Évaluer les biomarqueurs de manière critique
Les biomarqueurs jouent également un rôle important dans le diagnostic du SjS primaire. Dans la pratique, les anticorps antinucléaires (ANA) ainsi que les Ac SSA/Ro et Ac SSB/La sont importants. Le dosage des anticorps anti-α-fodrine n’est généralement pas nécessaire. Lors de l’interprétation des résultats sérologiques, il convient de garder à l’esprit que les ANA sont très fréquents dans la population générale: selon l’âge et le pays, de 5,9 à 30,8% des personnes sont porteuses d’ANA.6,7 De même, les Ac ASS/Ro sont positifs chez environ 3% des adultes en bonne santé et font donc partie des autoanticorps faussement positifs les plus fréquents.8 «Comme on le voit, le SjS peut facilement être surdiagnostiqué si l’on n’examine pas les critères sous un oeil», résume S.Gadola.
Des virus comme déclencheurs?
On ignore toujours la cause de l’apparition de la maladie. Cependant, les virus ciblant les glandes (EBV, hépatite D, HTLV-1) sont de plus en plus associés à l’immunopathogenèse du SjS. En 2022, une étude de Harvard a fait sensation en révélant un lien évident entre l’infection par l’EBV et l’apparition de de la sclérose en plaques.9 Il pourrait en aller de même pour le SjS. On pense que le virus Epstein-Barr déclenche l’expression de SSB à la surface des cellules épithéliales des glandes salivaires – un déclencheur possible de la formation d’Ac SSB/La. En outre, l’EBV est connu pour son tropisme lymphocytaire B et sa capacité à stimuler les lymphocytes B. On ignore encore si d’autres virus ont également cette capacité et s’il existe des différences entre un SjS positif ou négatif pour les Ac SSB/La.
Les scores et leur pertinence dans les études
Deux scores se sont aujourd’hui établis pour évaluer la situation clinique et les symptômes subjectifs: l’EULAR Sjögren’s Syndrome Disease Activity Index (ESSDAI) et l’EULAR Sjögren’s Syndrome Patient-Reported Index (ESSPRI). Ils sont surtout utilisés dans les études cliniques. L’ESSDAI est utilisé pour évaluer l’activité systémique de la maladie. Il couvre 12 domaines, dont l’état général (symptômes B), l’hypertrophie des ganglions lymphatiques et de la rate, l’atteinte articulaire, musculaire, pulmonaire, neuronale centrale et périphérique et rénale, ainsi que les paramètres hématologiques et de chimie de laboratoire. Un nombre de points est attribué à chaque domaine en fonction de l’activité, multiplié par la pondération pour le domaine en question. La somme totale de tous les points est considérée comme l’expression de l’activité actuelle de la maladie.10 Parmi les faiblesses de l’ESSDAI, S.Gadola a cité la complexité, le fait que la graduation n’est pas standardisée et que d’autres causes doivent toujours être exclues dans tous les domaines. L’ESSPRI est utilisé pour quantifier la symptomatologie décrite subjectivement par le patient. Ce score comprend l’évaluation subjective concernant les symptômes de syndrome sec, la fatigue et la douleur. L’ESSDAI et l’ESSPRI sont complémentaires, mais ne corrèlent pas entre eux. Dans les études actuelles, les patients sont donc souvent répartis en deux cohortes: l’une avec une forte symptomatologie selon l’ESSPRI et l’autre avec une forte activité de la maladie selon l’ESSDAI. Le plus souvent, l’ESSDAI est choisi comme critère d’évaluation primaire.
Options thérapeutiques actuelles
Malgré l’acquisition croissante de connaissances sur la pathogenèse du SjS, il n’existe à ce jour aucun traitement systémique ciblé. Le traitement s’oriente vers les manifestations cliniques prioritaires.
Pour le traitement de la sécheresse buccale pathologique, l’accent est mis sur la prévention des caries au moyen de fluorures topiques, de l’hygiène dentaire et des scellements des sillons dentaires. Les autres options de traitement, comme le rinçage au phosphate de calcium et les solutions antimicrobiennes topiques (chlorhexidine), ne sont pas fondées sur des preuves. En cas de parodontite, la doxycycline à faible dose (50mg) peut être utilisée. Il convient en outre de veiller à un apport liquidien suffisant. «Recommandez à vos patients de boire de grandes portions plutôt que de petites gorgées fréquentes. Lorsqu’ils boivent par petites gorgées, ils évacuent la salive à chaque fois. L’eau s’évapore beaucoup plus vite que la salive», a indiqué S.Gadola. En cas de xérostomie sévère ou réfractaire, la pilocarpine peut être envisagée. En raison de son mécanisme d’action (stimulation du système parasympathique), la substance active présente toutefois quelques effets secondaires désagréables, notamment une transpiration accrue ou des bouffées vasomotrices.
«Nous ne connaissons pas vraiment les causes de la sécheresse de la bouche et des yeux dans le SjS», a déclaré S.Gadola. Dans la xérophtalmie, on parle d’un dysfonctionnement et d’une perte des glandes lacrymales (dus à des inflammations ou à des troubles de l’innervation) ou d’un dysfonctionnement et d’une perte des glandes de Meibomius (dus à une carence en androgènes, à des inflammations).11,12 Les substituts lacrymaux, en particulier ceux contenant de l’acide hyaluronique ou une forte teneur en lipides, aident à remplacer le liquide lacrymal et à réduire l’évaporation. En cas de sécheresse oculaire sévère, il est possible de passer à des collyres contenant des glucocorticoïdes ou de la cyclosporine. En cas de dysfonctionnement des glandes de Meibomius (sécrétion séchée), le réchauffement local des paupières à 40°C, p.ex. à l’aide de sachets de thé chauds, de masques chauffants ou d’appareils spécialement conçus à cet effet, peut fluidifier la sécrétion glandulaire et apporter ainsi un soulagement.13
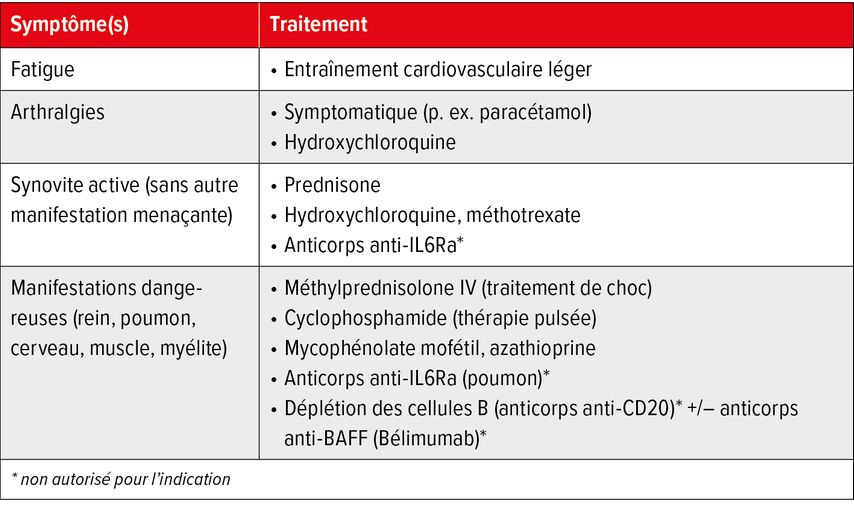
Le SjS n’est pas systématiquement associé à des symptômes de syndrome sec; parfois, les manifestations extra-glandulaires sont au premier plan. Un aperçu des options thérapeutiques respectives est présenté au Tableau 2.
Nouvelles approches thérapeutiques
Ces dernières années, on a acquis certaines connaissances essentielles sur les mécanismes pathologiques du SjS. Dans les grandes glandes salivaires des patients atteints de SjS primaire, on trouve généralement des follicules lymphoïdes tertiaires (TLF). Il s’agit d’une structure pathologique associée à différentes maladies auto-immunes (LED, Hashimoto, SEP, granulomatose avec polyangéite). Les TLF contiennent non seulement des lymphocytes B, mais aussi des lymphocytes T, qui interagissent tous deux. Une paire de signaux importante est le CD40 sur les lymphocytes B et le ligand du CD40 (correspondant au CD154) sur les lymphocytes T, qui sont également étudiés comme nouvelles cibles (voir ci-dessous).
Le BAFF, une nouvelle cible
Il y a une stimulation chronique des lymphocytes B dans le SjS. De plus, on sait aujourd’hui que les patients atteints de SjS primaire présentent des taux significativement plus élevés de facteur d’activation des lymphocytes B (BAFF) que les témoins sains.14 Le BAFF est une cytokine qui joue un rôle important dans la différenciation, la maturation et la prolifération des lymphocytes B et qui est probablement sécrétée par les macrophages, les monocytes et les cellules dendritiques activés.15 En cas de déplétion des lymphocytes B, p.ex. avec du cyclophosphamide ou un anticorps anti-CD20, le taux de BAFF est multiplié par 4 ou 5 en quelques heures. «Et ces niveaux élevés de BAFF ne font pas que stimuler la différenciation et la prolifération des lymphocytes B tissulaires, ils protègent également les lymphocytes B d’une réaction cytotoxique médiée par les anticorps. Cela a été démontré in vitro», a expliqué le rhumatologue. De plus, il se produit une sélection de clones de lymphocytesB auto-immuns dans les glandes salivaires.14 Le BAFF ainsi que le récepteur BAFF sont également des structures cibles prometteuses pour de nouvelles approches thérapeutiques.
Qu’est-ce qui est dans le pipeline?
Une série de nouvelles molécules sont actuellement étudiées dans le cadre d’essais de phase II/III. Les deux anticorps monoclonaux, l’ianalumab et l’iscalimab, sont actuellement considérés comme particulièrement prometteurs.
L’ianalumab est un anticorps monoclonal qui se lie spécifiquement au récepteur BAFF et dispose d’un double mécanisme d’action: d’une part, l’activation des lymphocytes B médiée par le BAFF est inhibée par le blocage du récepteur BAFF et, d’autre part, l’ianalumab entraîne une déplétion des lymphocytes B exprimant le récepteur BAFF. Les données de phase IIb sur l’ianalumab ont montré une réduction modérée mais cliniquement significative de l’activité de la maladie de 1,92 points au score ESSDAI.16 «Cette étude peut néanmoins être qualifiée d’historique, car il s’agissait de la toute première grande étude randomisée en double aveugle et contrôlée par placebo sponsorisée par l’industrie pharmaceutique à montrer un effet dans le SjS primaire», a indiqué S.Gadola.
Une autre approche thérapeutique consiste à inhiber la co-stimulation des lymphocytes T par l’anticorps anti-CD40 iscalimab.17 «Les données concernant l’iscalimab semblent comparativement meilleures, mais il s’agit également d’un traitement plus agressif», a expliqué S.Gadola. L’étude de phase IIb de détermination de la dose TWINSS a évalué l’efficacité et l’innocuité de l’iscalimab dans deux groupes de patients différents: la cohorte 1 (C1) présentant une maladie systémique modérée/sévère (ESSDAI élevé) et la cohorte 2 (C2) présentant une maladie systémique légère (ESSDAI faible) et des symptômes importants de syndrome sec et de fatigue. Après 24 semaines, l’anticorps anti-CD40 avait entraîné une réduction significative et dose-dépendante de l’ESSDAI dans la cohorte C1. Les résultats étaient également positifs dans la cohorte C2: la fatigue a été réduite et le flux salivaire stimulé et non stimulé a pu être augmenté.18 «C’est un résultat remarquable. En effet, dans le cas des agents entraînant une déplétion des lymphocytes B, comme le rituximab, de nombreuses études ont certes montré qu’ils agissaient sur les symptômes extra-glandulaires, mais pas sur la sécheresse», a fait remarquer S.Gadola. L’anticorps est maintenant testé dans des études de phase III.
Source:
Rheuma Schweiz, Webinar: «Sjögren-Syndrom: ein Update», Pr Stephan Gadola, MD, PhD, 11 mars 2024
Littérature:
1 Dana R et al.: Am J Ophthalmol 2019; 202: 47-54 2 Agostini BA et al.: Braz Dent J 2018; 29: 606-18 3 Baldini C: American College of Rheumatology 2012; 2012 (ACR/ARHP Annual Meeting): Abstract #2185 4 Shiboski CH et al.: Ann Rheum Dis 2017; 76: 9-16 5 Radfar L et al.: Arthritis Rheum 2002; 47: 520-4 6 Didier K et al.: Front Immunol 2018; 9: 541 7 Satoh M et al.: Arthritis Rheum 2012; 64: 2319-27 8 Hayashi N et al.: Mod Rheumatol 2008; 18: 153-60 9 Bjornevik K et al.: Science 2022; 375: 296-301 10 Seror R et al.: Ann Rheum Dis 2010; 69: 1103-9 11 Shimazaki J et al.: Ophthalmology 1998; 105: 1485-8 12 Kang YS et al.: Int Ophthalmol 2018; 38: 1161-7 13 Badawi D: Clin Ophthalmol 2018; 12: 683-94 14 Pollard RP et al.: Ann Rheum Dis 2013; 72: 146-8 15 Nocturne G et al.: Nat Rev Rheumatol 2013; 9: 544-56 16 Bowman SJ et al.: Lancet 2022; 399: 161-71 17 Pontarini E et al.: Clin Exp Rheumatol 2020; 38 Suppl 126: 222-7 18 Fisher BA et al.: Arthritis Rheumatol 2023; 75(suppl 9): ACR 2023, Abstract #1634
Das könnte Sie auch interessieren:
Présentation des données pertinentes pour la pratique sur le mavacamten dans la CMHO
Le mavacamten, un inhibiteur de la myosine, a été la première substance de cette classe à être autorisée en 2023 pour le traitement de la cardiomyopathie hypertrophique obstructive (CMHO ...
La perte de poids reste toujours le meilleur traitement en cas de MASLD
La directive commune pour la prise en charge de la maladie stéatosique du foie associée à une dysfonction métabolique (MASLD) de l’European Association for the Study of the Liver (EASL ...
Hypertension secondaire: formes, diagnostic & options thérapeutiques
La fréquence d’une cause secondaire d’hypertension artérielle est de 10%. En cas de suspicion d’hypertension secondaire, il convient de procéder à un examen ciblé afin de pouvoir, dans l ...