Radiothérapie: l’essentiel de 2023
Auteur:
Prof. Dr méd. Panagiotis Balermpas
Leitender Arzt
Universitätsspital Zürich
Klinik für Radio-Onkologie
Kompetenzzentrum für Palliative Care
Interdisziplinäres Zentrum für Hochpräzisionstherapie, Zürich
E-Mail: panagiotis.balermpas@usz.ch
En 2023, quelques travaux très importants ont été publiés, dans lesquels des développements «purement» radiothérapeutiques ont conduit à une amélioration significative de critères d’évaluation importants. Les concepts modernes de volume cible peuvent améliorer les résultats dans les cancers du sein et les tumeurs pharyngées, l’intensification de la dose peut révolutionner le traitement du cancer du poumon à petites cellules et les efforts dans le domaine de la préservation des organes, celui des cancers du rectum. Des données récentes confirment l’importance de la radiochimiothérapie conservatrice de la vessie. Enfin, la technique moderne, avec seulement quelques séances et une toxicité minimale, établit de nouveaux standards dans le traitement du carcinome de la prostate.
Keypoints
-
L’irradiation du carcinome du pharynx optimisée pour la dysphagie peut minimiser l’incidence des troubles de la déglutition comme conséquence tardive en épargnant les muscles constricteurs.
-
Une grande méta-analyse montre un avantage significatif en termes de survie pour tous les groupes à risque après une irradiation des voies de drainage lymphatique chez les patientes atteintes d’un cancer du sein.
-
Une escalade de dose entraîne un avantage de survie hautement significatif sans augmentation significative de la toxicité dans le cancer bronchique à petites cellules.
-
L’intensification focalisée de la dose par curiethérapie entraîne des taux très élevés (81–97%) de préservation du rectum.
-
La plus grande analyse réalisée à ce jour de centres d’avant-garde au niveau mondial montre que la préservation de la vessie par radiochimiothérapie est au moins équivalente à une cystectomie.
-
Des données randomisées à long terme établissent la radiothérapie stéréotaxique en 5 séances seulement comme nouveau standard dans le cancer de la prostate.
Tumeurs de la tête et du cou
La dysphagie chronique tardive est une toxicité fréquente après une radio(chimio)thérapie curative des tumeurs de la tête et du cou. Elle a un impact négatif important sur la qualité de vie de la population toujours croissante des survivants à long terme, souvent plus jeunes.
Le groupe britannique dirigé par Chris Nutting, de l’hôpital Royal Marsden, qui a également établi la radiothérapie par modulation d’intensité (IMRT) épargnant les parotides dans la même indication, a publié l’année dernière les résultats très attendus de l’étude prospective randomisée de phase III sur la préservation des muscles constricteurs.1 Dans la méthode dite optimisée pour la dysphagie (DO, «Dysphagia optimized»), toutes les parties des muscles constricteurs pharyngés sont maintenues en dehors de la zone de forte dose à l’aide d’une planification de l’IMRT sous un certain seuil de dose moyen (50 Gy). Cela s’est traduit par des taux de dysphagie tardive significativement inférieurs, tant subjectivement qu’objectivement, après une période de suivi médiane de 39,5 mois. L’évaluation objective a été réalisée en aveugle par des experts à l’aide de l’inventaire de dysphagie de M.D. Anderson (MDADI). Les patient·es du groupe expérimental DO-IMRT avaient un score MDADI significativement supérieur un an après la radiothérapie (p=0,037, critère d’évaluation primaire), et ce, sans aucune perte en termes d’autres toxicités ou de contrôle de la tumeur.
Ainsi, l’IMRT optimisée pour la dysphagie peut être considérée comme une nouvelle norme dans la planification de l’irradiation en cas de carcinome pharyngé.
Cancer du sein
L’indication et l’utilité d’une irradiation des voies de drainage lymphatique régionales, c’est-à-dire des ganglions lymphatiques axillaires, supraclaviculaires et mammaires internes, ont longtemps été un problème non résolu dans le traitement du cancer du sein. La raison en était l’hétérogénéité des données, qui montraient des résultats parfois controversés en termes de bénéfice oncologique et de toxicité tardive. La toxicité cardiovasculaire tardive redoutée après l’irradiation de la région mammaire interne, en particulier, a compliqué l’évaluation des risques et des bénéfices. L’évolution rapide des techniques radiothérapeutiques et des traitements systémiques au cours des décennies a encore compliqué l’interprétation des données déjà hétérogènes.
Vers la fin de l’année, le «Early Breast Cancer Trialists’ Collaborative Group» (EBCTCG) a publié la plus grande méta-analyse au monde de données individuelles de patientes sur le sujet. Les données de 14324 femmes et de 16 études cliniques menées entre 1961 et 2018 ont été incluses.2 Les études menées entre 1961 et 1978, qui utilisaient des techniques de radiothérapie obsolètes, ont été examinées séparément. Ces études ont parfois montré une augmentation de la mortalité non liée au cancer du sein.
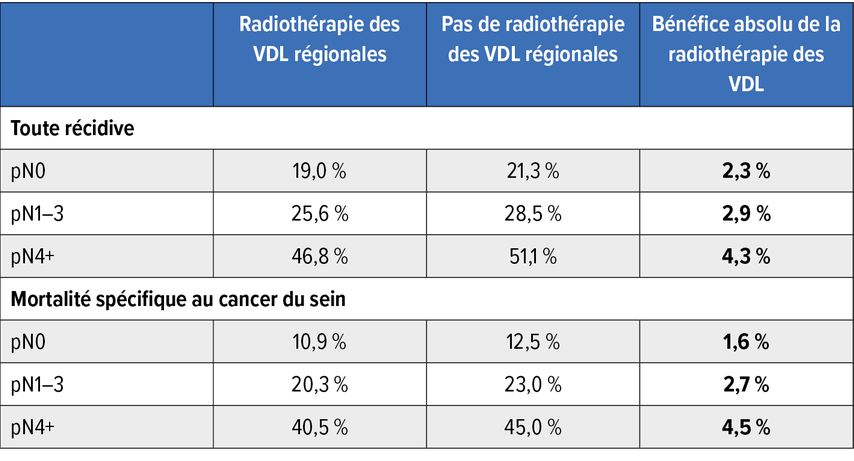
Sur la base de données récentes (1989–2008) concernant 12167 femmes, cette méta-analyse a démontré que l’irradiation des voies de drainage lymphatique (VDL) régionales entraînait une réduction significative de la mortalité totale, de la mortalité spécifique au cancer du sein et du taux de récidive. Plus précisément, dans l’ensemble de la cohorte, l’irradiation des VDL a réduit le risque de récidive à 15 ans de 2,6%, le taux de métastases à distance de 2,9%, la mortalité due au cancer du sein de 3% et la mortalité globale également de 3%.
Il est important de noter que la mortalité sans récidive était identique dans les deux groupes et n’était pas augmentée par l’irradiation supplémentaire. L’avantage absolu ne dépendait que du stade pN comme seul facteur prédictif (Tab. 1). La grande majorité des patientes ont même subi une dissection axillaire et les patientes de catégorie pN0 elles-mêmes ont semblé bénéficier de l’irradiation des VDL régionales.
Tab. 1: Risques cumulés à 15 ans avec ou sans irradiation des VDL régionaux en fonction de la catégorie pN. Modifié selon l’EBCTCG2
Une augmentation du volume de radiothérapie adjuvante, incluant les VDL régionales, doit toujours être proposée et est particulièrement indiquée chez les femmes présentant une atteinte ganglionnaire. L’avantage absolu en termes de survie globale, de 3% à 15 ans, est plus important que celui de nombreux traitements systémiques établis et autorisés.
Cancer bronchique à petites cellules
Les résultats oncologiques après le traitement initial du cancer bronchique à petites cellules sont loin d’être satisfaisants; et depuis l’établissement de la radiochimiothérapie simultanée, peu de progrès ont été enregistrés, du moins au stade de la «maladie limitée». Le taux de survie globale à 5 ans est d’environ 10% pour les stades IIB-IIIC. De même, l’avantage potentiel de l’immunothérapie, contrairement aux stades plus avancés, n’est pas clair et, s’il existe, il est faible.
Dans ce contexte, une étude chinoise prospective randomisée de phase III a examiné les résultats d’une intensification de 20% de la dose de rayonnement physique dans le traitement de première ligne au stade de «maladie limitée». Les résultats ont été présentés pour la première fois au congrès annuel de la Société américaine de radio-oncologie (ASTRO).3 A cette occasion, un total de 224 patient·es ont été randomisé·es selon un rapport de 1:1 pour recevoir une radiochimiothérapie standard à base de platine et d’étoposide, hyperfractionnée (1,5 Gy 2 fois par jour) jusqu’à 45Gy, et le même traitement, mais jusqu’à 54 Gy (1,8 Gy 2 fois par jour). Ce schéma accéléré plus intensif avec application d’une dose physique plus élevée dans le même laps de temps résulte théoriquement en un effet biologique encore plus élevé. Une irradiation prophylactique du cerveau entier a été appliquée à l’ensemble des patient·es répondant au traitement conformément aux recommandations.
Les résultats ont été convaincants: La survie globale (critère d’évaluation primaire, médiane de 62,4 mois versus 43,1 mois) et la survie sans progression dans le groupe expérimental (HR de 0,59 et 0,77, respectivement) ont été significativement prolongées. Il est intéressant de noter que les taux de toxicité redoutés, à savoir l’œsophagite et la pneumonie de grade III–IV, étaient respectivement de 12–13% et de 4,6–6%, ce qui n’est pas inattendu et presque identique dans les deux groupes. Ces données démontrent qu’une escalade intensive de la dose de rayonnement est possible, à la fois par l’augmentation de la dose physique et par l’accélération, avec des résultats oncologiques améliorés sans effets secondaires supplémentaires.
Cancer du rectum
Les progrès réalisés dans le traitement systémique préopératoire du cancer du rectum ont conduit ces dernières années à une amélioration des taux de rémission et des résultats oncologiques, et même à la question de la nécessité d’une radiothérapie tout court dans le cadre d’un traitement néoadjuvant. Toutefois, la préservation du rectum par renoncement à l’opération a également pu passer du statut d’événement «de nature accidentelle» à celui d’objectif oncologique de plus en plus souhaitable et réalisable.
Dans ce contexte, les schémas radiothérapeutiques innovants jouent un rôle de plus en plus important, comme cela a pu être démontré dans le cadre de l’étude prospective randomisée de phase III OPERA.4 Le groupe français dirigé par Jean–Pierre Gerard a réparti aléatoirement 141 patient·es atteint·es d’un cancer du rectum opérable, de stadesc T2–3b cN0-1, selon un rapport de 1:1 pour recevoir une irradiation purement percutanée à dose intensive de 45 Gy plus 9 Gy de boost simultanément à la capécitabine versus une radiochimiothérapie de 45 Gy plus 30 Gy, appliquée comme boost par curiethérapie de contact en trois séances. Les participant·es ont été stratifié·es en fonction de la catégorie T, du diamètre de la tumeur (<3cm vs plus grand) et de la distance par rapport à la ligne ano-cutanée. Le critère d’évaluation principal était la préservation du rectum après trois ans. Une excision totale du mésorectum était effectuée si aucune réponse ou une réponse partielle était postulée après radiothérapie. Des rémissions complètes ou presque complètes ont pu être observées.
La préservation des organes a été possible chez 81% de l’ensemble des patient·es dans le bras de curiethérapie expérimentale, versus 59% dans le bras percutané (p=0,0026, HR: 0,36). Le taux de préservation du rectum était encore plus élevé pour les petites tumeurs <3cm (97% vs 63%, p=0,012, HR: 0,07). La seule toxicité significativement plus fréquente, mais non supérieure, dans le bras expérimental était un taux accru de saignements rectaux de grade I–II (63% vs 12%).
Ces taux de préservation du rectum sont les meilleurs obtenus à ce jour et la méthode doit être proposée aux patient·es admissibles atteint·es de tumeurs cT2–3 qui le souhaitent.
Cancer de la vessie
Jusqu’à présent, les tentatives de comparaison prospective randomisée entre la cystectomie et le traitement trimodal de préservation vésicale (résection transurétrale suivie d’une radiochimiothérapie) ont échoué en raison d’un manque de recrutement. C’est pourquoi les chercheurs des trois centres d’avant-garde au plan mondial dans le traitement du carcinome de la vessie (Boston, Los Angeles, Toronto) ont réuni leurs données et les ont évaluées à la fois selon l’appariement des coefficients de propension (ACP) et selon une analyse pondérée.5
L’analyse finale a permis d’identifier 722 patient·es qui seraient admissibles sans restriction aux deux modalités (cystectomie ou traitement trimodal). En outre, les critères d’inclusion étaient un stadeT2–4 N0 M0, une extension tumorale <7cm, une tumeur solitaire, une hydronéphrose unilatérale maximale, une fonction vésicale adéquate et l’absence de composante de CIS extensif. Dans cette cohorte, les deux méthodes statistiques n’ont pas permis de montrer de différence dans la survie sans métastases (critère d’évaluation primaire, 74% vs 75%) et la survie sans maladie (73% vs 74%). Il est toutefois intéressant de noter que les deux méthodes ont permis d’observer un avantage significatif en termes de survie globale en faveur du traitement trimodal: 77% [72–81] vs 72% [69–75], HR: 0,75 [0,58–0,97] (p=0,0078, ACP).
Tous les résultats étaient cohérents et presque identiques dans les trois centres participants. En outre, une cystectomie de sauvetage n’a été nécessaire que chez 13% des patient·es après un traitement trimodal, et elle n’a été incomplète que dans 1% des cas (R1) et associée à une mortalité acceptable de 2,5%. Ce travail fournit les meilleures preuves à ce jour de l’efficacité d’un traitement trimodal de préservation de la vessie pour des patient·es sélectionné·es. Elle doit être proposée à la totalité des patient·es admissibles comme alternative à la cystectomie.
Cancer de la prostate
Les résultats de l’étude internationale prospective randomisée de phase III PACE-B avaient déjà été publiés en 2022. Elle évaluait la toxicité jusqu’à deux ans après l’administration d’une radiothérapie stéréotaxique (RTST) dans cinq fractions pour les cancers de la prostate des groupes à risque faible et moyen. L’année dernière, les résultats à 5ans, y compris le contrôle biochimique, ont été présentés dans le cadre du congrès annuel de l’ASTRO.6
Au total, 874 patients atteints d’un cancer de la prostate localisé, cT1c–cT2c, Gleason ≤3 + 4, PSA ≤20ng/ml, avec IRM et sans déprivation androgénique ont été randomisés dans l’étude. Les patients ont été répartis selon un rapport de 1:1 pour recevoir une irradiation conventionnelle fractionnée à modérément hypofractionnée (c’est-à-dire 2-3,1 Gy sur 4–8 semaines) ou une RTST en 5séances seulement (36,25Gy et 40Gy sur le volume cible clinique sur 1–2semaines). Le critère d’évaluation primaire était la progression biochimique ou clinique. Les deux groupes étaient bien équilibrés en termes de patient et de caractéristiques de la tumeur. Il est important de souligner que 91% des patients appartenaient au groupe à risque intermédiaire et que 82% avaient un score de Gleason de 7a. En outre, 42% des tumeurs appartenaient à la catégoriecT2c.
L’étude a été positive, avec une absence d’événement chez 95,8% des patients dans le bras RTST et 94,6% dans le bras de traitement conventionnel. Il est important de noter que même après cinq ans, aucune différence significative de toxicité n’a été observée: une toxicité urogénitale de grade 2 ou plus (G2+ selon RTOG) est survenue chez 3,2% (11/348) des patients du bras de traitement conventionnel et 5,5% (20/363) des patients du bras RTST (p=0,14); une toxicité gastro-intestinale de G2+ chez seulement 1 des 348 patients du bras de traitement conventionnel et 1des 363patients du bras RTST (p=0,99).
Ces premières données à long terme sur le fractionnement stéréotaxique extrême pour le cancer de la prostate localisé ouvrent la voie à l’établissement de cette technique moderne en tant que nouveau standard avec un fardeau du traitement réduit pour les patients concernés.
Littérature:
1 Nutting C et al.: DARS Trialist Group. Dysphagia-optimised intensity-modulated radiotherapy versus standard intensity-modulated radiotherapy in patients with head and neck cancer (DARS): a phase 3, multicentre, randomised, controlled trial. Lancet Oncol 2023; 24(8): 868-80 2 Early Breast Cancer Trialists’ Collaborative Group(EBCTCG): Radiotherapy to regional nodes in early breast cancer: an individual patient data meta-analysis of 14324 women in 16 trials. Lancet 2023; 402(10416): 1991-2003 3 Yu J et al.: Standard dose for limited stage small-cell lung cancer: a multicenter, open-label randomized, phase 3 trial.IntJ Radiat Oncol Biol Phys 2023; 117(2): S1 4 Gerard JP et al.: ICONE group. Neoadjuvant chemoradiotherapy with radiation dose escalation with contact x-ray brachytherapy boost or external beam radiotherapy boost for organ preservation in early cT2-cT3 rectal adenocarcinoma (OPERA): a phase 3, randomised controlled trial. Lancet Gastroenterol Hepatol 2023; 8(4): 356-67 5 Zlotta AR et al.: Radical cystectomy versus trimodality therapy for muscle-invasive bladder cancer: a multi-institutional propensity score matched and weighted analysis. Lancet Oncol 2023; 24(6): 669-81 6 Van As N et al.: 5-year outcomes from PACE B: an international phase III randomized controlled trial comparing stereotactic body radiotherapy (SBRT) vs. conventionally fractionated or moderately hypo fractionated external beam radiotherapy for localized prostate cancer. Int J Radiat Oncol Biol Phys 2023; 117(4): e2-3
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...