NSCLC de stade III: rôle de la radiothérapie à l’ère de l’immunothérapie
Auteur:
PD Dr méd. Tobias Finazzi
Kaderarzt Radioonkologie
Leiter Zentrum für Lungentumore
Universitätsspital Basel
E-mail: tobias.finazzi@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
La radiothérapie est une pierre angulaire du traitement du cancer du poumon non à petites cellules (NSCLC) de stade III. Les nouveaux développements sont marqués de manière déterminante par l’introduction de l’immunothérapie dans le cadre du traitement multimodal.
Keypoints
-
La chimioradiothérapie suivie d’un traitement d’entretien par le durvalumab est le traitement de référence actuel en cas de NSCLC non résécable de stade III.
-
De nouvelles approches combinant la radiothérapie et l’immunothérapie sont en cours d’évaluation dans le cadre d’études cliniques.
-
En cas de NSCLC de stade III, la radiothérapie sera à l’avenir encore plus individuelle, mais la collaboration interdisciplinaire reste déterminante.
Le cancer du poumon non à petites cellules («non-small cell lung cancer», NSCLC) de stade III comprend un groupe hétérogène de patient·es dont le traitement optimal fait l’objet d’une recherche clinique continue. Alors que la prise en charge thérapeutique n’avait guère évolué pendant de nombreuses années, l’introduction des inhibiteurs de point de contrôle immunitaire (ICI) en particulier a permis de réaliser des progrès thérapeutiques très attendus. Dans le contexte de ces développements, la discussion sur le rôle de la radiothérapie dans le NSCLC de stade III a également été relancée.
Près de 15 ans se sont écoulés depuis la publication des résultats de l’étude nord-américaine Intergroup-0139 et de l’étude européenne EORTC-08941. Complétées depuis par l’étude germano-néerlandaise ESPATUE, ces études de phase III ont démontré en résumé qu’une chimioradiothérapie combinée pouvait être considérée comme équivalente à une approche avec résection après chimio(radio)thérapie en termes de survie.1–3 L’étude SAKK-16/00 a en outre révélé qu’une chimioradiothérapie néoadjuvante n’améliorait pas les résultats thérapeutiques par rapport à une chimiothérapie seule avant résection, de sorte qu’un traitement trimodal planifié est désormais uniquement recommandé dans des cas exceptionnels (p.ex. pour les tumeurs de Pancoast).4
Actuellement, on distingue en premier lieu les approches avec traitement systémique néoadjuvant (le cas échéant, périopératoire) avant résection et la chimioradiothérapie combinée définitive. La stratégie thérapeutique est définie individuellement et de manière interdisciplinaire, bien que la pratique et l’expertise locales puissent tout à fait différer entre les centres.5,6
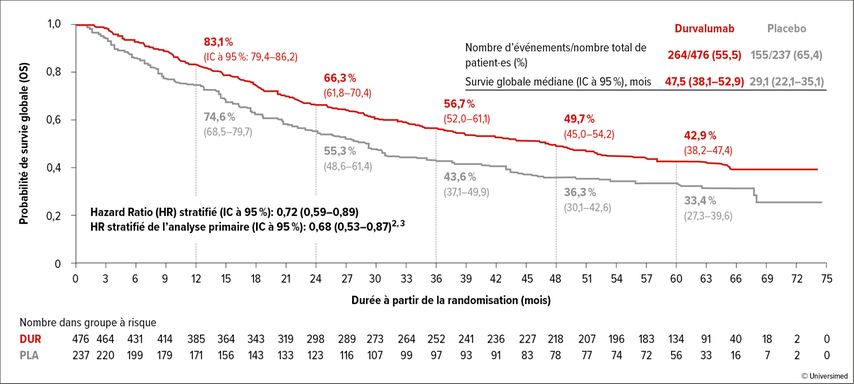
Dans l’étude PACIFIC, les ICI ont fait pour la première fois leur entrée en tant que traitement de référence du NSCLC de stade III.7 Des patient·es atteint·es de NSCLC non résécable de stade III et n’ayant pas connu de progression de la maladie après une chimioradiothérapie combinée définitive ont été randomisé·es entre un traitement de 12 mois par le durvalumab, un anticorps anti-PD-L1, ou un placebo. L’avantage significatif en termes de survie globale et de survie sans progression (PFS) a conduit à une large acceptation de l’immunothérapie de consolidation dans ce contexte. Il convient de noter que l’étude PACIFIC a permis d’obtenir un résultat sans précédent pour les patient·es atteint·es de NSCLC non résécable de stade III, avec une survie à 5 ans de 43% dans le bras expérimental (Fig. 1). Il faut toutefois souligner que les patient·es ont été inclus·es seulement après la fin de la chimioradiothérapie et en l’absence de progression, ce qui implique une certaine sélection des patient·es.
Fig. 1: Taux de survie à 5 ans dans l’étude PACIFIC après chimioradiothérapie et immunothérapie de consolidation combinées (courbe rouge) en cas de NSCLC non résécable de stade III
Les comparaisons numériques entre les essais cliniques, dont les caractéristiques des patient·es sont souvent très différentes, restent donc difficiles. Cela vaut également pour les études de phase III avec chimio-immunothérapie néoadjuvante ou périopératoire, qui ont récemment obtenu d’excellents résultats dans un collectif plus large, y compris à des stades tumoraux plus précoces.8–10 La collaboration interdisciplinaire au sein des «Tumor Boards» reste déterminante, et il faut avant tout tenir compte de la condition d’une résécabilité primaire (et non potentielle) pour les études mentionnées.
Études portant sur les approches alternatives avec immunothérapie
L’introduction de l’immunothérapie a également ouvert la voie à de nouvelles approches thérapeutiques en association avec la radiothérapie. Cela est important car, malgré la recommandation d’une chimioradiothérapie concomitante, une proportion importante de patient·es atteint·es de NSCLC non résécable de stade III reçoivent un traitement différent.11 Des approches alternatives avec immunothérapie sont donc actuellement examinées dans diverses études cliniques.
Dans l’étude japonaise DOLPHIN, 35 patient·es présentant une expression de PD-L1 ≥1% ont reçu un traitement par radiothérapie plus durvalumab (sans chimiothérapie). L’étude a obtenu un résultat très prometteur, avec un taux de PFS à 1 an de 72%.12 Pour les patient·es plus âgées et/ou en moins bonne santé, une approche similaire est actuellement évaluée dans l’étude allemande TRADE-hypo, dans laquelle une radiothérapie hypofractionnée est également examinée en plus de la radiothérapie conventionnelle, afin d’améliorer éventuellement l’interaction avec l’immunothérapie.13 Une immunothérapie de consolidation après une radiothérapie seule peut également être envisagée comme option pour les patient·es qui ne sont pas éligibles pour une chimio(radio)thérapie.14,15
On peut s’attendre à ce que le traitement soit encore plus individuel à l’avenir. L’étude SPRINT a par exemple traité 25 patient·es atteint·es de NSCLC non résécable et présentant une expression de PD-L1 ≥50% par radio-immunothérapie séquentielle individuelle: les patient·es ont reçu trois cycles d’induction par le pembrolizumab, suivis d’une radiothérapie adaptée au risque (basée sur la TEP-TDM) et d’une poursuite du traitement par le pembrolizumab pendant un an au total. Ici aussi, un résultat très prometteur a été obtenu avec un taux de PFS à 1 an de 76% et une faible toxicité.16 D’autres exemples comprennent des approches avec radiothérapie stéréotaxique ainsi que des associations avec de nouvelles substances.17,18
Les questions en suspens font l’objet de recherches actuelles
L’intégration optimale de la radiothérapie et de l’immunothérapie sont toujours des sujets de discussion, tant en ce qui concerne la dose et le fractionnement que le volume cible et le moment opportun de la radiothérapie. La question de savoir si l’immunothérapie doit être administrée en même temps que la chimioradiothérapie définitive en cas de NSCLC de stade III reste en suspens. Plusieurs études de phase III actuelles portent sur ce sujet, le communiqué de presse ayant indiqué que l’ajout de durvalumab dans l’étude PACIFIC-2 n’avait pas permis de prolonger la PFS par rapport au traitement de référence.19 Il reste à attendre les résultats ultérieurs.
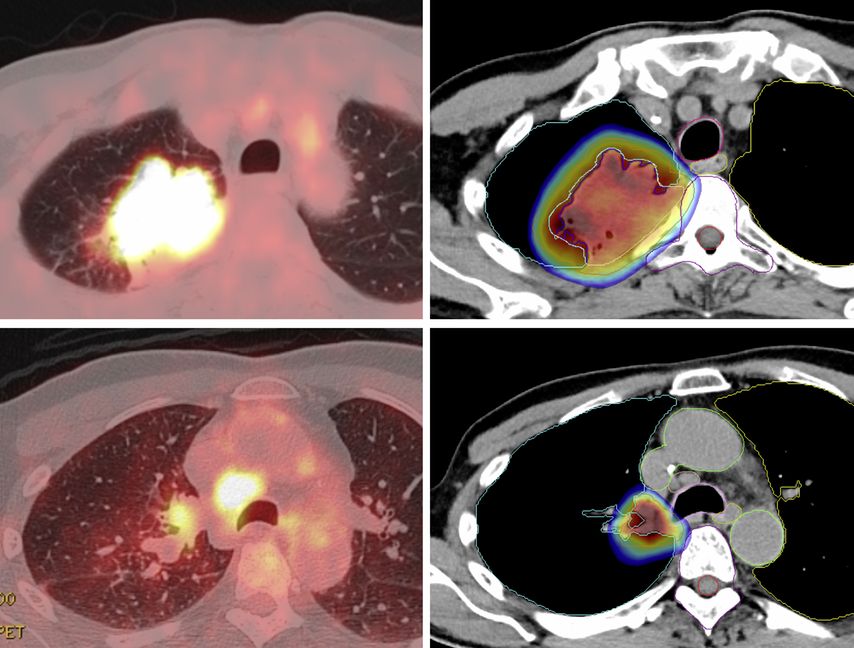
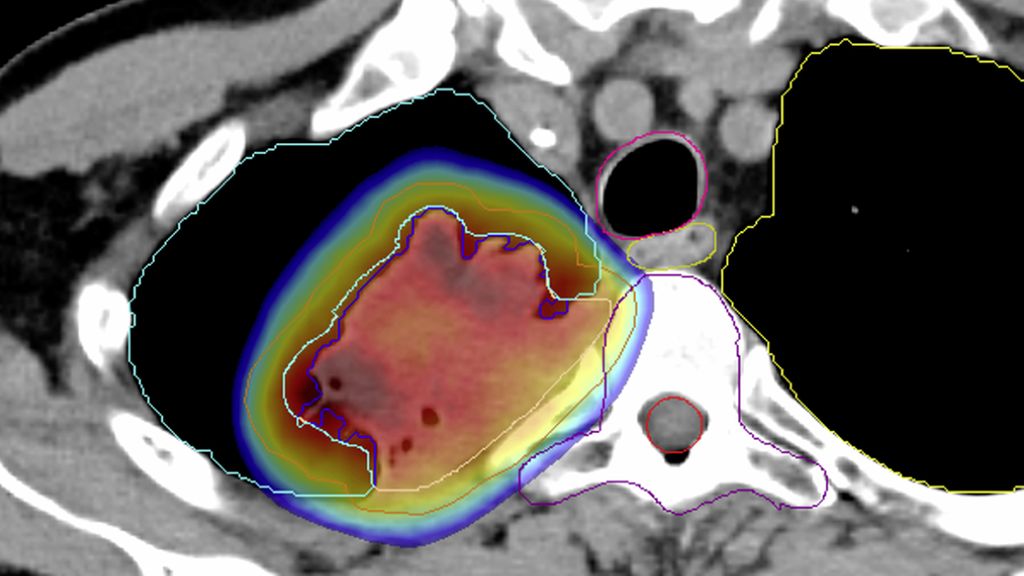
Le rôle de la radiothérapie en périopératoire fait également à nouveau l’objet de recherches à l’ère de l’immunothérapie. Actuellement, l’étude suisse SAKK 16/18 examine si une irradiation de la tumeur primitive peut encore améliorer la PFS après chimio-immunothérapie néoadjuvante en cas de NSCLC résécable de stade IIIA(N2) par rapport à l’étude précédente SAKK 16/14.20 La radiothérapie est effectuée parallèlement à l’immunothérapie néoadjuvante en évitant le médiastin afin de prévenir toute toxicité et tout effet immunosuppresseur (Fig. 2). De plus, il est spécial que trois concepts de radiothérapie différents soient étudiés de manière randomisée afin d’examiner les différences éventuelles de synergie avec l’immunothérapie. Des données intérimaires confirment la sécurité de cette approche, pour laquelle une étude chinoise à petite échelle de forme similaire a récemment pu présenter un taux de rémission pathologique (MPR) très élevé de 76%.21,22
Fig. 2: Radiothérapie immunomodulatrice dans l’étude SAKK 16/18: l’étude vise à déterminer si la radiothérapie peut améliorer l’effet d’une immunothérapie néoadjuvante par le durvalumab. La radiothérapie se concentre sur la tumeur primitive, tout en épargnant les tissus normaux ainsi que les ganglions lymphatiques du médiastin. Figure: TEP-TDM (gauche); plan de radiothérapie (droite), dégradé de couleurs avec dose ≥20 Gy dans le bras B (5x5Gy). Source: Hôpital Universitaire de Bâle (avec l’aimable autorisation du·e la patient·e)
En résumé, le suspense reste entier en ce qui concerne le NSCLC de stade III: les progrès réalisés dans les approches chirurgicales et non chirurgicales apportent des améliorations attendues depuis longtemps par les patient·es, et les traitements vont continuer d’être perfectionné dans les années à venir. Même à l’ère de l’immunothérapie, la radiothérapie reste une pierre angulaire du traitement multimodal, qui devient de plus en plus individuel.
Littérature:
1 Albain KS et al.: Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer: a phase III randomised controlled trial. Lancet 2009; 374(9687): 379-86 2 van Meerbeeck JP et al.: Randomized controlled trial of resection versus radiotherapy after induction chemotherapy in stage IIIA-N2 non-small-cell lung cancer. J Natl Cancer Inst 2007; 99(6): 442-50 3 Eberhardt WEE et al.: Phase III study of surgery versus definitive concurrent chemoradiotherapy boost in patients with resectable stage IIIA(N2) and selected IIIB non-small-cell lung cancer after induction chemotherapy and concurrent chemoradiotherapy (ESPATUE). J Clin Oncol 2015; 33(35): 4194-201 4 Pless M et al.: Induction chemoradiation in stage IIIA/N2 non-small-cell lung cancer: Aphase 3 randomised trial. Lancet 2015; 386(9998): 1049-56 5 Cotarla I et al.: Treatment decision drivers in stage III non–small-cell lung cancer: outcomes of a web-based survey of oncologists in the United States. JCO Oncol Pract 2020; 16(10): e1232-42 6 Evison M et al.: Stage III non-small cell lung cancer: a UK national survey of practice. Clin Oncol 2020; 32(8): 527-36 7 Spigel DR et al.: Five-year survival outcomes from the PACIFIC trial: durvalumab after chemoradiotherapy in stage III non–small-cell lung cancer. J Clin Oncol 2022; 40(12): 1301-11 8 Forde PM et al.: Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med 2022; 386(21): 1973-85 9 Wakelee H et al.: Perioperative pembrolizumab for early-stage non–small-cell lung cancer. N Engl J Med 2023; 389(6): 491-503 10 Heymach JV et al.: Perioperative durvalumab for resectable non–small-cell lung cancer. N Engl J Med 2023; 389: 1672-84 11 Adizie JB et al.: Stage III non-small cell lung cancer management in England. Clin Oncol 2019; 31(10): 688-96 12 Tachihara M et al.: Durvalumab plus concurrent radiotherapy for treatment of locally advanced non–small cell lung cancer: the DOLPHIN phase 2 nonrandomized controlled trial. JAMA Oncol 2023; 9(11): 1505-13 13 Bozorgmehr F et al.: Thoracic radiotherapy plus Durvalumab in elderly and/or frail NSCLC stage III patients unfit for chemotherapy – employing optimized (hypofractionated) radiotherapy to foster durvalumab efficacy: study protocol of the TRADE-hypo trial. BMC Cancer 2020; 20(1): 806 14 Yamada T et al.: Aphase 2 trial of durvalumab treatment following radiation monotherapy in patients with non-small cell lung cancer ineligible for stage III chemoradiotherapy: the SPIRAL-RT study. Eur J Cancer 2023; 195: 113373 15 Filippi ARR et al.: LBA62 Durvalumab after radiotherapy (RT) in patients with unresectable stage III NSCLC ineligible for chemotherapy (CT): primary results from the DUART study. Ann Oncol 2021; 17(34): 4657-63 16 Ohri N et al.: Selective personalized radioimmunotherapy for locally advanced non– small-cell lung cancer trial. J Clin Oncol 2023; 1-9 17 Arcidiacono F et al.: Stereotactic ablative radiotherapy in newly diagnosed and recurrent locally advanced non-small cell lung cancer patients unfit for concurrent radio-chemotherapy: early analysis of the START-NEW-ERA non-randomised phase II trial. Int J Radiat Oncol 2023; 115(4): 886-96 18 Herbst RS et al.: COAST: an open-label, phase II, multidrug platform study of durvalumab alone or in combination with oleclumab or monalizumab in patients with unresectable, stage III non-small-cell lung cancer. JClin Oncol 2022; 40(29): 3383-93 19 AstraZeneca. https://www.astrazeneca.com/media-centre/press-releases/2023/update-on-pacific-2-phase-iii-trial-for-imfinzi.html 20 Rothschild SI et al.: SAKK 16/14: Durvalumab in addition to neoadjuvant chemotherapy in patients with stage IIIA(N2) non–small-cell lung cancer—a multicenter single-arm phase II trial. J Clin Oncol 2021; 39(26): 2872-80 21 Mauti LA et al.: SAKK 16/18: Immune-modulatory radiotherapy to enhance the effects of neoadjuvant PD-L1 blockade after neoadjuvant chemotherapy in patients with resectable stage III (N2) non-small cell lung cancer (NSCLC)—A multicenter phase II trial. J Clin Oncol 2023; 41: 8547 22 Zhao ZR et al.: LBA60 Stereotactic body radiation therapy with sequential immunochemotherapy as neoadjuvant therapy in resectable non-small cell lung cancer. Ann Oncol 2023; 34: S1301
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...