Les inhibiteurs de KIT-D816V comme traitements ciblés dans la MSI?
Compte-rendu:
Torsten U. Banisch, PhD
Le traitement des mastocytoses non avancées, comme la masto-cytose systémique indolente (MSI), se limitait jusqu’à présent à des traitements non ciblés ainsi qu’au traitement et au contrôle des symptômes.1-3 Les premières données cliniques sur l’effet des inhibiteurs spécifiques de KIT-D816V récemment développés montrent pour la première fois le potentiel de traitements ciblés dans la MSI.4–6
Keypoints
-
Les mastocytoses non avancées, y compris la MSI, sont caractérisées cliniquement par des lésions cutanées, une anaphylaxie, des symptômes gastro-entérologiques et une ostéopénie/ostéoporose.
-
Jusqu’à présent, les traitements de la MSI faisaient appel à des options thérapeutiques non spécifiques comme les MSS, les antihistaminiques ou l’omalizumab.
-
Les nouveaux inhibiteurs de KIT-D816V (élénestinib, bézuclastinib, avapritinib) ont une spécificité élevée et ont déjà démontré leur utilité dans des études précliniques.4-6
-
Le traitement par l’avapritinib a permis d’obtenir des améliorations des symptômes de MSI par rapport au placebo et a entraîné une réduction des taux de tryptase sérique, de la charge mastocytaire et de la FAV de KIT-D816V.28
-
Plusieurs études de phaseII évaluant l’efficacité des inhibiteurs de KIT-D816V dans la MSI sont actuellement en cours (PIONEER, SUMMIT, HARBOR).22,28,31
Les mastocytoses sont attribuables à l’accumulation et à l’activation de mastocytes néoplasiques dans la peau, la moelle osseuse ou les organes internes.7–10 Elles sont causées dans 95% des cas par une mutation somatique entraînant un gain de fonction du récepteur tyrosine kinase KIT (KIT D816V).11–13
Cette maladie extrêmement hétérogène peut être divisée en mastocytoses systémiques non avancées et avancées. La catégorie non avancée comprend les mastocytoses cutanées, la mastocytose systémique de la moelle osseuse et la mastocytose systémique indolente (MSI), le sous-type le plus fréquent des mastocytoses systémiques.14–16
Les patient·es atteint·es de MSI présentent souvent tout au long de leur vie des lésions cutanées et des troubles gastro-entérologiques, neurocognitifs, musculo-squelettiques et systémiques, comme l’anaphylaxie, qui est particulièrement fréquente et grave dans les mastocytoses systémiques. Ces symptômes nuisent à la faible qualité de vie, entraînant des restrictions importantes dans la vie quotidienne et professionnelle.13,17,18
La plupart des patient·es atteint·es de MSI reçoivent actuellement un traitement polypharmaceutique conforme aux «meilleurs soins de soutien» (MSS).1–3 Les médicaments utilisés ont cependant souvent des effets secondaires importants, et la majorité des patient·es sont résistant·es/réfractaires aux options de traitement actuelles.19–21
Comme il n’existe actuellement aucun traitement efficace ou autorisé pour les MSI causées par KIT-D816V, il y a un besoin important de nouvelles options thérapeutiques efficaces.
Options thérapeutiques disponibles dans la mastocytose non avancée
Les options thérapeutiques actuelles dans les mastocytoses non avancées se limitent aux MSS pour le traitement des symptômes, notamment les antihistaminiques, l’omalizumab, le cromoglycate sodique et l’immunothérapie allergénique pour le traitement des médiateurs ou les bisphosphonates et le dénosumab pour le traitement de l’ostéopénie/ostéoporose.19–21
Le développement de nouveaux traitements basés sur l’imatinib, un inhibiteur de tyrosine kinase de type II, ou un traitement par anticorps ciblés ont jusqu’à présent échoué en raison de la toxicité des doses.17
Développement de traitement ciblant KIT-D816V
La mutation KIT-D816V sous-jacente concerne le domaine d’activation du récepteur tyrosine kinase KIT et résulte en une protéine constitutivement active. Celle-ci entraîne une surprolifération des mastocytes touchés, leur accumulation dans différents tissus et, finalement, une réponse immunitaire accrue.
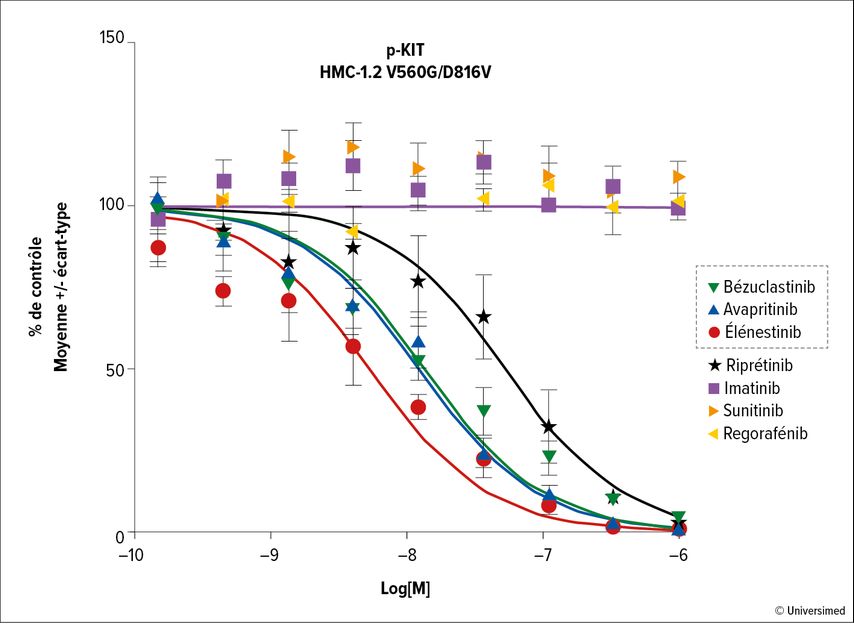
Une nouvelle génération d’inhibiteurs de la tyrosine kinase de type I se lie sélectivement à la conformation active de la kinase, inhibe son autophosphorylation et présente des activités cliniquement pertinentes même à faibles doses (Fig. 1).
Fig.1: Le bézuclastinib, l’avapritinib et l’élénestinib sont de puissants inhibiteurs de KIT D816V dans les mastocytes humains (HMC-1.2). Modifié d’après Guarnieri A et al.4
L’élénestinib (BLU-263), un inhibiteur de KIT, s’est distingué dans les études précliniques par une inhibition robuste de KIT-D816V et par un bon profil de sécurité.4,22 De plus, les analyses ont montré que la pénétration dans le SNC était minimale, ce qui devrait minimiser l’apparition d’effets secondaires.4,23
Le bézuclastinib (CGT9486), un inhibiteur de KIT, a démontré une spécificité élevée pour les mutations de KIT dans les exons 9, 11, 17 et 18 et pour la mutation D816V. Les analyses précliniques montrent une réduction des mutations de l’exon 17 et, ainsi, une diminution de la charge tumorale associée.5 Le bézuclastinib présente également un bénéfice cliniquement pertinent dans le traitement des patient·es atteint·es de mastocytose systémique avancée, avec une réduction des taux de tryptase sérique et une réduction de la charge mastocytaire et de la fréquence allélique de variant (FAV) pour KIT-D816V.24
L’avapritinib (BLU-285), un inhibiteur de KIT, a une forte spécificité pour les mutations du domaine d’activation de KIT et du récepteur alpha du facteur de croissance des plaquettes (PDGFRA).17,25,26 Les premières études sur le traitement des mastocytoses systémiques avancées par l’avapritinib ont déjà pu montrer des effets de modification de la maladie, notamment une réduction de la charge mastocytaire, une normalisation des lésions organiques et, enfin, des améliorations du taux de réponse objective et du taux de survie.27 L’autorisation de l’avapritinib en monothérapie dans le traitement des patient·es adultes atteint·es de mastocytose systémique agressive (MSA), de mastocytose systémique avec néoplasme hématologique associé (MS-NHA) ou de leucémie à mastocytes (LM) après au moins un traitement systémique a été accordée dans l’UE en mars 202223 et en Suisse en juillet 2023.32
ÉtudePIONEER sur l’efficacité de l’inhibiteur de KIT-D816V avapritinib
L’étude de phaseIIPIONEER, randomisée, contrôlée par placebo et en double aveugle, évalue l’effet de l’avapritinib associé aux MSS chez les patient·es atteint·es de MSI par rapport à un placebo + MSS.28
Il s’agit d’une étude en trois parties, la partie1 de l’étude visant à déterminer une dose quotidienne d’avapritinib à utiliser dans les parties 2 et 3 de l’étude. La première analyse a porté sur 39patient·es et a permis d’établir une dose quotidienne recommandée d’avapritinib de 25mg. La deuxième partie de l’étude a consisté en un essai de 24semaines mené auprès de patient·es âgés d’au moins 18ans et présentant des symptômes incontrôlables de MSI avec un score total de symptômes (STS) ≥28, malgré au moins deux schémas de MSS optimisés antérieurs. Les patient·es ont été randomisé·es selon un rapport 2:1 pour recevoir l’avapritinib (n=141) ou un placebo (n=71). Dans la troisième partie de l’étude, en cours, tou·tes les patient·es de la deuxième partie recevront une dose quotidienne de 25mg d’avapritinib pendant une période prévue de cinq ans, les patient·es du groupe placebo de la deuxième partie de l’étude passant également à l’avapritinib.
Le critère d’évaluation principal de l’étude est la variation du STS par rapport au score initial sur une échelle de 0 à 110, les valeurs les plus élevées indiquant des symptômes plus graves. Les données ont été obtenues à l’aide de questionnaire MSI-SAF, un questionnaire en 12points qui permet de documenter quotidiennement la gravité de onze symptômes de MSI sur une échelle de 0 à 10. Les symptômes comprennent les douleurs abdominales, les nausées, la diarrhée, les lésions cutanées, les démangeaisons, les rougeurs, la fatigue, les maux de tête, les vertiges et les douleurs osseuses. Le douzième point est la fréquence des diarrhées.
En outre, les lésions cutanées ont été observées par imagerie à intervalles réguliers et des biopsies cutanées ont été réalisées pour quantifier les infiltrats mastocytaires.
Les principaux critères d’évaluation secondaires étaient le nombre de patient·es présentant une réduction ≥50% des taux de tryptase sérique, le nombre de patient·es présentant une réduction ≥50% de la FAV pour KIT-D816V et, enfin, le nombre de patient·es présentant une réduction ≥50% de la charge mastocytaire, déterminée par une biopsie de moelle osseuse.28
Succès du traitement de la MSI après 24semaines de traitement
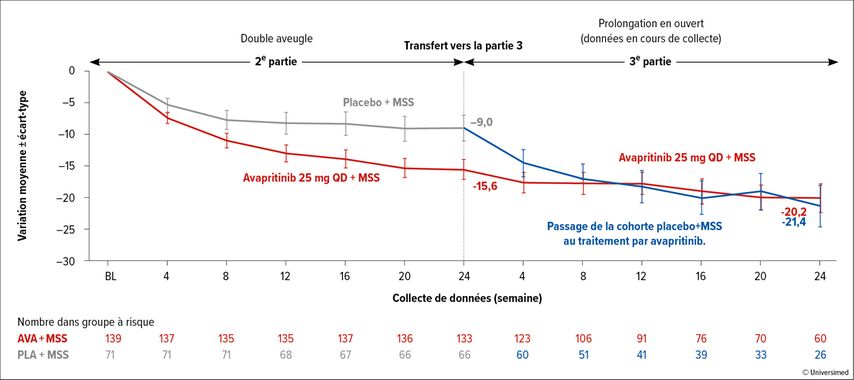
Les critères d’évaluation de la deuxième partie de l’étudePIONEER ont été déterminés après une période d’observation de 24semaines. Une modification significative du STS a été constatée chez les patient·es recevant l’avapritinib, soit -15,6points par rapport au score initial (IC à 95%: -18,6 à -12,6) par rapport à -9,2 points dans le bras témoin (IC à 95%: -13,1 à -5,2; p=0,003; Fig. 2).
Fig. 2: STS-gravité des symptômes de MSI pendant la période de traitement. Modifié d’après Gotlib J et al.28
Pour les critères d’évaluation secondaires définis, une réduction ≥50% des taux de tryptase sérique a été relevée chez 54% des patient·es du bras de traitement, contre 0% dans le bras témoin (p<0,001). Parmi les patient·es ayant reçu l’avapritinib, 68% ont présenté une réduction ≥50% de la fréquence allélique du variant (FAV) KIT-D816V, comparativement à 6% (p<0,001). De plus, 53% des patient·es ayant reçu l’avapritinib ont présenté une réduction ≥50% de la charge mastocytaire dans la moelle osseuse, contre 23% dans le bras témoin (p<0,001).28
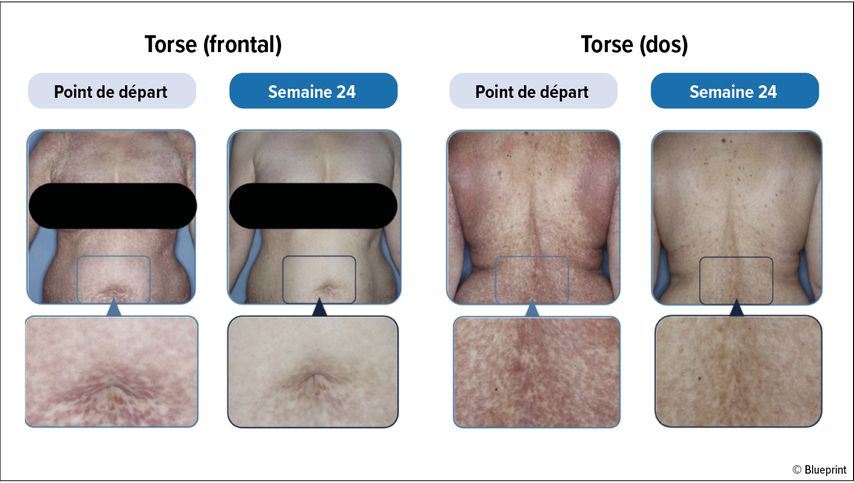
Afin de détecter d’éventuelles modifications des lésions cutanées, les régions cutanées les plus touchées des patient·es volontaires ayant reçu l’avapritinib (n=74) et le placebo (n=37) ont été photographiées au début de l’étude, puis toutes les douze semaines (voir Fig. 3). Les analyses effectuées à l’aide d’un algorithme généré par ordinateur ont notamment révélé une réduction de l’étendue des lésions cutanées de -36,6% avec l’avapritinib comparativement à -1,8% avec le placebo.29
Fig. 3: Amélioration de l’étendue et de la coloration des lésions cutanées après 24semaines de traitement par avapritinib. Modifié d’après Maurer M et al.29
Dans la troisième partie de l’étude PIONEER, les patient·es des groupes avapritinib et témoin ont reçu l’avapritinib. Les premières données montrent que les patient·es traité·es par l’avapritinib présentent une amélioration à long terme du STS.28
Amélioration de la qualité de vie pendant la période de traitement
Les scores à différents questionnaires ont été utilisés pour analyser la qualité de vie pendant la période de traitement: Le questionnaire EQ-VAS («European Quality of Life» – échelle visuelle analogique) a montré une amélioration des scores de 19% pendant la période de traitement, contre 5% dans le bras témoin. Un questionnaire sur la qualité de vie des patient·es atteint·es de mastocytose (MC-QoL) a révélé une réduction de 34% des symptômes avec l’avapritinib, contre 18% avec le placebo. Les questionnaires SF-12 (scores aux échelles physique et mentale) ont également montré des améliorations.28
Des effets secondaires liés au traitement, quelle que soit leur nature, sont survenus chez 54,6% des patient·es du groupe recevant l’avapritinib et chez 45,1% de ceux du groupe témoin. Les effets secondaires les plus fréquents ont été les maux de tête, les nausées, l’œdème et les vertiges.30
L’étudeHARBOR évalue l’efficacité de l’élénestinib, un inhibiteur de KIT-D816V
L’étude de phaseII/IIIHARBOR en cours évalue l’efficacité et la sécurité de l’élénestinib (inhibiteur de KIT) (BLU-263) + MSS chez des patient·es atteint·es de MSI dont les symptômes ne peuvent pas être contrôlés de manière adéquate par les MSS.22 Le critère d’évaluation principal de l’étude est le nombre de patient·es qui obtiennent une réduction ≥30% du STS. Les patient·es seront ensuite traité·es et suivi·es pendant un maximum de cinq ans dans la partie ouverte de l’étude.
Il convient de noter que les premières analyses précliniques montrent que l’élénestinib affiche une pénétration minimale du SNC, avec des valeurs bien inférieures à celles de l’avapritinib, pour une efficacité équivalente.4
ÉtudeSUMMIT sur l’efficacité du bézuclastinib (inhibiteur de KIT-D816V)
L’étude en cours de phaseIISUMMIT, en double aveugle et contrôlée par placebo, évalue l’effet du bézuclastinib (CGT9486), un inhibiteur de KIT, chez des patient·es atteint·es de MSI et de mastocytose systémique de type smouldering (SSM) ayant reçu au moins deux schémas antérieurs de MSS.31 Le critère d’évaluation principal de l’étude est la variation absolue des résultats rapportés par les patient·es (PRO), spécifiques à la maladie. L’étude est suivie d’une analyse d’un an du profil de sécurité du traitement par bézuclastinib.
Perspective
Les premières données positives sur l’effet de l’élénestinib et du bézuclastinib, ainsi que les résultats de l’étude sur l’avapritinib, soulignent l’intérêt des inhibiteurs de KIT-D816V dans le traitement des mastocytoses non avancées, notamment la MSI. Les études présentées ont donc le potentiel de produire pour la première fois des traitements ciblés pour le traitement de la MSI.
Source:
«Non-advanced mastocytosis: clinical manifestation and management», exposé de Pre Dre méd. Karin Hartmann, Macrophage – Histiocyte – Mast Cell – Symposium 2023, 30 juin 2023, Vienne
Littérature:
1 Akin C et al.: J Allergy Clin Immunol 2022; 149: 1912-8 2 Pardanani A: Blood 2013; 121: 3085-94 3 Pardanani A: Am J Hematol 2021; 96: 508-25 4 Guarnieri A et al.: Cancer Res 2022; 82(Suppl. 12): 147 5 Wagner AJ: J Clin Oncol 2018; 36(Suppl. 15): 11509 6 DeAngelo DJ et al.: Nat Med 2021; 27: 2183-91 7 Lim KH et al.: Blood 2009; 113: 5727-36 8 Hermine O et al.: PLoS One 2008; 3: e2266 9 Pardanani A et al.: Blood 2009; 114: 3769-72 10 Akin C et al.: Ann Rev Med 2004; 55: 419-32 11 Garcia-Montero AC et al.: Blood 2006; 108: 2366-72 12 Chatterjee A et al.: Oncotarget 2015; 6: 18250-64 13 Orfao A et al.: Br J Haematol 2007; 138: 12-30 14 Horny HP et al.: WHO Classification of Tumours 2016 15 Hartmann K et al.: WHO Classification of Skin Tumours 2018 16 Sotlar K et al.: J Allergy Clin Immunol Pract 2022; 10(8): 1986-98.e2 17 Evans EK et al.: Sci Transl Med 2017; 9: eaao1690 18 Pardanani A: Am J Hematol 2019; 94: 363-77 19 Mesa RA et al.: Cancer 2022; 128: 3691-9 20 Cardet JC et al.: Expert Opin Pharmacother 2013; 14: 2033-45 21 Reiter A et al.: Blood 2020; 135(16): 1365-76 22 Castells M et al.: Hemasphere 2022; 6(Suppl.): 907-8 23 Information professionnelle d’Ayvakyt®, mise à jour de mars 2023 24 DeAngelo DJ et al.: Congrès de l’EHA 2022; AB P1049 25 Evans E et al.: Blood 2015; 126: 568 26 Evans E et al.: Blood 2014; 124: 3217 27 DeAngelo DJ et al.: Nat Med 2021; 27: 2183-91 28 Gotlib J et al.: N Engl J Med 2023; doi: 10.1056/EVIDoa2200339 29 Maurer M et al.: JAllergy Clin Immunol 2023; 151: AB340, 10.1016/j.jaci.2022.12.795 30 Castells M et al.: J Allergy Clin Immunol 2023; 151: AB204, 10.1016/j.jaci.2022.12.635 31 Siebenhaar OF et al.: Blood 2021; 138(Suppl. 1): 3642 32 Information professionnelle d’Ayvakyt®, www.swissmedic.ch
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...