Succès de l’immunothérapie néoadjuvante dans le cancer du sein précoce
Compte-rendu:
Dre Ine Schmale
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Chaque année, le congrès SABCS (San Antonio Breast Cancer Symposium) clôture l’année scientifique consacrée au cancer du sein. D’importants résultats d’études présentés lors du congrès confirment l’influence positive du traitement néoadjuvant par inhibiteur de point de contrôle dans le cancer du sein précoce, tandis que le traitement adjuvant n’a pas apporté beaucoup de bénéfices. La radiothérapie adjuvante des ganglions lymphatiques peut également être épargnée à certain·es patient·es.
L’analyse des biomarqueurs confirme le statut PD-L1 et sTIL
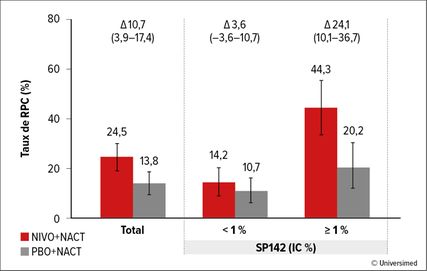
Fig. 1: Rémissions pathologiques complètes (RPC) en fonction du statut PD-L1, mesurées par test IHC SP142 (IC%). Modifié d’après Loi S et al. 20231
L’étude de phaseIIICheckMate 7FL contrôlée par placebo a évalué l’ajout de nivolumab à une chimiothérapie néoadjuvante (4 cycles de paclitaxel + 4 cycles d’anthracycline plus cyclophosphamide) suivie d’un traitement endocrinien postopératoire.1 L’étude portait sur des patient·es atteint·es d’un cancer du sein à récepteurs hormonaux positifs et HER2 négatif (HR+/HER2–) présentant un risque élevé de récidive. L’étude a atteint son critère d’évaluation principal et a montré un taux supérieur de rémissions pathologiques complètes (RPC) avec l’immunothérapie supplémentaire (24,5% versus 13,8%; p=0,0021). Pour les tumeurs PD-L1 positives (test IHC SP142 ≥1%), le taux de RPC était de 44,3% versus 20,2% sans nivolumab (Fig. 1). Une faible charge tumorale résiduelle (RCB 0–1) a été observée plus fréquemment dans le bras expérimental de l’étude, avec une fréquence de 30,7% versus 21,3%. Les résultats d’une analyse exploratoire des biomarqueurs ont été présentés lors du congrès SABCS. En conclusion, une efficacité clinique supérieure a été observée lors de l’administration néoadjuvante de nivolumab en présence d’une expression plus élevée de PD-L1, d’une proportion plus élevée de lymphocytes stromaux infiltrant la tumeur (sTIL) et d’une expression plus faible du récepteur hormonal. L’indice Ki67 n’était pas associé à un bénéfice supérieur avec le nivolumab. La comparaison de la pertinence des biomarqueurs a montré une bonne concordance des dosages de PD-L1-IHC SP142 et 28–8, mais une moins bonne concordance des dosages de PD-L1 avec le taux de sTIL.
Administration parallèle de nivolumab plus chimiothérapie
Le schéma nivolumab plus chimiothérapie néoadjuvante (carboplatine plus paclitaxel) a également été étudié dans l’étude de phaseII BCT1902/IBCSG 61-20 Neo-N, ici dans le cancer du sein triple négatif de stade I/II.2 Des études antérieures sur les immunothérapies néoadjuvantes ayant indiqué de meilleurs résultats thérapeutiques avec une administration initiale décalée dans le temps, le début décalé du traitement par immunothérapie et chimiothérapie a été comparé à l’administration simultanée. Quelque 108 patient·es ont été traité·es, dont environ 54% étaient en phase préménopausique. Chez un tiers des participantes à l’étude, le taux de TIL était ≥30% et près de la moitié présentait une expression de PD-L1 ≥1%. Deux tiers des patient·es présentaient une tumeur de stade II. Au total, 53% des patient·es ont obtenu une RPC, que le début du traitement soit différé ou simultané. Le pourcentage de CPC était de 49% chez les participant·es présentant une maladie de stade I et de 55% en présence d’une maladie de stade II. Avec une expression de PD-L1 ≥1%, une RPC a été observée chez 71% des patient·es, avec une expression <1% chez 33% des patient·es. Lorsque la proportion de TIL était élevée, le taux de RPC était de 67%, versus 46% lorsque la proportion de TIL était faible. Aucun nouveau signal de sécurité n’a été relevé, le traitement a été globalement bien toléré. Les auteurs·rices ont conclu qu’avec un taux de RPC >50%, les résultats étayaient un traitement néoadjuvant par nivolumab d’une durée de 12 semaines plus chimiothérapie dans le traitement du cancer du sein triple négatif de stade I/II.
Bénéfices de l’immunothérapie pour les sous-groupes
Le traitement néoadjuvant par pembrolizumab plus chimiothérapie suivi d’un traitement adjuvant par pembrolizumab plus endocrinothérapie dans le cancer du sein HR+/HER2– à haut risque a été évalué dans l’étude de phaseIII randomisée et contrôlée par placebo KEYNOTE-756.3 Il a été démontré que l’administration supplémentaire de pembrolizumab pouvait augmenter significativement le taux de RPC, et ce, indépendamment de l’expression de PD-L1. Dans le cadre du congrès SABCS, les taux de RPC ont été présentés en référence à certains sous-groupes. Au final, tous les sous-groupes ont bénéficié du pembrolizumab. Le taux de RPC était le plus élevé (57,6% versus 33,3%) chez les patient·es présentant un statut PD-L1 positif (score combiné positif CPS ≥1) et une faible expression du récepteur des œstrogènes (<10%). Avec CPS pour l’expression de PD-L1 ≥1 et une expression du récepteur des œstrogènes ≥10%, le taux de RPC était de 27,6% versus 18,4%. Chez les patient·es présentant une faible expression de PD-L1 (CPS <1), l’augmentation du bénéfice n’était que de 4,6% avec l’administration supplémentaire de pembrolizumab (7,2% versus 2,7%). Dans l’ensemble, plus l’expression de PD-L1 était élevée, plus le bénéfice de l’administration de pembrolizumab était important. Les patient·es présentant une atteinte des ganglions lymphatiques ont davantage bénéficié du pembrolizumab (25,2% versus 15,8%) que ceux·celles n’ayant pas d’atteinte ganglionnaire (16,9% versus 13,1%). Lorsque la chimiothérapie a été administrée comme prévu (10 à 12 doses de paclitaxel, 4 doses de doxorubicine/cyclophosphamide ou d’épirubicine/cyclophosphamide), 26,2% des patient·es du groupe pembrolizumab ont obtenu une RPC versus 16,9% dans le groupe placebo, et 13,2% versus 6,4% en cas de chimiothérapie incomplète. Un plus grand nombre de patient·es du groupe pembrolizumab ont obtenu une RCB de 0–1 après l’intervention chirurgicale (35,0% versus 23,6%). Aucun nouveau signal de sécurité n’a été observé.
Immunothérapie adjuvante sans bénéfice supplémentaire
Aucun bénéfice n’a été observé avec l’ajout d’atézolizumab à une chimiothérapie adjuvante (12semaines de paclitaxel + 4doses de doxorubicine/cyclophosphamide ou d’épirubicine/cyclophosphamide) dans le cancer du sein triple négatif.4 Les résultats de l’étude de phaseIII ALEXANDRA/IMpassion030 confirment notamment que l’utilisation adjuvante d’une immunothérapie par inhibiteurs de points de contrôle n’est probablement pas le bon moment dans la séquence thérapeutique. L’étude portait sur 2199patient·es atteint·es d’un cancer du sein triple négatif de stade II-III, dont plus de la moitié présentaient une atteinte ganglionnaire. Près de la moitié des patient·es (48%) ont subi une chirurgie conservatrice et 52%, une mastectomie. Quelque 29% des patient·es avaient un statut PD-L1 négatif. Il s’est produit des événements liés au critère d’évaluation principal chez 11,5% versus 10,2% des patient·es (survie sans maladie invasive, iDFS) (HR: 1,12; IC à 95%: 0,87–1,45; p=0,37). Dans la population PD-L1 positive, un événement d’iDFS a été observé chez 9,8% versus 9,3% des patient·es (HR: 1,03; IC à 95%: 0,75–1,42). La survie globale (OS) était comparable, avec des événements chez 5,5% versus 4,5% des patient·es dans le groupe atézolizumab versus placebo (HR: 1,20; IC à 95%: 0,82–1,75). Les résultats concernant la sécurité étaient conformes aux données connues et aucune interférence avec l’administration de la chimiothérapie n’a été observée avec l’atézolizumab.
Traitement adjuvant par un inhibiteur de CDK4/6
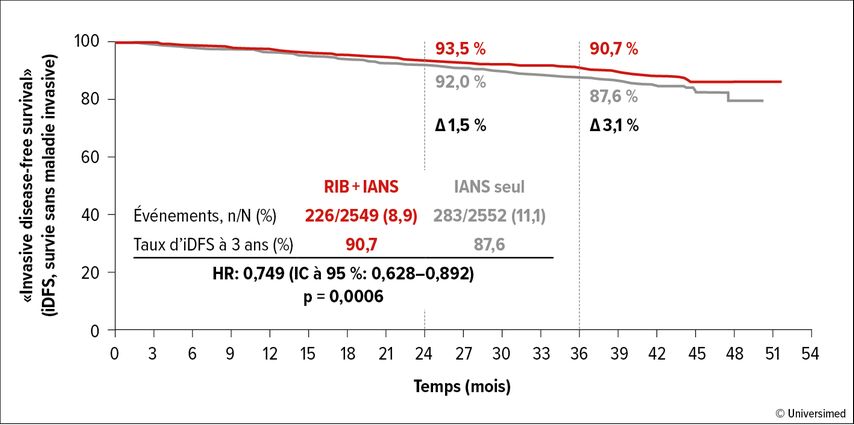
Le traitement de première ligne par un inhibiteur de CDK4/6 plus un inhibiteur de l’aromatase (IA) est une norme de traitement dans le cancer du sein HR+/HER2–. L’étude de phaseIIINATALEE évaluait l’association de ribociclib et de létrozole ou d’anastrozole dans le traitement adjuvant.5 Les patient·es inclus·es étaient atteint·es d’un cancer du sein précoce de stade IIA, IIB ou III. Une endocrinothérapie antérieure d’une durée maximum de 12 mois était autorisée, tout comme une chimiothérapie (néo)adjuvante. Le critère d’évaluation principal était l’iDFS selon les critères STEEP. Au total, 5101 patient·es ont été inclus·es dans l’étude, dont 2549 ont été affecté·es aléatoirement au groupe recevant 3ans de ribociclib plus ≥5ans d’IA et 2552 patient·es, au groupe recevant l’IA pendant ≥5ans. Au moment de l’évaluation, avec un suivi médian de 33,3 mois, 75,1% versus 68,5% des patient·es continuaient de recevoir l’IA. Au total, 78,3% des patient·es ont arrêté le ribociclib, 42,8% en raison de l’atteinte des trois années de traitement et 19,5%, en raison d’effets secondaires. L’étudeNATALEE a confirmé une différence significative en faveur du ribociclib dans l’analyse finale de l’iDFS, avec un taux à 3ans de 90,7% versus 87,6% (HR: 0,749; IC à 95%: 0,625–0,892; p=0,0006; Fig. 2). Un bénéfice comparable de l’administration de ribociclib a été observé pour tous les sous-groupes pertinents. Les données relatives à l’OS n’ont pas encore démontré de différence entre les médicaments de l’étude, avec un suivi médian de 35,9mois et <4% d’événements dans les deux groupes de l’étude (HR: 0,892; IC à 95%: 0,661–1,203). Le profil de sécurité correspondait à celui des évaluations précédentes, les effets secondaires hépatiques étant la raison la plus fréquente de l’arrêt du traitement par ribociclib.
Fig. 2: Évaluation finale de la survie sans maladie invasive (iDFS) dans l’essai NATALEE. Modifié d’après Hortobagyi G et al. 20235
Radiothérapie adjuvante adaptée
L’irradiation adjuvante des ganglions lymphatiques régionaux est également associée à un bénéfice clinique chez les patient·es présentant une atteinte ganglionnaireaxillaire. L’étude de phaseIIINRGOncology/NSABPB-51/RTOG1304 a été lancée pour étudier l’effet de la radiothérapie sur le risque de récidive chez les patient·es présentant ou non (ypN0) une atteinte ganglionnaire après un traitement néoadjuvant, et les résultats ont été présentés lors du congrès SABCS après un suivi médian de 59,5 mois.6 L’étude portait sur 1641patient·es atteint·es d’un cancer du sein de stade T1-3 N1 M0 et ayant reçu une chimiothérapie néoadjuvante pendant ≥8semaines, ainsi qu’un traitement ciblant HER2 en cas de maladie HER2+. Dans cette étude randomisée, les patient·es ont reçu ou non une irradiation régionale des ganglions lymphatiques, stratifiée en fonction du type d’intervention chirurgicale (mastectomie ou tumorectomie), du statut des récepteurs hormonaux, du statut HER2, de la chimiothérapie adjuvante et du statut de RPC. En cas de résection conservatrice du sein, le sein a été irradié dans les deux groupes de l’étude; en cas de mastectomie, la paroi thoracique a été irradiée uniquement dans le groupe de l’étude avec irradiation des ganglions lymphatiques. Le critère d’évaluation principal était le délai entre la randomisation et la récidive locale, régionale ou à distance invasive de la maladie ou le décès lié à la maladie (IBCRFI). Les critères d’évaluation secondaires étaient la récidive locorégionale sans métastases à distance dans les deux mois (LRRFI), le délai sans métastases à distance (DRFI), la DFS, l’OS et la sécurité. Les patient·es avaient un âge médian de 52 ans, avec respectivement 21% et 23% de cancer du sein triple négatif, et ont été opéré·es de manière conservatrice dans 58% des cas. Au total, 78-79% des patient·es ont obtenu une RPC après le traitement néoadjuvant. Au final, aucune différence significative n’a été observée entre les critères d’évaluation de l’étude en ce qui concerne le critère d’évaluation principal ou secondaire de l’efficacité. Comme prévu, le profil de sécurité était plus favorable dans le groupe n’ayant pas subi d’irradiation. Chez les patient·es atteint·es d’un cancer du sein précoce avec atteinte ganglionnaire de stade ypN0 après une chimiothérapie néoadjuvante, la radiothérapie adjuvante des ganglions lymphatiques axillaires pourrait être adaptée en fonction du downstaging, ont résumé les auteurs·rices.
Source:
46th Annual San Antonio Breast Cancer Symposium (SABCS), San Antonio, Texas, 5 au 9 décembre 2023
Littérature:
1 Loi S et al.: Biomarker results in high-risk estrogen receptor positive, human epidermal growth factor receptor 2 negative primary breast cancer following neoadjuvant chemotherapy ± nivolumab: an exploratory analysis of CheckMate 7FL. SABCS 2023; Abstr. #GS01-01 2 Loi S et al.: Randomized phase II study of neoadjuvant nivolumab (N) 2 week lead-in followed by 12 weeks of concurrent N+carboplatin plus paclitaxel (CbP) vs concurrent N+CbP in triple negative breast cancer. BCT1902/IBCSG 61-20 Neo-N). SABCS 2023; Abstr. #LB01-03 3 Cardoso F et al.: Phase 3 study of neoadjuvant pembrolizumab or placebo plus chemotherapy, followed by adjuvant pembrolizumab or placebo plus endocrine therapy for early-stage high-risk ER+/HER2- breast cancer: KEYNOTE-756. SABCS 2023; Abstr. #GS01-02 4 Ignatiadis M et al.: Adding atezolizumab to adjuvant chemotherapy for stage II and III triple-negative breast cancer is unlikely to improve efficacy: interim analysis of the ALEXANDRA/IMpassion03 phase 3 trial. SABCS 2023; Abstr. #GS01-03 5 Hortobagyi G et al.: Ribociclib + nonsteroidal aromatase inhibitor as adjuvant treatment in patients with HR+/HER2- early breast cancer: final invasive disease-free survival analysis from the NATALEE trial. SABCS 2023; Abstr. #GS03-03 6 Mamounas E et al.: Loco-regional irradiation in patients with biopsy-proven axillary node involvement at presentation who become pathologically node-negative after neoadjuvant chemotherapy: primary outcomes of NRG oncology/NSABP B-51/RTOG 1304. SABCS 2023; Abstr. #GS02-07
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...