CCR: nouvelles données et questions ensuspens
Auteur·es:
Dre méd. Tabea Ibach-Bilgeri
Prof. Dr méd. Dr phil. Andreas Wicki
PD Dr méd. Ralph Fritsch
Klinik für Medizinische Onkologie und Hämatologie, Universität und Universitätsspital Zürich
Correspondance:
E-Mail: tabea.ibach-bilgeri@usz.ch
La mortalité due au cancer colorectal (CCR) n’a cessé de diminuer en Europe au cours des dernières décennies. Que ce soit dans le cadre d’un traitement à des fins curatives ou de la maladie métastatique, une proportion significative de patient·es présente des profils moléculaires pour lesquels le pronostic peut être amélioré par des thérapies ciblées.
Keypoints
-
Le traitement néoadjuvant total (TNT) est souvent la nouvelle norme thérapeutique à visée curative dans le CRLA.
-
L’ADNtc représente un marqueur très prometteur pour la stratification du risque avant une chimiothérapie adjuvante dans le CCR.
-
Les CCR présentant une instabilité des microsatellites (MSI-h) présentent une excellente réponse à l’immunothérapie néoadjuvante.
-
Les options thérapeutiques dans le CCR métastatique se diversifient de plus en plus avec des traitements ciblés en complément de la chimiothérapie standard, mais une percée avec une survie globale significativement prolongée reste encore à faire.
C’est un fait que les traitements ciblés ont permis d’améliorer le pronostic des personnes atteintes de cancer colorectal (CCR). Toutefois, dans les tumeurs au stade avancé, la base du traitement systémique reste généralement un schéma associant 5-fluorouracile, leucovorine, oxaliplatine et/ou irinotécan, avec un anticorps dirigé contre l’EGFR ou le VEGF. En raison également de la nette amélioration de la survie globale, il est nécessaire de disposer de marqueurs prédictifs fiables sur l’utilité exacte de chaque traitement à différents stades. Cela permet d’éviter le surtraitement potentiellement dommageable à long terme. Cet article offre un aperçu des développements actuels des options thérapeutiques dans le CCR.
Traitement néoadjuvant total du cancer du rectum localement avancé
Le traitement périopératoire du cancer du rectum localement avancé (CRLA) a de plus en plus évolué vers un traitement néoadjuvant total (TNT). Dans ce cas, à la radiochimiothérapie néoadjuvante classique vient s’ajouter une chimiothérapie intensive (préopératoire). Jusqu’à présent, l’objectif primaire d’un traitement néoadjuvant était d’augmenter le taux d’opérations préservant le sphincter et d’obtenir un taux de récidives locales aussi faible que possible. Le TNT doit en outre permettre de minimiser le risque de métastases à distance au cours de l’évolution. Dans certains cas, il est même possible de renoncer à l’intervention chirurgicale. Cette stratégie thérapeutique alternative a déjà été étudiée sous différentes formes dans plusieurs études de grande envergure (RAPIDO1, PRODIGE232 et OPRA3).
Les données à 7ans de l’étude PRODIGE23 ont été publiées en 2023. Les patient·es atteint·es de CRLA ont reçu un traitement néoadjuvant par FOLFIRINOX, suivi d’une radiochimiothérapie. Dans le bras témoin, seule la radiochimiothérapie concomitante a été administrée à titre de traitement néoadjuvant. Une chimiothérapie adjuvante était possible dans les deux bras. Après septans, la survie sans maladie (DFS) était significativement prolongée sur le plan statistique de 67,6% versus 62,5% dans le bras de traitement standard.4 Près de la moitié des patient·es ayant reçu le schéma FOLFIRINOX ont présenté des effets secondaires importants (grade3–4 selon les critères CTCAE), principalement une neutropénie et une diarrhée. Le traitement néoadjuvant par FOLFIRINOX est donc une norme thérapeutique plus agressive que les schémas alternatifs avec FOLFOX, avec des effets secondaires plus marqués. Il est envisagé en premier lieu chez les patient·es en bonne forme physique, présentant une charge tumorale élevée et nécessitant une réponse rapide urgente.
L’étude de phaseIII PROSPECT, en cours, analysait s’il était possible de renoncer à la radiothérapie. Les patient·es atteint·es de CRLA ont reçu un traitement néoadjuvant avec six cycles de FOLFOX ou une radiochimiothérapie concomitante. Seul·es quelques patient·es (9,1%) ont dû être traité·es par radiochimiothérapie en raison d’une mauvaise réponse dans le bras de traitement expérimental. Tous·tes ont ensuite été opéré·es et ont reçu un traitement adjuvant. La survie à 5ans s’est avérée presque identique (89,5% versus 90,2%).5 Jusqu’à présent, il n’y a pas eu significativement de récidives locales sans irradiation locale. Les effets secondaires aigus – principalement une neutropénie et des neuropathies – étaient plus prononcés dans le bras de traitement expérimental (grade3–4: 41% versus 22,8%). La radiochimiothérapie a entraîné plus de cas de diarrhée et, après un an, une diminution de la fonction sexuelle.6
Cette étude a fait l’objet de discussions approfondies au niveau international. D’une part, les lignes directrices européennes ont déjà évolué en ce sens que la chirurgie directe avec chimiothérapie adjuvante est déjà la norme pour les néoplasies proximales précoces (incluses dans cette étude). D’autre part, les concepts développés entre-temps pour le TNT n’ont pas été pris en compte. Dans l’ensemble, l’étude PROSPECT offre une option thérapeutique aux patient·es atteint·es de CRLA qui souhaitent renoncer à la radiothérapie. Il convient toutefois d’en discuter au cas par cas, en particulier parce qu’il existe un risque de surtraitement dans certains groupes de patient·es.
Traitement adjuvant du carcinome colorectal
Le traitement adjuvant du CCR a pour objectif d’augmenter le taux de guérison après la chirurgie. La norme de traitement dans les cancers du côlon de stadeIII est une chimiothérapie adjuvante de trois à six mois.7 Au stadeII, un traitement adjuvant est actuellement indiqué en présence de facteurs de risque supplémentaires. Les cancers du rectum situés dans le tiers supérieur du rectum font l’objet d’un traitement adjuvant, tout comme les cancers du côlon. Il est urgent de trouver des marqueurs prédictifs permettant de différencier les patient·es qui bénéficient réellement d’une chimiothérapie adjuvante.
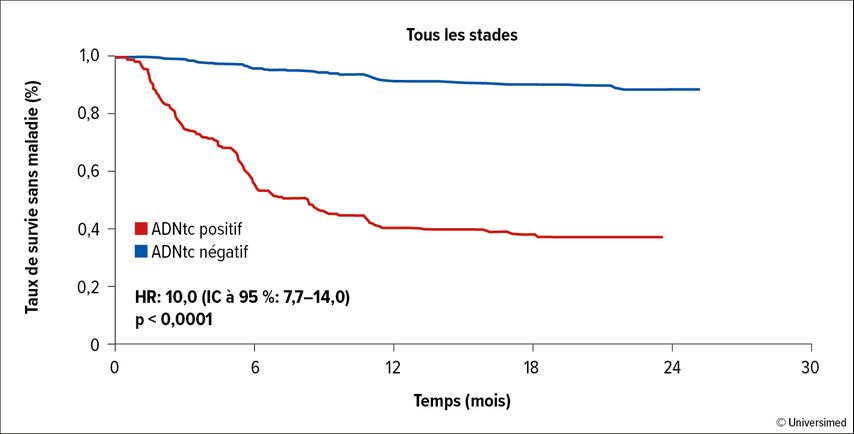
L’étude de phaseII GALAXY a analysé le lien entre la maladie résiduelle minimale (MRM) mesurable dans le sang après l’intervention chirurgicale sous forme «d’ADN tumoral circulant» (ADNtc), l’évolution de l’ADNc et la survie sans progression (PFS) dans les CCR de stade II-IV après résection complète. L’étude a porté sur des patient·es ayant reçu un traitement néoadjuvant (11%) et un traitement adjuvant (39%). Après la résection chirurgicale, des contrôles réguliers de l’ADNtc dans le sang périphérique ont été effectués pendant trois mois selon la détermination de la MRM. Dans l’ensemble de la cohorte, la négativité de l’ADNtc s’est révélée être un marqueur pronostique statistiquement significatif d’une PFS prolongée à deux ans (ADNtc négatif 89%, ADNtc positif 34%, Fig. 1).7
Fig. 1: Négativité de l’ADNtc comme marqueur pronostique statistiquement significatif d’une PFS prolongée dans le CCR de stadeII–IV, deux ans après une résection complète. Modifié d’après Kotani D et al.7
De plus, l’évolution de l’ADNtc était importante sur le plan pronostique. Chez les patient·es de stadeII-III sans ADNtc dans le sang, la chimiothérapie adjuvante n’a apporté aucun avantage en termes de PFS à deux ans. En revanche, chez les patient·es ADNtc positifs·ves, le taux de récidive était nettement supérieur, mais ces patient·es ont significativement bénéficié de la chimiothérapie adjuvante. L’ADNtc peut donc être utilisé dans le cadre d’un traitement adjuvant, à la fois comme marqueur pronostique et comme aide à la décision prédictive par rapport à la chimiothérapie adjuvante.
Deux études japonaises de phaseIII (ALTAIR, VEGA) en cours évaluent un traitement adjuvant dépendant de l’ADNtc. Ces résultats, combinés à d’autres études en cours, pourraient conduire à une large utilisation de l’ADNtc dans le traitement à visée curative du CCR.
Traitement néoadjuvant dans le cancer du côlon
Le traitement néoadjuvant n’est pas une norme de traitement généralisée dans le cancer du côlon localisé. Jusqu’à 15% des cancers du côlon localisés présentent un déficit de réparation par mésappariement (dMMR). Dans le cas de ces cancers, la série d’étudesNICHE a démontré qu’une immunothérapie néoadjuvante entraînait d’excellents résultats.8 Les études NICHE et NICHE-2 ont déjà montré que l’administration combinée de nivolumab (anticorpsanti-PD1), et d’ipilimumab (anticorpsanti-CTLA4) entraînait une réponse pathologique majeure dans 95% des cas.9,10
Dans l’étude de phaseII NICHE-3, 19patient·es présentant un cancer du côlon localement avancé et un dMMR ont reçu un traitement néoadjuvant composé de deux cycles de nivolumab et de rélatlimab (anticorps anti-LAG3). Cette association avait déjà été évaluée dans le mélanome malin avec une très bonne réponse et une faible toxicité.11 L’ensemble des patient·es ont obtenu une réponse pathologique, dont 79%, une rémission pathologique complète.10 Le profil d’effets secondaires était caractéristique des immunothérapies, et aucun retard n’a été observé dans les interventions chirurgicales planifiées.
En résumé, bien que le nombre de cas dans ces études ait été faible jusqu’à présent, les résultats montrent une excellente réponse à l’immunothérapie néoadjuvante et celle-ci devrait donc être prise en compte dès maintenant chez ces patient·es. La question reste toutefois ouverte de savoir si les patient·es atteint·es d’un cancer du côlon et présentant une réponse clinique complète après une immunothérapie néoadjuvante doivent obligatoirement être opérés ou si l’on pourrait adopter une approche «watch and wait» (observer et attendre), à l’instar des développements dans le CRLA.
Traitement palliatif du CCR métastatique
Dans le cas des tumeurs disséminées pour lesquelles il n’existe pas d’option curative, on renonce à une intervention chirurgicale chez les patient·es asymptomatiques. En première ligne, en fonction de l’état général et des marqueurs moléculaires, une chimiothérapie est choisie, parfois en association avec un anticorps. En cas de progression lors du traitement de deuxième ligne, la chimiothérapie et les anticorps peuvent tous deux être modifiés. Pour la troisième ligne, les résultats de trois études ont été publiés en 2023, présentant des alternatives aux traitements oraux établis par trifluridine/tipiracil (FTD/TPI), régorafénib ou panitumumab (anticorps anti-EGFR) en présence de RAS de type sauvage.
Dans l’étude SUNLIGHT, les patient·es ont reçu FTD/TPI en monothérapie dans le bras de traitement standard ou une association de FTD/TPI et de bévacizumab (anticorps anti-VEGF) dans le bras de traitement expérimental. Des patient·es ayant déjà reçu le bévacizumab ont également été inclus·es dans l’étude. Une survie globale significativement plus longue (mOS: 10,8 vs 7,5mois) a été observée dans le bras de traitement expérimental.12 Les effets secondaires coïncidaient avec les profils de sécurité connus du FTD/TPI et du bévacizumab (principalement neutropénie, nausées et hypertension). Le traitement d’association est donc une nouvelle norme thérapeutique à partir de la troisième ligne dans le CCR métastatique.
Environ 3% de tous les cas de CCR présentent une mutation KRASG12C, qui est associée à un moins bon pronostic.13 Les études menées sur le sotorasib (inhibiteur de la protéine KRASG12C) en monothérapie dans le cancer du côlon fortement prétraité ont montré peu d’activité antitumorale. L’association avec des anticorps anti-EGFR semble prometteuse, car la désactivation supplémentaire d’EGFR devrait renforcer l’inhibition de la voie de signalisation KRAS et empêcher l’apparition de résistances.
L’étude de phaseIII CodeBreak300 a permis de montrer que l’association de 960mg de sotorasib et du panitumumab (anticorps anti-EGFR) entraîne une survie sans progression plus longue qu’avec le FTD/TPI ou le régorafénib dans les tumeurs présentant une mutation KRASG12C.14 Les données sur la survie globale sont encore attendues. Aucun nouvel effet secondaire inattendu n’a été constaté. Il s’agit actuellement d’une option thérapeutique alternative pour les patient·es chez qui la chimiothérapie n’est plus possible.
Il convient toutefois de préciser que depuis l’étude SUNLIGHT susmentionnée, le bras témoin n’est plus utilisé comme norme de traitement en troisième ligne. De plus, divers autres inhibiteurs de la protéine KRASG12C sont en cours d’évaluation, notamment l’adagrasib, un deuxième inhibiteur de la protéine KRASG12C, en association avec le cétuximab (anticorps anti-EGFR), dans le cadre d’une étude de phaseIII (KRYSTAL-10).
Environ 2% de tous les cancers du côlon sont associés à une amplification de HER2, bien que cela ne joue actuellement aucun rôle dans le choix du traitement de première et de deuxième ligne.15 Un traitement ciblant HER2 avec l’anticorps trastuzumab a cependant montré un effet antitumoral dans d’autres lignes.16
Une alternative déjà utilisée avec beaucoup de succès dans le cancer du sein est le conjugué anticorps-médicament trastuzumab-déruxtécan (T-Dxd). Dans ce cas, le trastuzumab a été lié au déruxtécan, un inhibiteur de la topo-isoméraseI. Celui-ci est activé dès que la molécule s’est liée à HER2 et a pénétré dans la cellule tumorale. Cependant, des études antérieures ont montré des effets secondaires prononcés, notamment la pneumopathie interstitielle.17
Toutefois, l’étude en coursDESTINYCRC02 a montré qu’une dose réduite de 5,4mg/kg entraînait moins d’effets secondaires graves avec une réponse à peine réduite (ORR: 37%; mPFS: 5,5mois).18 Dans cette étude de phaseII, deux aspects méritent une attention particulière. En effet, les patient·es inclus·es avaient déjà reçu des traitements ciblant HER2 dans des lignes de traitement précédentes: Le T-Dxd peut donc être utilisé, par exemple, après le trastuzumab/lapatinib. Qui plus est, des patient·es présentant des mutations du gène KRAS ont été inclus·es. Dans les directives actuelles de l’European Society for Medical Oncology (ESMO), les traitements ciblant HER2 ne sont recommandés que pour les patient·es présentant un gène RAS de type sauvage, sur la base des études réalisées jusqu’à présent.19 Cela pourrait changer en fonction des données désormais disponibles de l’étudeDESTINYCRC02.
Littérature:
1 Bahadoer RR et al.: Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22(1): 29-42 2 Conroy T et al.: Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22(5): 702-715 3 Garcia-Aguilar J et al.: Organ preservation in patients with rectal adenocarcinoma treated with total neoadjuvant therapy. J Clin Oncol 2022; 40(23): 2546-56 4 Conroy T et al.: Total neoadjuvant therapy with mFOLFIRINOX versus preoperative chemoradiation in patients with locally advanced rectal cancer: 7-year results of PRODIGE 23 phase III trial, a UNICANCER GI trial. J Clin Oncol 2023, 41(17_suppl): LBA3504 5 Schrag D et al.: Preoperative treatment of locally advanced rectal cancer. NEngl J Med 2023; 389(4): 322-34 6 Basch E et al.: Patient-reported outcomes during and after treatment for locally advanced rectal cancer in the PROSPECT trial (Alliance N1048). J Clin Oncol 2023; 41(21): 3724-34 7 Kotani D et al.: Molecular residual disease and efficacy of adjuvant chemotherapy in patients with colorectal cancer. Nat Med 2023; 29(1): 127-134 8 Goel A, Boland CR: Epigenetics of colorectal cancer. Gastroenterology 2012; 143(6): 1442-60 9 Chalabi M et al.: Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers. Nat Med 2020; 26(4): 566-76 10 Verschoor YL et al.: LBA31. Neoadjuvant nivolumab plus relatlimab (anti-LAG3) in locally advanced MMR-deficient colon cancers: the NICHE-3 study. Ann Oncol 2023; 34: S1270 11 Amaria RN et al.: Neoadjuvant relatlimab and nivolumab in resectable melanoma. Nature 2022; 611(7934): 155-60 12 Prager GW et al.: Trifluridine-tipiracil and bevacizumab in refractory metastatic colorectal cancer. N Engl J Med 2023; 388(18): 1657-67 13 Chida K et al.: The prognostic impact of KRAS G12C mutation in patients with metastatic colorectal cancer: amulticenter retrospective observational study. Oncologist 2021; 26(10): 845-53 14 Fakih MG et al.: Sotorasib plus panitumumab in refractory colorectal cancer with mutated KRAS G12C. N Engl J Med 2023; 389(23): 2125-39 15 Djaballah SA et al.: HER2 in colorectal cancer: the long and winding road from negative predictive factor to positive actionable target. Am Soc Clin Oncol Educ Book 2022; (42): 219-32 16 Sartore-Bianchi A et al.: Dual-targeted therapy with trastuzumab and lapatinib in treatment-refractory, KRAS codon 12/13 wild-type, HER2-positive metastatic colorectal cancer (HERACLES): a proof-of-concept, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17(6): 738-46 17 Yoshino T et al.: Final results of DESTINY-CRC01 investigating trastuzumab deruxtecan in patients with HER2-expressing metastatic colorectal cancer. Nat Commun 2023; 14(1): 3332 18 Raghav KPS et al.: Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2- overexpressing/amplified (HER2+) metastatic colorectal cancer (mCRC): Primary results from the multicenter, randomized, phase 2 DESTINY-CRC02 study. J Clin Oncol 2023, 41(16_suppl): 3501 19 Cervantes A et al.: Metastatic colorectal cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(1): 10-32
Das könnte Sie auch interessieren:
Cancer de l’endomètre métastatique, avancé et récidivant
L’association d’inhibiteurs de point de contrôle et de chimiothérapie peut être considérée comme une nouvelle norme thérapeutique dans les cancers de l’endomètre avec déficit de ...
Parfois, il suffit d’attendre
Compte tenu de la multitude d’options thérapeutiques ciblées et immunothérapeutiques désormais disponibles, la prise en charge du carcinome à cellules rénales en situation adjuvante et ...
Les néoplasies myélodysplasiques: stratégies thérapeutiques personnalisées
Les progrès réalisés dans la compréhension moléculaire des néoplasies myélodysplasiques (MDS, myelodysplastic syndrome) ont permis de mettre au point des approches thérapeutiques ...