Auf der Suche nach Frühdiagnosekriterien und krankheitsmodifizierenden Therapien für Parkinson
Bericht:
Dipl.-Ing. Dr. Manuel Spalt-Zoidl
Die Früherkennung und Behandlung der Parkinsonkrankheit (PD) standen im Fokus der diesjährigen International Conference on Alzheimer’s and Parkinson’s Diseases and Related Neurological Disorders (AD/PD) in Wien. Führende Expert:innen präsentierten die neuesten Erkenntnisse über Biomarker in präsymptomatischen Erkrankungsstadien und potenzielle Behandlungsmöglichkeiten.
Keypoints
-
Der Nachweis von Hyposmie und Störungen im REM-Schlaf, kombiniert mit α-Synuklein-Nachweis und bildgebender Messung der Dopamintransporterdichte, zeigte gute Ergebnisse in der Diagnose von Frühstadien.
-
Durch Kombination von Biomarkern und klinischer Diagnostik ist bei Parkinson auch eine innovative Stadieneinteilung möglich, die zur Abschätzung des Krankheitsverlaufs dienlich ist.
-
Die PADOVA-Studie mit Prasinezumab zeigte positive Signale, verfehlte aber den primären Endpunkt. Womöglich sind längere Studiendauern nötig.
Die Parkinsonkrankheit früh genug zu erkennen – bevor sie die Patient:innen in ihrem Leben einschränkt –, ist eine der großen Herausforderungen für die Forschung. Schließlich ist das die Voraussetzung dafür, dass in Zukunft krankheitsmodifizierende Therapien durchgeführt werden können. Es hat sich zwar noch kein Wirkstoff durchgesetzt, doch es wird viel Hoffnung in die Anti-α-Synuklein-Präparate gesetzt.
Die Diagnose der PD scheint aufgrund der offensichtlichen Symptome zunächst einfach zu sein, eröffnete Prof. Dr. Werner Poewe, Universitätsklinik Innsbruck, seine Präsentation.
Neurologische Bildgebung für die Früherkennung der PD
Eine retrospektive Analyse von Post-mortem-Befunden zeigt jedoch, dass die Genauigkeit der Diagnose von Expert:innen und Kliniker:innen 90% nicht wesentlich überschreitet.1 Außerdem ist es gegenwärtig unmöglich, prodromale sowie präklinische Patient:innen und Risikopatient:innen systematisch zu erfassen. Um das zu ändern, schlagen kürzlich veröffentlichte Diagnosekriterien vor, Biomarker in die Diagnostik zu inkludieren. Diese umfassen Marker der α-Synuklein-Pathologie, die Auswertung genetischer Varianten, die für die Entwicklung von PD verantwortlich gemacht werden, und den bildgebenden Nachweis der dopaminergen Denervierung.2,3
Tatsächlich konnte in einer Studie mit 96 Proband:innen, welche Hyposmie, REM-Schlaf-Verhaltensstörungen (RBD) und ein Dopamintransporterdefizit hatten, bei 56% ein positiver α-Synuklein-Nachweis im „seed amplification assay“ (SAA) erbracht werden. Bei 39% wurde im weiteren Verlauf eine PD diagnostiziert.4
Für den bildgebenden Nachweis des dopaminergen Abbaus in frühen Stadien hat die Dopamintransporter-Single-Photon-Emissions-Computertomografie (DAT-SPECT) einen hohen Stellenwert, so Poewe. In einer Studie von Arnaldi et al. wurden 173 Personen mit RBD, die im Verlauf der Studie PD entwickelten („converters“), 232 Personen mit RBD, die im Verlauf der Studie keine PD entwickelten („non-converters“) und 160 gesunde Proband:innen einer regelmäßigen DAT-SPECT-Untersuchung unterzogen. Bei der Differenzierung zwischen „converters“ und „non-converters“ erreichte die Bildgebung eine Sensitivität von 77% und eine Spezifität von 85% .5 Die noradrenerge Denervierung ist ein weiterer bildgebender Biomarker der PD. Diese kann mittels kardialer Metaiodobenzylguanidin-SPECT (MIBG-SPECT) oder 18F-Dopamin-PET nachgewiesen werden. So zeigten Goldstein et al., dass 8 von 9 Proband:innen mit mehr als drei Risikofaktoren einer Demenz mit Lewy-Körperchen (LBD) und niedrigem myokardialem 18F-Dopaminspiegel im weiteren Verlauf eine LBD entwickelten.6
Biologische Definition von neuronalen Synukleinopathien
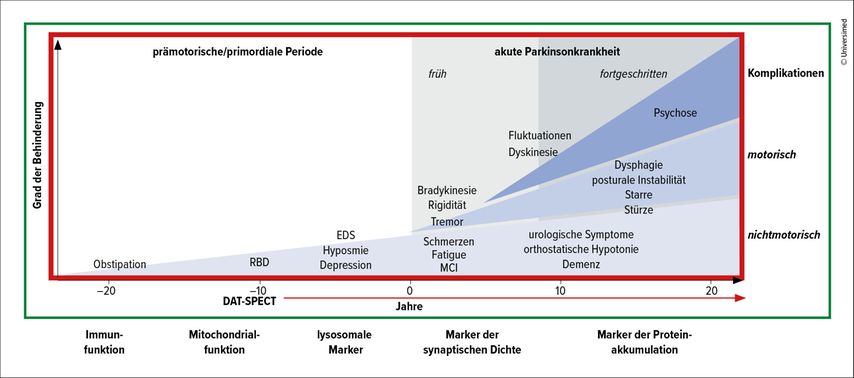
Im Krankheitsverlauf der asymptomatischen Neurosynukleinstörungen (NSD), zu denen sowohl die PD als auch die LBD zählen, geht der dopaminergen Denervierung eine Aggregation von α-Synuklein voraus, berichtete Prof. Dr. Kenneth Marek, Institute for Neurodegenerative Disorders, Connecticut (Abb. 1).7,8 Tatsächlich weist ein Großteil der Menschen mit sporadischer PD einen positiven SAA-Befund, ein Dopamintransporterdefizit und Hyposmie auf (Sensitivität 93%; Spezifität 94%).9 Die Kombination dieser Biomarker mit der Schwere von klinischen Symptomen und funktionellen Einschränkungen ermöglicht außerdem eine integrierte Stadieneinteilung von NSD. Stadium 1A/B umfasst dabei asymptomatische Personen mit einem positiven α-Synuklein-Befund mit oder ohne dopaminerge Dysfunktion. Ab dem Auftreten der ersten klinischen Symptome werden diese Personen dem Stadium 2A/B zugeordnet. In Stadium 3–6 werden die Patient:innen dann anhand der Schwere ihrer klinischen Symptome und der funktionellen Einschränkung unterteilt.3
Abb. 1: Klinische Symptome und Verlauf der PD. Rot: für Bildgebung relevanter Bereich. Grün: für Biomarker relevante Prozesse. RBD: REM-Schlaf-Verhaltensstörung, EDS: abnorme Tagesschläfrigkeit, MCI: leichte kognitive Beeinträchtigung (modifiziert nach Kalia LV et al. 2015 und Marek K 2025)7, 8
Mithilfe dieses sogenannten NSD-ISS-Schemas können Forschende und Kliniker:innen gezielt neue Therapeutika entwickeln, die bereits vor den ersten Symptomen in den Krankheitsverlauf eingreifen. Außerdem kann mit dem Schema die Heterogenität der Studienteilnehmer:innen reduziert werden, um aussagekräftigere Ergebnisse in Studien zu generieren.10
Prasinezumab für die Behandlung in frühen Erkrankungsstadien
Prasinezumab ist ein humanisierter monoklonaler IgG1-Antikörper, der gegen aggregierte Formen des α-Synukleins gerichtet ist und auf diese Weise früh im Verlauf der NSD eingreifen kann, eröffnete Dr.in Tania Nikolcheva, Wissenschaftlerin bei Roche, Basel, ihren Vortrag.11,12 Die Wirksamkeit und Sicherheit von Prasinezumab wurden u.a. anhand der Phase-IIb-Studie PADOVA evaluiert. Die Studie schloss 586 Patient:innen mit idiopathischer PD ein, die mit Levodopa oder Monoaminoxidase-B-Inhibitoren (MAO-Bi) behandelt wurden. Sie wurden in einem Verhältnis von 1:1 randomisiert und erhielten alle 4 Wochen intravenös Prasinezumab 1500mg oder Placebo. Nikolcheva hob das innovative Studiendesign hervor. Anders als traditionelle placebokontrollierte Studien wurde PADOVA als „Time to event“-Studie entworfen. Dabei wurde die doppelblinde Behandlungsphase so lange durchgeführt, bis mindestens 248 Teilnehmer:innen eine Veränderung gegenüber Baseline von mindestens fünf Punkten im Teil III der Movement Disorder Society-sponsored revision of the United PD Rating Scale (MDS-UPDRS) aufwiesen (primärer Endpunkt). Die doppelblinde Behandlungsphase umfasste 76 Wochen, wobei ein:e Teilnehmer:in 3,5 Jahre lang Prasinezumab erhielt.13
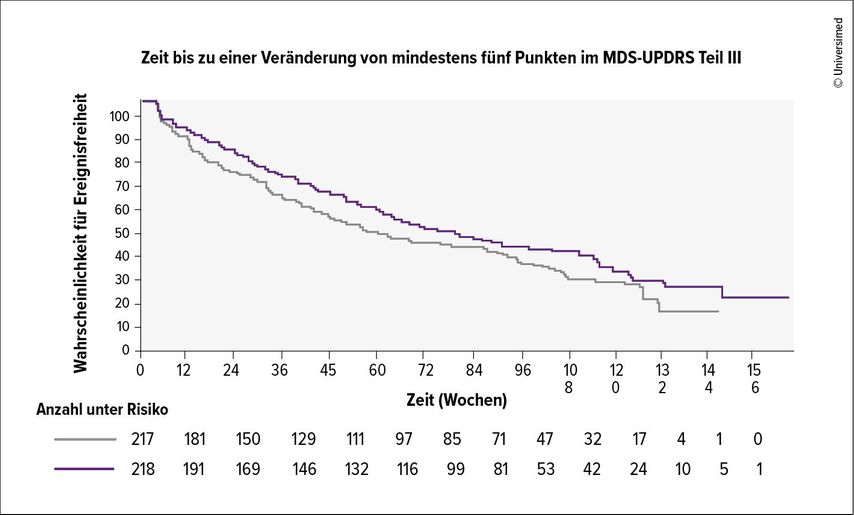
Patient:innen, die mit Prasinezumab behandelt wurden, erreichten den primären Endpunkt im Median nach 61,1 Wochen, Patient:innen in der Placebogruppe nach 49,7 Wochen. Dies entspricht einem nicht signifikanten Behandlungsunterschied von 11,4 Wochen und einer Hazard-Ratio von 0,84 Punkten (95% CI: 0,69–1,01; Abb. 2).11 Nach 76 Wochen konnte Prasinezumab auch keine signifikanten Unterschiede im Vergleich zu Placebo bei der Veränderung des MDS-UPDRS Teil III zeigen (Unterschied: –0,39 Punkte; 95% CI: –1,84 bis 1,05). Nikolcheva vermutete, dass längere Beobachtungszeiträume notwendig wären, um eine signifikante Separation der Placebo- und der Verumgruppe zu beobachten. Tatsächlich zeigte Prasinezumab über einen Zeitraum von 104 Wochen hinweg signifikante Unterschiede bei der Veränderung des MDS-UPDRS Teil III gegenüber Baseline (Unterschied: –2,18; 95%CI: –3,87 bis 0,84).13 PADOVA bestätigte das Sicherheits- und Verträglichkeitsprofil vorangegangener Studien. Infusionsbedingte Reaktionen (IRR) traten in der Prasinezumab-Gruppe nicht häufiger auf als in der Placebogruppe (11% vs. 12,8% unter Placebo). Es kam zu keinen schwerwiegenden IRR. Insgesamt traten 2 Todesfälle in der Placebogruppe und 1 Todesfall in der Verumgruppe aufgrund eines sinusalen Adenokarzinoms auf. Schwerwiegende unerwünschte Ereignisse oder unerwünschte Ereignisse der Grade 3–5 gab es in der Prasinezumab-Gruppe mit 11,6% bzw. 12,7% und in der Placebogruppe mit 11,7% bzw. 14,1%.13
Abb. 2: Zeitverlauf der Wahrscheinlichkeit für Ereignisfreiheit unter Prasinezumab (violett) und Placebo (grau) (modifiziert nach Nikolcheva T et al.)11
Fazit
Neurologische Bildgebung sowie die α-Synuklein-SAA stellen wichtige Analyseverfahren für den Nachweis von Biomarkern in frühen Stadien der NSD dar. Prasinezumab lieferte positive Signale, die auf eine Verlangsamung des Verlaufs der PD hindeuten. Längere Beobachtungszeiträume sind jedoch notwendig, um eine signifikante Separation der Placebo- und der Verumgruppe zu erreichen.
Quelle:
International Conference on Alzheimer’s and Parkinson’s Diseases and Related Neurological Disorders (AD/PD), 1. – 5. 4.2025, Wien.
Literatur:
1 Virameteekul S et al.: Clinical diagnostic accuracy of parkinson‘s disease: where do we stand? Mov Disord 2023; 38(4): 558-66 2 Höglinger GU et al.: A biological classification of parkinson‘s disease: the SynNeurGe research diagnostic criteria. Lancet Neurol 2024; 23(2): 191-204 3 Simuni T et al.: A biological definition of neuronal α-synuclein disease: towards an integrated staging system for research. Lancet Neurol 2024; 23(2): 178-90 4 Coughlin DG et al.: α-synuclein seed amplification assay amplification parameters and the risk of progression in prodromal parkinson disease. Neurology 2025; 104(5): e210279 5 Arnaldi D et al.: Presynaptic dopaminergic imaging characterizes patients with REM sleep behavior disorder due to synucleinopathy. Ann Neurol 2024; 95(6): 1178-92 6 Goldstein DS et al.: Cardiac noradrenergic deficiency revealed by 18f-dopamine positron emission tomography identifies preclinical central lewy body diseases. J Clin Invest 2024; 134(1): e172460 7 Kalia LV et al.: Parkinson‘s disease. Lancet 2015; 386(9996): 896-912 8 Marek K: A biological definition and research integrated staging system of neuronal a-synuclein disease: research framework. AD/PD Conference 2025, Wien. Vortrag am 2.4.2025 9 Siderowf A et al.: Assessment of heterogeneity among participants in the parkinson‘s progression markers initiative cohort using α-synuclein seed amplification: a cross-sectional study. Lancet Neurol 2023; 22(5): 407-17 10 Brumm MC et al.: Parkinson‘s progression markers initiative: a milestone-based strategy to monitor parkinson’s disease progression. J Parkinsons Dis 2023; 13(6): 899-916 11 Nikolcheva T et al.: PADOVA: Topline results from a phase IIb study of prasinezumab in early-stage Prakinson’s disease participants on stable symptomatic treatment. AD/PD Conference 2025, Wien. Vortrag am 1.4.2025
Das könnte Sie auch interessieren:
Welchen Beitrag kann therapeutisches Drug-Monitoring leisten?
Bariatrische Operationen sind eine wirksame Strategie zur Gewichts-reduktion bei Adipositas. Die damit veränderte Anatomie kann die Bioverfügbarkeit von Arzneimitteln massgeblich ...
Neues zur Diagnostik und Therapie bei akutem und episodischem Schwindel
Schwindel ist eines der häufigsten Leitsymptome sowohl auf der Notfallstation wie auch in der Praxis. Wegen der äusserst breiten Differenzialdiagnose, der oftmals transienten Natur der ...
Wichtige Laborparameter bei Epilepsie: ein aktueller Überblick
Laborkontrollen sind bei Epilepsien aus verschiedensten Gründen erforderlich. Anfallssupprimierende Medikamente können Störwirkungen auf unterschiedliche Organsysteme haben, die unter ...