Graft-versus-Host-Erkrankung: wichtige Fortschritte bei Prophylaxe und Therapie
Autorin:
Univ.-Prof. Dr. Hildegard Greinix
Klinische Abteilung für Hämatologie
LKH-Universitätsklinikum Graz
E-Mail: hildegard.greinix@medunigraz.at
Die Kombination aus Posttransplantations-Cyclophosphamid, Tacrolimus und Mycophenolat-Mofetil (MMF) stellt eine wirksame Prophylaxe gegen eine Graft-versus-Host-Erkrankung (GvHD) bei einer hämatopoetischen Stammzelltransplantation (HSZT) mit dosisreduzierter Konditionierung und HLA-identem Spender dar. Abatacept könnte künftig eine wichtige Rolle in der GvHD-Prophylaxe in Kombination miteinem Calcineurin-Inhibitor und Methotrexat (MTX) zukommen. Weitere Daten bestätigen die Wirksamkeit von Ruxolitinib in der Therapie der akuten und chronischen GvHD.
Keypoints
-
Die GvHD stellt eine häufige und schwere Komplikation nach allogener HSZT dar.
-
Posttransplantations-Cyclophosphamid in Kombination mit Tacrolimus und MMF könnte die neue Standard-GvHD-Prophylaxe nach HSZT mit dosisreduzierter Konditionierung werden.
-
Die allogene fäkale Mikrobiomtherapie ist bei Patienten mit refraktärer, schwerer akuter GvHD des GI Trakts sehr wirksam.
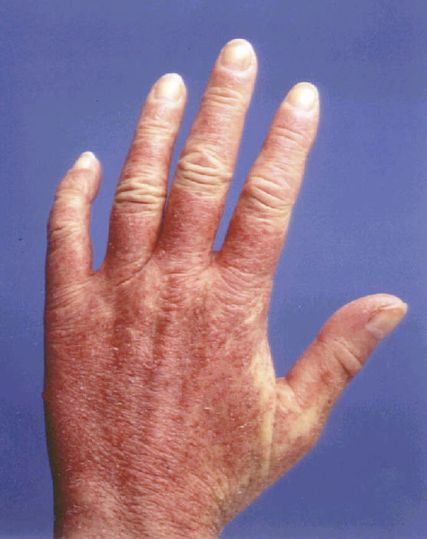
Die Graft-versus-Host(Spender-gegen-Empfänger)-Erkrankung (GvHD) stellt nach wie vor eine schwere Komplikation nach allogener hämatopoetischer Stammzelltransplantation (HSZT) dar, die bei höheren Schweregraden mit ausgeprägter Morbidität und Mortalität einhergeht und bei chronischen Verlaufsformen auch die Lebensqualität betroffener Patienten signifikant beeinträchtigt.1 In den vergangenen Jahren änderten sich zwar nicht die bekannten Risikofaktoren für das Auftreten einer GvHD – etwa höheres Patienten- und Spenderalter, Verwendung von Blutstammzellen anstelle von Knochenmark und Unterschiede in den HLA-Klasse-I- und -II- Merkmalen zwischen Patient und Spender. Es wurden jedoch bedeutende Fortschritte in der Prophylaxe und Therapie der GvHD, basierend auf verbesserten pathophysiologischen Einblicken aus der Grundlagenforschung, erzielt.2 Dies war auch beim Jahreskongress der Amerikanischen Gesellschaft für Hämatologie (ASH) 2022 anhand ausgezeichneter Präsentationen ersichtlich.
Fortschritte in der Prophylaxeder GvHD
Zur GvHD-Prophylaxe wird weltweit ein Calcineurin-Inhibitor (CNI) kombiniert mit Methotrexat (MTX), Mycophenolat-Mofetil (MMF) oder Sirolimus verwendet. Jüngst wurde Abatacept von der amerikanischen Arzneimittelbehörde (FDA) zur Prophylaxe der akuten GvHD zugelassen. Abatacept stellt ein rekombinantes Fusionsprotein dar, das aus der extrazellulären Domäne des humanen zytotoxischen T-Lymphozyten-assoziierten Antigens 4 (CTLA-4) verbunden mit dem modifizierten Fc-Teil des humanen Immunglobulins G1 (IgG1) besteht, um die Komplementfixation und antikörperabhängige zelluläre Zytotoxizität zu verhindern.
Leslie S. Kean vom Boston Children’s Hospital präsentierte die Daten einer retrospektiven Kohortenstudie des Center for International Blood and Marrow Transplant Research (CIBMTR). Darin erhielten pädiatrische und erwachsene Patienten mit Leukämien, Lymphomen oder myelodysplastischen Syndromen mit einem 8/8- (n=781) oder 7/8-identen (n=378) unverwandten Spender (URD) in den Jahren 2011 bis 2018 entweder Abatacept (ABA) mit CNI/MTX, Antithymozytenglobulin (ATG) mit CNI/MTX oder Posttransplantations-Cyclophosphamid (PTCy) als GvHD-Prophylaxe. Das Gesamtüberleben war sowohl bei 8/8(86% vs. 70%, p=0,02)- als auch 7/8(87% vs. 58%, p=0,0026)-identen URD mit ABA+CNI/MTX signifikant besser als mit ATG+CNI/MTX. Weiters konnte die Studie zeigen, dass das Gesamtüberleben und das Rezidiv-freie Überleben (RFS) bei Patienten mit 7/8-identem URD mit ABA+CNI/MTX gleich gut ist wie nach HSZT mit einem 8/8-identen URD.3 Diese eindrucksvollen Daten sollten sicherlich im Rahmen einer prospektiven Studie bestätigt werden.
Als Late-breaking-Abstract wurde von Shernan G. Holtan von der University of Minnesota in Minneapolis über die Ergebnisse einer randomisierten Phase-III-Studie berichtet, die das Blood and Marrow Transplant Clinical Trials Network (BMT CTN) bei 431 erwachsenen Patienten nach dosisreduzierter Konditionierung und einem HLA-identen verwandten oder unverwandten Spender durchführte. Dabei wurde PTCy/Tacrolimus/MMF mit dem Standardregime Tacrolimus/MMF als GvHD-Prophylaxe verglichen. Der primäre Studienendpunkt war das GvHD-Rezidiv- oder progressionsfreie Überleben (GRFS), das im PTCy-Studienarm nach 1 Jahr 52,7% verglichen mit 34,9% im Standardarm betrug. Im PTCy-Arm waren sowohl die akute (Tag 100 Grade III–IV 6,3% vs. 14,7%, p=0,001) als auch die chronische GvHD (nach 1 Jahr 21,9% vs. 35,1%, p=0,005) signifikant reduziert. Es zeigten sich jedoch keine Unterschiede in der 1-Jahres-Rezidiv/Progressionsrate (20,8% vs. 20,2%, p=0,9) sowie im Gesamtüberleben (76,8% vs. 72,6%, p=0,3). Auch die Raten an Grad-III-Infektionen, Zytomegalieviruserkrankungen sowie an komplettem Spenderchimärismus am Tag 100 waren nicht signifikant unterschiedlich. Die Autoren schlussfolgerten daraus, dass PTCy/Tacrolimus/MMF nach HSZT mit dosisreduzierter Konditionierung und HLA-identen Geschwister- und unverwandten Spendern den neuen Standard der GvHD-Prophylaxe darstellen sollte.4
Ruxolitinib in der Therapie der akuten GvHD
Der orale, selektive Januskinase(JAK)1/JAK2-Inhibitor Ruxolitinib wurde kürzlich von der europäischen Arzneimittelbehörde (EMA) zur Therapie der steroidrefraktären akuten GvHD bei Patienten im Alter von 12 Jahren und älter, basierend auf den ausgezeichneten Daten der auch in Österreich durchgeführten REACH2-Studie, zugelassen. Gerard Socie vom Hôpital Saint-Louis in Paris präsentierte Daten einer Post-hoc-Analyse dieser randomisierten Phase-III-Studie, in der evaluiert wurde, welchen Einfluss der Therapiebeginn von Ruxolitinib auf das Outcome der Patienten hatte. Von den 154 Patienten im Studienarm erhielten 112, 42 und 24 Ruxolitinib früh (innerhalb 0–3 Tagen ab Diagnosestellung einer steroidrefraktären akuten GvHD), spät und sehr spät (≥4 Tage) oder sehr spät (≥7 Tage). Verglichen mit dem Standardarm der besten verfügbaren Therapie waren die Gesamtansprechraten und kompletten Remissionen (CR) auf Ruxolitinib in allen drei Subgruppen besser. Es zeigte sich jedoch ein Trend zu höheren CR-Raten am Tag 28 (36,6% vs. 33,3% vs. 25%) sowie ein längeres Andauern des Ansprechens (141,5 Tage vs. 107,3 Tage vs. 123,7 Tage) bei frühzeitigem verglichen mit späterem Beginn von Ruxolitinib.5
Franco Locatelli vom Ospedale Pediatrico Bambino Gesù in Rom präsentierte die Daten der einarmigen, multizentrischen Phase-I/II-Studie REACH-4, in der 45 pädiatrische Patienten im Alter von 2 bis 17 Jahren mit therapienaiver oder steroidrefraktärer akuter GvHD zusätzlich zu kortikosteroidem Ruxolitinib erhielten. Während die Jugendlichen von 12 bis 17 Jahren mit einer Dosis von 10mg zweimal täglich therapiert wurden, erhielten jüngere Patienten 5 mg zweimal täglich (Alter von 6 bis 11 Jahren) oder 4mg/m2 (Alter von 2 bis 5 Jahren). Das Gesamtansprechen (ORR) aller Patienten am Tag 28 lag bei 84,4%, einschließlich CR in 489% der Fälle. Interessanterweise hatten therapienaive Patienten ein niedrigeres ORR am Tag 28 als steroidrefraktäre (69,2% vs. 90,6%), wobei in der ersten Gruppe die CR-Raten am Tag 28 und Tag 56 höher (53,8% vs. 469%) waren. Die beobachteten Nebenwirkungen entsprachen den bei Erwachsenen berichteten.6
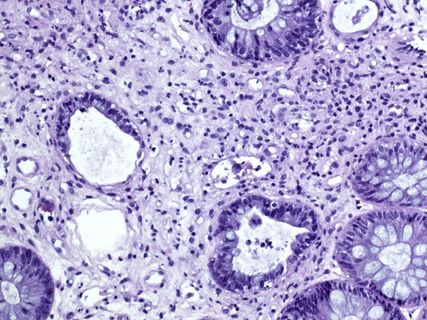
Abb. 2: Akute GvHD Lerner-Grad III: histologisch Kryptenverlust mit Ulzeration, Ödem in der Lamina propria, Apoptosen und Nekrosen epithelialer Zellen
In einer randomisierten, multizentrischen Phase-II-Studie, die von Liping Dou vom Chinese PLA General Hospital in Peking präsentiert wurde, erhielten 198 Patienten mit neu diagnostizierter akuter GvHD entweder Ruxolitinib in einer Dosierung von 5 mg pro Tag in Kombination mit Methylprednisolon 1mg/kg/Tag (n=99) oder Methylprednisolon allein in einer Dosierung von 2mg/kg/Tag (n=99). Die ORR am Tag 28 lag bei 92,9% im Ruxolitinib-Arm verglichen mit 70,7% im Kontrollarm (p=0,002). Auch am Tag 56 war die ORR in der Ruxolitinib-Kohorte signifikant höher (86% vs. 46%, p<0,001). Die Nebenwirkungen zwischen den beiden Armen waren nicht unterschiedlich und die häufigsten Grad-III-Toxizitäten waren Anämien und Thrombozytopenien. In dieser Studie wurde Ruxolitinib in einer deutlich niedrigeren Dosierung als bisher verwendet und auch die begleitende Steroidtherapie betrug nur 50% der in der Klinik üblichen Dosierung.7 Die vorliegenden Daten unterstützen die weitere Verwendung von Ruxolitinib in niedrigeren Dosen.
Fäkale, allogene Mikrobiotatherapie in der refraktären gastrointestinalen akuten GvHD
Mohamad Mohty vom Hôpital Saint-Antoine in Paris präsentierte die Ergebnisse des französischen Early-Access-Programms zur Verwendung der gepoolten, allogenen Mikrobiotatherapie MaaT013 bei 81 Patienten mit steroidrefraktärer oder steroidabhängiger akuter GvHD, die zuvor auf 1 bis 6 Therapielinien (median2) nicht angesprochen hatten, und bei 66/81 Patienten auch Ruxolitinib inkludierten. Die meisten Patienten hattenakute GvHDvon Grad III (n=51%) oder Grad IV (n=38%) . Bei jedem Patienten waren 3 MaaT013-Gaben bestehend aus 30g Fäzes von 4 bis 8 gesunden Spendern vorgesehen, die im Abstand von 7 Tagen mittels Einlaufs verabreicht wurden. Am Tag 28 lag die ORR im Gastrointestinal(GI)-Trakt bei 56%, einschließlich CR bei 37%. Die GI-ORR war höher bei Patienten mit niedrigerem GvHD-Grad (89% bei Grad II, 66% bei Grad III und 32% bei Grad IV) und steroidabhängiger verglichen mit steroidrefraktärer GvHD (92% vs. 49%). Interessanterweise sprachen auch Ruxolitinib-refraktäre Patienten sehr gut auf die Mikrobiotatherapie an. Die Überlebensraten bei 6 und 12 Monaten betrugen 51% und 39% und waren bei Respondern am Tag 28 höher als bei Non-Respondern (69% vs. 28% nach 6 Monaten, 59% vs. 14% nach 12 Monaten). Die Therapie wurde insgesamt sehr gut toleriert und die Treatment-emergent Adverse Events waren mehrheitlich Infektionen bei 18 Patienten, wobei keine Pathogenübertragung durch die Mikrobiotatherapie gefunden wurde.8 Basierend auf diesen Ergebnissen wird derzeit eine Phase-III-Studie mit der Anwendung von MaaT013 durchgeführt.
Neue Entwicklungen in der chronischen GvHD
Annie Im vom University of Pittsburgh Cancer Institute berichtete Ergebnisse des Dosisfindungsteils der multizentrischen, randomisierten Phase-I/II-Studie Gravitas-309, in der der selektive JAK1-Inhibitor Itacitinib in Kombination mit Kortikosteroiden bei 103 Patienten mit neu diagnostizierter moderater oder schwerer chronischer GvHD zum Einsatz kam. Initial wurden Dosierungen von 200mg oder 300mg pro Tag eingesetzt, in der Folge wurde die Itacitinib-Dosis auf 400mg/Tag bzw. 300mg zweimal täglich erhöht. Die ORR nach 6 Monaten lagen bei 46% mit 14% CR für die 300mg/Tag- und 53% mit 32% CR für die 400mg/Tag-Itacitinib-Dosis, verglichen mit 36% ORR und 18% CR in der alleinigen Steroid-Kohorte. Mit zunehmender Itacitinib-Dosierung stiegen die Nebenwirkungen, die aus Zytopenien und Infektionen (>Grad III 44% vs. 6%) bestanden und auch die Mortalität der Patienten erhöhten (14–18% vs. 11%). So lagen die Treatment-emergent Adverse Events Schweregrad >III in der Itacitinib-Kohorte bei 65% verglichen mit 31% in der alleinigen Steroidgruppe. Aufgrund dieser Nebenwirkungsdaten wird die Kombinationstherapie aus Itacitinib und Steroiden als Erstlinientherapie der chronischen GvHD nicht mehr weiter exploriert werden.9
Vijaya Raj Bhatt vom University of Nebraska Medical Center in Omaha präsentierte die Ergebnisse einer einarmigen, multizentrischen Phase-II-Studie, in der Ruxolitinib in einer Dosierung von 10mg zweimal täglich bei 47 Patienten mit steroid-refraktärer sklerodermiformer chronischer GvHD zum Einsatz kam. Primäres Studienziel stellte das NIH-definierte Ansprechen von Haut- und Gelenksmanifestationen nach 6 Monaten Therapie dar. Der mediane Zeitraum ab Diagnose der chronischen GvHD bis zur Studienteilnahme betrug 48 Monate, 85% der Patienten hatten eine schwere chronische GvHD und hatten im Mittel 3 vorangegangene Therapielinien, auf die sie refraktär waren. Nach 6 Monaten zeigte sich ein partielles Ansprechen (PR) von Haut oder Gelenken bei 49%, es gab jedoch keine CR. Die ORR gesamt bestand aus 47%. Die besten ORR wurden bei oraler Mundschleimhaut (9/17, 53%), Ösophagus (5/9, 55%), oberem GI- (2/3, 67%) und unterem GI-Trakt (2/3, 67%) erzielt, jedoch sind hier die Fallzahlen zu gering, um valide Aussagen treffen zu können.10
Literatur:
1 Greinix H et al.: The EBMT Handbook 7th edition. Cham; Springer, 2019 2 Luznik L et al.: Biol Blood Marrow Transplant 2008; 14(6): 641-50 3 Kean LS et al.: Blood 2022; 140(Suppl_1): 1373-75 4 Holtan SG et al.: Blood 2022; 140(Suppl_1): LBA-4 5 Socié G et al.: Blood 2022; 140(Suppl_1): 4765-6 6 Locatelli F et al.: Blood 2022; 140(Suppl_1): 1376-8 7 Dou L et al.: Blood 2022; 140(Suppl_1): 1381-2 8 Malard F et al.: Blood 2022; 140(Suppl_1): 276-8 9 Im A et al.: Blood 2022; 140(Suppl_1): 1870-1 10 Bhatt V et al.: Blood 2022; 140(Suppl_1): 1379-80
Das könnte Sie auch interessieren:
Hautmanifestationen bei onkologischen Erkrankungen
Krebserkrankungen verschiedener Organsysteme können auch mit Symptomen an der Haut einhergehen, die manchmal bereits als frühe Warnzeichen auftreten. Dazu zählt ausgeprägter Pruritus. ...
Kutane oder systemische Mastozytose – was macht die Hämatologie?
Mastzellerkrankungen sind eine heterogene Gruppe von Erkrankungen, die von einer Vielzahl zugrunde liegender genetischer Veränderungen und Komorbiditäten beeinflusst werden und in ihrem ...
Neues zur GVHD-Prophylaxe und Risikobewertung bei Myelofibrose
Die Prophylaxe der Graft-versus-Host-Krankheit (GVHD) bleibt eine zentrale Herausforderung nach allogener Stammzelltransplantation. Auf dem diesjährigen EBMT-Kongress wurden dazu neue ...