Ist die Operation der Brust bei vollem Ansprechen notwendig?
Autor:
PD Dr.med. Christoph Tausch
Chief Medical Officer
Past-Präsident der Schweizerischen Gesellschaft für Senologie
Brust-Zentrum Zürich
E-Mail: c.tausch@brust-zentrum.ch
Die neoadjuvante Systemtherapie gewinnt zunehmend an Bedeutung in der Behandlung des Mammakarzinoms. Wurde zunächst die neoadjuvante Chemotherapie nur zur Verkleinerung von lokal fortgeschrittenen Tumoren und in der Folge zur Erhöhung der Brusterhaltungsrate eingesetzt, so wurde mit den Jahren mehr und mehr das Ziel verfolgt, möglichst oft ein Komplettansprechen des Tumors (pCR) zu erzielen.1,2
Durch den Einsatz geeigneter Substanzen in neuen Schemata zeigt sich der grösste Effekt an Karzinomen mit hoher Zellteilung (HER2-positives und tripelnegatives Mammakarzinom). Mit modernen Behandlungsschemata erreichen wir für die hochproliferativen Karzinome mittlerweile pCR-Raten weit jenseits der 50%.3,4 Durch den zusätzlichen Einsatz von Immuntherapien werden die pCR-Raten weiter verbessert.
Das Ziel der neoadjuvanten Therapie ist nicht nur ein Downstaging im Bereich des Brusttumors, sondern auch ein Downstaging im Bereich der axillären Lymphknoten. Die Vorhersage einer pCR mittels radiologischer Bildgebung ist limitiert. Die besten Resultate werden mit dem MRI erreicht.5,6
Bereits Ende des letzten Jahrhunderts wurde bei gutem Ansprechen nach Einsatz von neoadjuvanter Chemotherapie der Versuch unternommen, auf die Operation zu verzichten. Diese frühen Studien waren geprägt von hohen Lokalrezidivraten, allerdings ohne Einbussen in Bezug auf das Überleben.7–10
Vakuum-assistierte Biopsien (VAB) haben die Operation zur Abklärung von suspekten Mikrokalzifikationen abgelöst. Selbst bei den meisten Risikoläsionen kann die Operation durch eine VAB im therapeutischen Sinn ersetzt werden.11,12
Bisherige Evidenz, die Operation durch eine Biopsie zu ersetzen
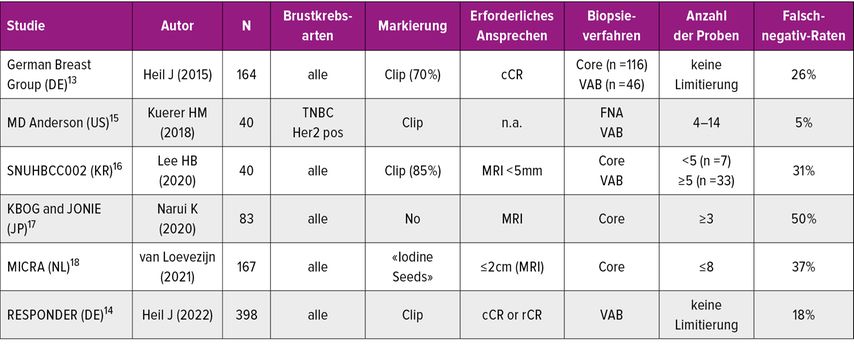
In den letzten Jahren wurden in einer Reihe von Studien bei gutem Ansprechen minimalinvasive Biopsieverfahren mit der Operation nach neoadjuvanter Systemtherapie verglichen (Tab. 1).
Zwei Studien aus Deutschland von Jörg Heil et al. aus Heidelberg mit 164 und 398 Patientinnen untersuchten anfänglich sowohl mit Corebiopsien als auch mit VABs die Prädiktion einer pCR.13,14 Dabei wurden alle Arten von Mammakarzinomen eingeschlossen und es war nicht notwendig, dassein radiologisches Komplettansprechen erzielt worden war. Die Falsch-negativ-Rate lag in der ersten Studie bei 26% und in der zweiten Studie bei 18%. Henry Kuerer et al. vom MD Anderson Cancer Center untersuchten an einer kleinen Serie (n=40) nur tripelnegative und HER2-positive Mammakarzinome mit einem radiologischen Komplettansprechen.15Sie konnten die pCR mit einer VAB sehr genau vorhersagen, die Falsch-negativ-Rate lag bei 5%.
Weitere Studien aus Südkorea, Japan und den Niederlanden,16–18 bei denen alle Tumoren eingeschlossen waren, grossteils Corebiopsien verwendet wurden, teilweise auch kein Clip zur Markierung des Primärtumors vor der Chemotherapie eingesetzt wurde, erzielten Falsch-negativ-Raten zwischen 31 und 50%.
Einsatz eines «Machine Learning»-Algorithmus
Aufgrund der inkonklusiven und vorwiegend ernüchternden Ergebnisse der bisher publizierten Studien wurde wiederum in Heidelberg ein spezieller «Machine Learning»-Algorithmus («extreme gradient boosting tree») entwickelt, um die pCR-Rate sowohl in der Brust als auch in der Axilla besser vorhersagen zu können.19 Dabei wurden 27 verschiedene Variablen von jeder Patientin erhoben und der Algorithmus wurde zunächst an einem Entwicklungsset (n=318) und dann an einem Validierungsset (n=45) überprüft. Damit konnte die Falsch-negativ-Rate deutlich gesenkt werden (0–5,2%).
VISION-I-Studie
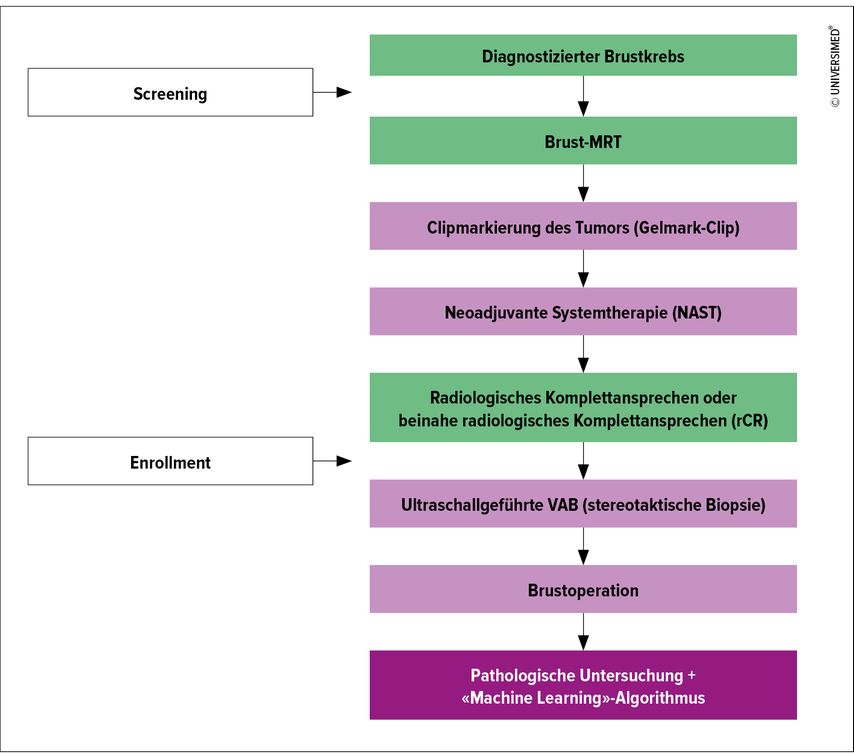
Aufgrund der Datenlage ist in Europa derzeit nicht an einen Verzicht auf eine Operation bei radiologischem Komplettansprechen durch eine neoadjuvante Systemtherapie zu denken. Deshalb wurde die VISION-I-Studie vor einem Jahr neu aufgelegt. Erstmalig wird in dieser Studie prospektiv nicht nur eine VAB, sondern auch der oben genannte «MachineLearning»-Algorithmus getestet. Die Studie wird als prospektive Kohortenstudie multizentrisch in der Schweiz, Deutschland und Österreich sowie in einzelnen weiteren internationalen Zentren durchgeführt. Um die Sensitivität zu erhöhen und die Falsch-negativ-Rate niedrig zu halten, werden multifokale Tumoren nur unter bestimmten Umständen aufgenommen, es kommen nur Vakuumbiopsien mit zumindest zwölf entnommenen Biopsiezylindern zum Einsatz und der Pathologe muss nach repräsentativen Biopsien (sichtbare Tumornarbe) suchen. Damit die Studie auch «Real World»-Ansprüchen standhält, werden nur hoch proliferative Tumoren eingeschlossen, wann immer möglich ist ein MRI vor der neoadjuvanten Systemtherapie als auch vor der Biopsie gefordert. Es werden nur Patientinnen eingeschlossen, die ein radiologisches Komplettansprechen oder ein nahezu komplettes Ansprechen aufweisen (Abb. 1). Erstmalig wird sowohl das axilläre Ansprechen mit eingeschlossen als auch der «MachineLearning»-Algorithmus eingesetzt.
Die Studie ist in der Schweiz in den allermeisten Zentren bereits angelaufen. In Österreich und in Deutschland ist jeweils ein Zentrum aktiviert; bisher wurden 80 von den geplanten 420 Patientinnen eingeschlossen. Mit einem Ergebnis ist frühestens in 2 Jahren zu rechnen.
Verzicht auf die Operation
Gestützt auf die vielversprechenden eigenen Daten hat Henry Kuerer eine multizentrische Studie mit 40 Patientinnen durchgeführt.20 Dabei wurde bei Nachweis einer pCR in der VAB auf eine weitere Operation verzichtet. Es wurden dieselben Einschlusskriterien wie in der Vorstudie verwendet (nur HER2-positive und tripelnegative Karzinome, Einsatz von VAB bei radiologischem Komplettansprechen im MRI). Die Studie wurde von 2017–2021 an 5 Zentren in den USA durchgeführt. Nach einer mittleren Nachbeobachtungszeit von 24,6 Monaten wurde bisher kein Lokalrezidiv beobachtet.
In Südkorea wurde in diesem Jahr der OPTIMIST-Trial gestartet. Diese Studie verfolgt in einem sehr ähnlichen Design wie die amerikanische Studie auch einen Verzicht auf die Operation bei nachgewiesener pCR in der VAB. In der südkoreanischen Studie wird bei pCR zusätzlich noch randomisiert zwischen Verzicht auf den axillären Eingriff und einer Sentinelbiopsie (+/–Axilladissektion). Es ist der Einschluss von 533 Patientinnen geplant.
Fazit
Mit dem zunehmenden Einsatz der neoadjuvanten Systemtherapie beobachten wir heute vermehrt eine pCR. Wie sicher die pCR mit einer alleinigen VAB vorherzusagen ist, werden uns mithilfe der intelligenten VAB die VISION-I-Studie, die Langzeitdaten der amerikanischen Studie und der OPTIMIST-Trial zeigen.
Ein Verzicht auf die Operation ausserhalb von klinischen Studien ist derzeit nicht zu empfehlen.
Literatur:
1 Bear HD et al.: Sequential preoperative or postoperative docetaxel added to preoperative doxorubicin plus cyclophosphamide for operable breast cancer: National Surgical Adjuvant Breast and Bowel Project Protocol B-27. J Clin Oncol 2006; 24(13): 2019-27 2 von Minckwitz G et al.: Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. J Clin Oncol 2012; 30(15): 1796-804 3 Loibl S et al.: Addition of the PARP inhibitor veliparib plus carboplatin or carboplatin alone to standard neoadjuvant chemotherapy in triple-negative breast cancer (BrighTNess): a randomised, phase 3 trial. Lancet Oncol 2018; 19(4): 497-509 4 Schneeweiss A et al.: Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol 2013; 24(9): 2278-84 5 Gu Y-L et al.: Role of Magnetic Resonance imaging in detection of pathologic complete remission in breast cancer patients treated with neoadjuvant chemotherapy: a meta-analysis. Clin Breast Cancer 2017; 17(4): 245-55 6 Marinovich ML et al.: Meta-analysis of magnetic resonance imaging in detecting residual breast cancer after neoadjuvant therapy. J Natl Cancer Inst 2013; 105(5): 321-33 7 De Lena M et al.: Multimodal treatment for locally advanced breast cancer. Result of chemotherapy-radiotherapy versus chemotherapy-surgery. Cancer Clin Trials 1981; 4(3): 229-36 8 Scholl SM et al.: Breast tumour response to primary chemotherapy predicts local and distant control as well as survival. Eur J Cancer 1995; 31A(12): 1969-75 9 Ellis P et al.: Clinical prognostic and predictive factors for primary chemotherapy in operable breast cancer. J Clin Oncol 1998; 16(1): 107-14 10 Ring A et al.: Is surgery necessary after complete clinical remission following neoadjuvant chemotherapy for early breast cancer? J Clin Oncol 2003; 21(24): 4540-5 11 Rageth CJ et al.: First International Consensus Conference on lesions of uncertain malignant potential in the breast (B3 lesions). Breast Cancer Res Treat 2016; 159(2): 203-13 12 Elfgen C et al.: Third International Consensus Conference on lesions of uncertain malignant potential in the breast (B3 lesions). Virchows Arch 2023; 483(1): 5-20 13 Heil J et al.: Diagnosis of pathological complete response to neoadjuvant chemotherapy in breast cancer by minimal invasive biopsy techniques. Br J Cancer 2015; 113(11): 1565-70 14 Heil J et al.: Diagnosing pathologic complete response in the breast after neoadjuvant systemic treatment of breast cancer patients by minimal invasive biopsy: Oral presentation at the San Antonio Breast Cancer Symposium on Friday, December 13, 2019, Program Number GS5-03. Ann Surg 2022; 275(3): 576-81 15 Kuerer HM et al.: A clinical feasibility trial for identification of exceptional responders in whom breast cancer surgery can be eliminated following neoadjuvant systemic therapy. Ann Surg 2018; 267(5): 946-51 16 Lee H-B et al.: Prediction of pathologic complete response using image-guided biopsy after neoadjuvant chemotherapy in breast cancer patients selected based on MRI findings: a prospective feasibility trial. Breast Cancer Res Treat 2020; 182(1): 97-105 17 Narui K et al.: Prediction of pathological complete response after neoadjuvant chemotherapy in breast cancer by combining magnetic resonance imaging and core needle biopsy. Surg Oncol 2020; 35: 447-52 18 van Loevezijn AA et al.: Minimally invasive complete response assessment of the breast after neoadjuvant systemic therapy for early breast cancer (MICRA trial): Interim analysis of a multicenter observational cohort study. Ann Surg Oncol 2021; 28(6): 3243-53 19 Pfob A et al.: Intelligent vacuum-assisted biopsy to identify breast cancer patients with pathologic complete response (ypT0 and ypN0) after neoadjuvant systemic treatment for omission of breast and axillary surgery. J Clin Oncol 2022; 40(17): 1903-15 20 Kuerer HM et al.: Eliminating breast surgery for invasive breast cancer in exceptional responders to neoadjuvant systemic therapy: a multicentre, single-arm, phase 2 trial. Lancet Oncol 2022; 23(12): 1517-24
Das könnte Sie auch interessieren:
Standard oder ein verzichtbarer Mehraufwand?
Die durchschnittliche Patientin mit einer zervikalen intraepithelialen Neoplasie (CIN) ist im reproduktiven Alter, im Mittel 30 Jahre alt und tendenziell werden die Patientinnenimmer jünger.1 Nahezu jede Exzisionsart an der Zervix uteri ist mit einer erhöhten perinatalen Morbidität behaftet. Die LLETZ («large loop excision of the transformation zone») und die LEEP («loop ...
Neues zur Prävention rezidivierender Harnwegsinfektionen
Ob in der Hausarztpraxis oder beim Spezialisten: Harnwegsinfektionen sind häufig. Gemäss dem Expertenbrief No.58 der Schweizerischen Gesellschaft für Gynäkologie und Geburtshilfe ist die ...
Betroffenheit oder Gefährdung erkennen und Hilfe leisten
Die weibliche Genitalbeschneidung (FGM/C) ist infolge der Migration aus praktizierenden Ländern auch in der Schweiz eine Realität. Insbesondere Gesundheitsfachpersonen kommen mit ...