Management RED-S/Female Athlete Triad
Autorinnen:
Dr. med. Sabrina Baumgartner
Klinik für Gynäkologie
Universitätsspital Zürich
Prof. Dr. med. Petra Stute
Gynäkologische Endokrinologie und Reproduktionsmedizin,
Universitätsklinik für Frauenheilkunde,
Inselspital Bern
Korrespondierende Autorin:
Dr. med. Sabrina Baumgartner
E-Mail: sabrina.baumgartner@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das RED-S («relative energy deficiency in sport») beschreibt einen durch Energiemangel induzierten Symptomkomplex bei Sportler*innen. Da bei Athletinnen ein RED-S oftmals durch das Ausbleiben der Menstruationsblutung zum Vorschein kommt, übernehmen Gynäkolog*innen im Sinne einer ersten Anlaufstelle eine wichtige Funktion im Management des RED-S. Das Management des RED-S bei Athletinnen ist komplex: Es besteht aus einer gynäkologisch-endokrinologischen Amenorrhöabklärung und dem Aufstellen eines interdisziplinären, längerfristigen, gemeinsamen Behandlungsplans.
Keypoints
-
Das Energiemangelsyndrom RED-S kann eine Athletin in ihrer sportlichen, gesundheitlichen und psychischen Leistungsfähigkeit schwer und teilweise irreversibel beeinträchtigen.
-
In der Differenzialdiagnostik bei der amenorrhöischen Sportlerin ist Vorsicht geboten. Sie bedarf einer ausführlichen gynäkologisch-endokrinologischen Abklärung.
-
Gynäkologen haben eine wichtige Funktion im multidisziplinären Management des RED-S zusammen mit der Sporternährungsberatung, Sportmedizin und ggf. Psychiatrie.
-
Die Prävention des RED-S spielt eine weitere wichtige Rolle, da ein frühes Beheben eines Energiedefizits die gesundheitlichen Konsequenzen in Schach hält, frühzeitige Karriereabbrüche verhindert und der Athletin einen zeitigen «Return to Sport» ermöglicht.
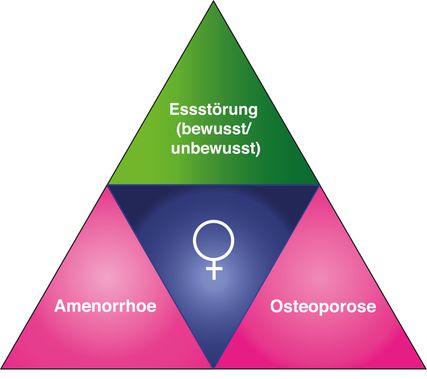
Der Medaillenspiegel der Schweizer Athletinnen bei der Olympiade 2020 in Tokio heuer steht sinnbildlich für das seit Jahrzehnten zunehmende Interesse der Frauen an kompetitiven Sportveranstaltungen. Leistungssport ist eine stete Gratwanderung zwischen maximaler Leistungsfähigkeit und Verletzungsanfälligkeit. Der Grat verschmälert sich in Abhängigkeit vom körperlichen Energiezustand insbesondere bei Frauen. Die Vulnerabilität der weiblichen Reproduktionsachse widerspiegelt sich in der 1997 formulierten «female athlete triad» (FAT) (Abb.1), welche die Kombination von Zyklusstörungen und verminderter Knochendichte als Folge verminderter Energiezufuhr bei Athletinnen beschreibt. Eine verminderte Energieverfügbarkeit (EV) tangiert jedoch weitaus mehr Körpersysteme als den Knochen und den Zyklus und verschont auch Männer nicht. Zur Berücksichtigung dieser Gegebenheiten hat das IOC (International Olympic Committee) im Jahr 2014 die FAT durch den Symptomkomplex «RED-S» («relative energy deficiency in sports») erweitert.
Pathophysiologie
Die im Nucleus arcuatus des Hypothalamus stationierten GnRH-Neuronen fungieren als Taktgeber der reproduktiven Achse, indem sie via hypophysäre LH- und FSH-Sekretion die Gonaden aktivieren. Die Funktionalität dieses neuroendokrinen Regelkreises kann aufgrund chronischer Stressoren (physisch, nutritiv, psychisch) oder auch infolge genetischer Variationen2 beeinträchtigt sein. Körperliches Training gilt als ein chronischer Stressor, welcher via Aktivierung der Hypothalamus-Hypophysen-Nebennierenachse und negativer Rückkopplung die GnRH- und LH-Pulsatilität stören kann, insbesondere bei Zuständen verminderter EV («energy availability hypothesis»).3,4
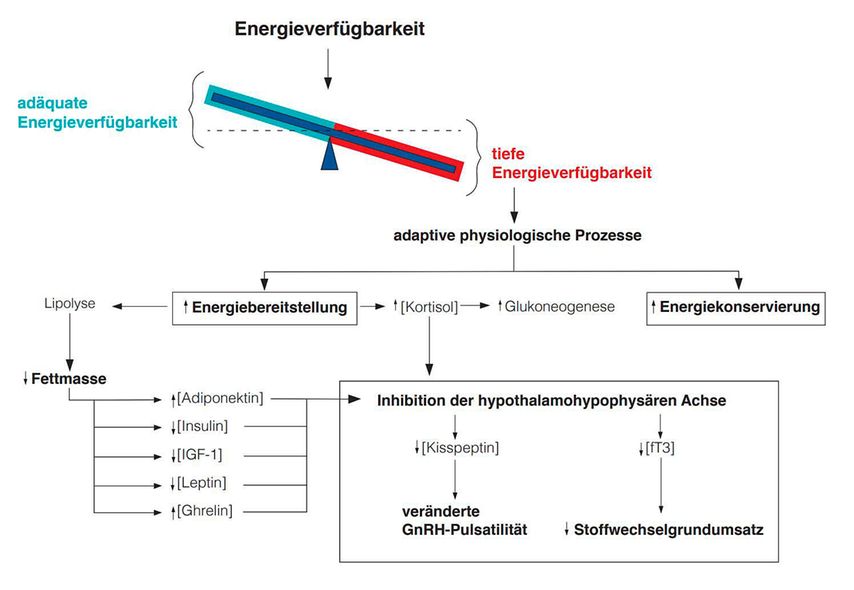
Wird bei der EV einer Athletin die kritische Grenze von 30kcal (=188kJ) pro kg FFM (fettfreie Masse) unterschritten, so bewirken die veränderten Konzentrationen von Kortisol, Adiponektin, Insulin, IGF-1 («insulin-like growth factor 1»), Leptin und Ghrelin ein negatives Feedback am Hypothalamus mit Abnahme der LH-Pulsatilität (Abb.2).5 Die alterierte LH-Pulsatilität verzögert die Follikulogenese, was sich in Form einer subklinischen Zyklusstörung bis hin zum völligen Ausbleiben der Menstruation äussern kann. Diese physiologische Kaskade ergibt aus evolutionsbiologischer Sicht Sinn, denn sie erlaubt es dem Körper, in Notzuständen die vorhandene Energie den prioritären lebenswichtigen Körperfunktionen – Thermogenesis, Zellerhalt und Fortbewegung – zuzuteilen.6
Abb. 2: Adaptive physiologische Prozesse bei niedriger Energieverfügbarkeit, adaptiert nach Misra et al.8
Eine weitere modulierende Rolle in der stressinduzierten Suppression der Gonadenachse wird dem Peptidhormon «Kisspeptin» zugeschrieben.7 Kisspeptin wird sowohl innerhalb als auch ausserhalb des Hypothalamus synthetisiert und stimuliert die hypothalamische GnRH-Sekretion. Stresszustände (z.B. Mangelernährung, Hypoglykämie, psychischer Stress, entzündliche Prozesse, Ghrelin, Laktation) supprimieren die Expression von Kisspeptin, wodurch ein wichtiger Stimulator der Gonadenachse entfällt (Abb.2).
Prävalenz verminderter Energieverfügbarkeit
In einer kürzlichen Erhebung bei Freizeitsportlern qualifizierten bis zu 45% der Studienteilnehmer für eine verminderte EV.9 Eine andere Arbeit präsentierte ähnliche Zahlen und zeigte auch, dass die geringe EV auch vor Hobbysportlerinnen (69,2%, im Vergleich zu 60,4% bei Elitesportlerinnen) nicht Halt macht.10 Ein Energiedefizit tritt gehäuft bei Individual- und körperbetonten Sportarten auf und ist oft assoziiert mit Risikofaktoren wie zwanghaftem Ess- oder Trainingsverhalten, fehlendem Ernährungswissen und dem Drang zur Reduktion des Körperfettanteils.11
Symptomkomplex des RED-S
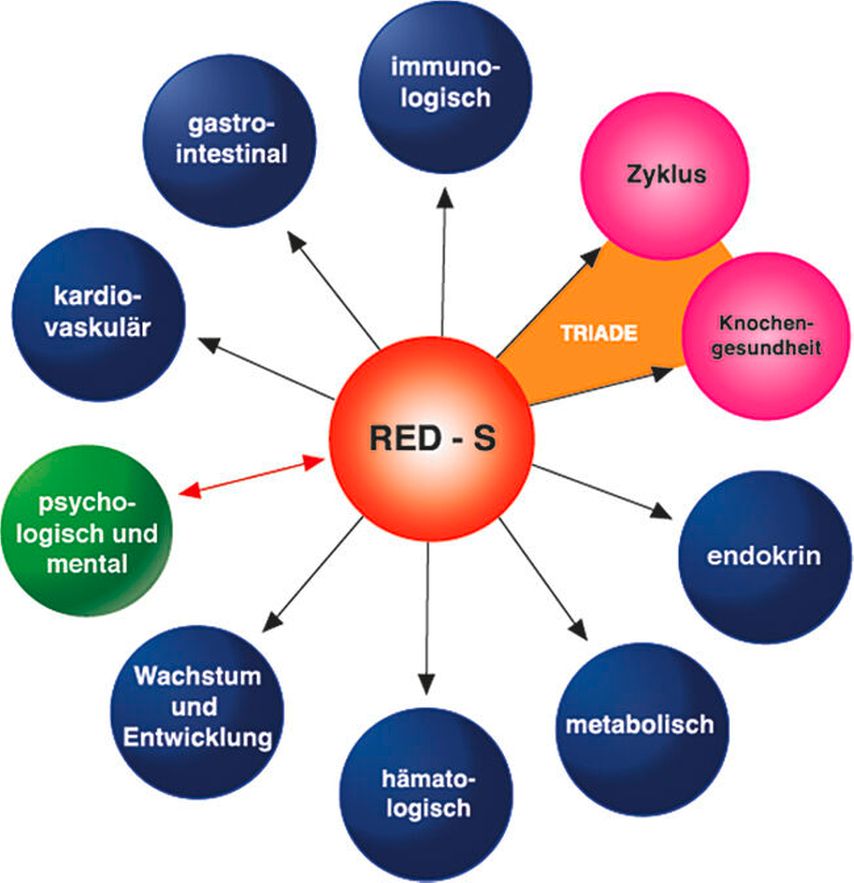
Das Symptombild des RED-S ist mannigfaltig und beinhaltet gesundheitliche, psychische und leistungsphysiologische Konsequenzen (Abb.3). Das klinische Korrelat der gestörten Hypothalamus-Hypophysen-Gonadenachse beinhaltet Zyklusstörungen unterschiedlichen Ausmasses, reichend von der ovulatorischen Eumenorrhö über subklinische Zyklusstörungen (Lutealphasendefekt, anovulatorische Zyklen) bis zur funktionellen hypothalamischen Oligo- und Amenorrhö.12 Die Prävalenz für die Amenorrhö beträgt je nach Sportart 12–79%,13 verglichen mit 3–4% in der Normalbevölkerung.14
Diese Daten beruhen hauptsächlich auf Selbsteinschätzungen mittels Menstruationsfragebögen. Es wird davon ausgegangen, dass bei den «scheinbar» regelmässig menstruierenden Sportlerinnen weitere 50% von unbemerkten subklinischen Zyklusstörungen betroffen sind.15 Die gestörte ovarielle Funktion bedingt verminderte Östrogenspiegel, die mit kurz-, aber auch langfristigen, teils irreversiblen Folgen verbunden sein können. Durch den Östrogenmangel demineralisiert der Knochen und es entfällt der kardioprotektive Effekt, was ein ungünstiges Lipidprofil mit endothelialer Dysfunktion und sogar eine frühe Atherosklerose begünstigen kann.16
Weiter wurden bei amenorrhöischen Athletinnen neurologische und kognitive Einschränkungen (insb. Konzentrationsstörungen, verminderte Reaktionsfähigkeit, eingeschränkte neuromuskuläre Koordination) und urogynäkologische Beschwerden (Inkontinenz, vaginale Atrophie) beschrieben.17 Die hypothalamische Suppression kann sich ausserdem in einem Hypothyreoidismus manifestieren.18
Erniedrigte Leptin-, Freies-Trijodthyronin(fT3-) und IGF-1-Konzentrationen in Kombination mit erhöhten Ghrelin- und Kortisolkonzentrationen sind Hinweiseauf ein schweres Energiedefizit.19 Diese metabolischen Anpassungen drosseln den Grundumsatz und erlauben dem Körper, Energie zu konservieren.4,9 So kann eine Athletin trotz eines normalen Körpergewichts und -fettanteils dennoch eine deutlich gestörte Physiologie im Sinne eines RED-S aufweisen.20
Eisenmangelanämien treten gehäuft auf und gelten als Marker für Energiemangelzustände bei Sportlern.21Der Ferritinmangel unterhält ein Energiedefizit direkt und indirekt via appetitzügelnden Effekt und der herabgesetzten metabolischen Effizienz.22
Athletinnen mit RED-S leiden häufiger unter wiederkehrenden Infektionen der oberen Atemwege aufgrund der geschwächten Immunfunktion, die sich in verminderten IgA-Konzentrationen des Speichels widerspiegelt.23
Was den psychiatrischen Formenkreis betrifft, werden vermehrt milde Depressionen, psychosomatische Störungen, Essstörungen und eine reduzierte Stressintoleranz beobachtet. Die Prävalenz von Essstörungen ist bei Sportlerinnen (13,5%) im Vergleich zur Normalbevölkerung (4,5%) erhöht.24 Diese können dem RED-S vorausgehen oder vice versa.25
Die initiale kurzfristige Leistungssteigerung durch Gewichtsreduktion muss längerfristig mit leistungsphysiologischen Einschränkungen bezahlt werden. Dazu gehören die Verminderung von Ausdauerfähigkeit, Trainingsantwort, Glykogenreserven, Proteinsynthese, Muskelkraft und Koordinationsvermögen wie auch eine erhöhte Verletzungsanfälligkeit.26
Diagnostik bei oligo- und amenorrhöischen Sportlerinnen
Die Art der Zyklusstörung erlaubt eine Aussage über das Ausmass der Follikelreifungsstörung. Somit entspricht die Corpus-luteum-Insuffizienz einer leichten und die Amenorrhö einer kompletten Follikelreifungsstörung. Die häufig bei Sportlerinnen auftretende funktionell hypothalamische Oligo- und Amenorrhö entspricht einer Ausschlussdiagnose und bedarf einer ausführlichen gynäkologisch-endokrinologischen Abklärung. Eine vor Kurzem durchgeführte Untersuchung bei 83 oligo- und amenorrhöischen Athletinnen ohne klinische Androgenisierungszeichen entdeckte bei 17% der Athletinnen einen verkannten Hyperandrogenismus, da dieser durch regelmässige sportliche Betätigung, aber auch durch ein Energiedefizit gemindert und maskiert werden kann.27
Das Fundament der Amenorrhöabklärung bildet eine ausführliche Anamnese mit Berücksichtigung neurologischer Beschwerden, Virilisierungszeichen (Hirsutismus, Akne, Alopezie) und niedrigschwelliger Stressoren (Schlaf, Gewichtsfluktuationen, Affekt, beruflich, psychosozial). Die klinische Untersuchung umfasst die Bestimmung der Körpermasse (Gewicht, Grösse, BMI, ggf. Körperfettanteil) und eine gynäkologische Untersuchung mit Augenmerk auf die Ausprägung der sekundären Geschlechtsmerkmale (Pubertätsstadien nach Tanner) als auch einer sonografischen Beurteilung des inneren Genitales zum Ausschluss von erworbenen (Synechien) oder kongenitalen Fehlbildungen. Die Diagnostik wird ergänzt durch eine laborchemische Basisuntersuchung mitsamt Blutbild, Bestimmung von follikelstimulierendem Hormon (FSH), luteinisierendem Hormon (LH), Prolaktin, Thyreoidea-stimulierendem Hormon (TSH), freiem Tetraiodthyronin (fT4), freiem Trijodthyronin (fT3), Gesamttestosteron, Dehydroepiandrosteronsulfat (DHEA-S), Estradiol (E2), Kortisol, Anti-Müller-Hormon (AMH), 17α-Hydroxyprogesteron (17-OHP), Thyreoperoxidase-Antikörpern (Anti-TPO), Lipiden, Insulin, Blutzucker, Calcidiol (25-Hydroxy-Vitamin-D3), Kalium, Natrium, Holotranscobalamin, Vitamin B12, Ferritin und CRP (C-reaktives Protein). Die Laboruntersuchung soll bei nüchterner Patientin frühmorgendlich, frühzyklisch (1.–5. Zyklustag) und stets durch das gleiche Labor durchgeführt werden – aufgrund der potenziellen Messungenauigkeit in der Steroidhormonanalytik insbesondere bei geringen Hormonkonzentrationen.28 Die Laboranalyse wird mit endokrinologischen Funktionstests (Gestagen-, Östrogen-Gestagen-, ggf. GnRH-Test) komplettiert.
Bei Vorliegen einer Hyperprolaktinämie und fokalen neurologischen Symptomen ist eine Bildgebung mittels MRT (Magnetresonanztomografie) der Hypophysenregion indiziert. Ein MRT soll weiter bei geringer Östrogenität (Endometriumdicke <6mm, negativer Gestagentest, E2 <40pg/ml, LH/FSH-Ratio <1) trotz Fehlen einer neurologischen Komponente grosszügig indiziert werden. Zeigt das MRT in dieser Situation keine Auffälligkeiten, so kann von einer hypothalamisch-hypophysären Taktstörung ausgegangen werden, welche mittels GnRH-Test final weiter differenziert werden kann.29
Ab einer Amenorrhödauer von >6 Monaten wird eine Knochendichtenmessung mittels «dual energy x-ray absorptiometry» (DXA) empfohlen. Diese kann bei Verdacht auf ein ausgeprägtes Energiedefizit (schweres Untergewicht, anamnestisch Insuffizienzfrakturen) bereits früher erwogen werden12 und soll bei Persistenz des Energiedefizits 12-monatlich durchgeführt werden.1 Die diagnostischen Schritte beider primären Amenorrhö (keine Menarche bis zum 16. Lebensjahr) unterscheiden sich ein wenig von derjenigen bei der sekundären Amenorrhö (Ausbleiben der Menstruation über 3 Monate bei vorher regelmässigem Zyklus). Bei der primären Amenorrhö sind zusätzlich die Bestimmung des Knochenalters und ggf. eine Karyotypisierung zum Ausschluss chromosomaler Aberrationen erforderlich.
Management der Zyklusstörungen bei RED-S
Die Wiederherstellung einer ausgeglichenen Energiebilanz zum Wiedererreichen eines regelmässigen Zyklus birgt einige Herausforderungen sowohl für die Athletin als auch den Betreuungsstab. Daher lohnt es sich, mit der Athletin einen multimodalen Behandlungsplan mitsamt Zielvereinbarungen und Zeithorizont zu formulieren.30 Die Athletin soll über die Pathophysiologie des RED-S aufgeklärt werden, insbesondere auch darüber, dass trotz wiederhergestellter EV eine Latenz von 12 Monaten bis zum Wiedereinsetzen der Menstruation zu erwarten ist.31 In einer 5-jährigen retrospektiven Untersuchung bei College-Sportlerinnen war die Gewichts- und BMI-Zunahme der beste Prädikator für das Wiedereintreten einer regelmässigen Menstruation.31
Mikronährstoffmängel sollen substituiert werden. So wird bei inadäquater Kalziumzufuhr (<1300mg/d) die kombinierte Substitution von Kalzium mit Vitamin D empfohlen.32 Mittels sportspezifischer Ernährungsberatung soll die Kalorieneinnahme ermittelt und adäquat angepasst werden,3 da diese den Haupteffekt zur Störung der Hormonachse beiträgt. Nicht selten fehlt den Sportlern dazu dasspezifische Wissen. Beispielsweise kann bei einer vermeintlich gesunden Ernährung mit niedrigem glykämischem Index und hohem Fasergehalt die Kalorienresorption sowohl aufgrund verlangsamter Resorption als auch gesteigerter Darmmotilität zusätzlich kompromittiert werden.33
Je nach Schwere der Symptomatik empfiehlt sich eine Trainingsanpassung. Neben der Ernährungssituation soll den niederschwelligen Stressoren (Schlaf, Arbeit, psychosozial) Beachtung geschenkt werden und bei Bedarf eine kognitive Verhaltenstherapie oder eine anderweitige psychologische Anbindung erwogen und angeboten werden.34
Von der Anwendung kombinierter oraler Kontrazeptiva wird abgeraten, da diese ein persistierendes Energiedefizit weiter maskieren können, ohne die Knochendichte zu verbessern.12,35
Bei der amenorrhöischen Athletin mit unauffälliger Knochendichte erfolgt im ersten Schritt ein nichtpharmakologisches Vorgehen.12 Die Indikation zur pharmakologischen Therapie ist gegeben bei Vorliegen einer Osteopenie (Z-Wert <–1SD),sie soll bei persistierender Amenorrhö trotz normaler Knochendichte ebenso mit der Patientin diskutiert werden, zur Prävention eines weiteren Verlustes der Knochenmatrix wie auch weiterer potenzieller Langzeitfolgen betreffend der Kognition36 und des kardiovaskulären Systems. Die hormonelle Substitution erfolgt bevorzugt mittels transdermaler Gabe von standarddosiertem 17β-Estradiol (z.B. als Patch) in Kombination mit einem sequenziell oder kontinuierlich verabreichten Gestagen. Die Substitution von transdermalem 17β-Estradiol mit einem Gestagen ist eine nützliche Massnahme zur Verbesserung der Knochenparameter bei Athletinnen mit funktioneller hypothalamischer Oligo- und Amenorrhö.37–39
Persistiert jedoch das Energiedefizit, so kann auch eine Hormonsubstitution die östrogenunabhängigen, auf den Knochen katabol wirkenden Botenstoffe (z.B. Hyperkortisolismus, erniedrigte Leptin-, IGF-1- und Testosteronkonzentrationen) nicht vollumfänglich kompensieren. Daher ist eine komplette Rekonvaleszenz des Energiestatus unabdingbar. Die Athletinnen zu diesem Schritt zu motivieren ist ein weiterer Teil unserer ärztlichen Aufgabe.
Literatur:
1 Nattiv A et al.: American College of Sports Medicine position stand. The female athlete triad. Med Sci Sports Exerc 2007; 39(10): 1867-82 2 Caronia LM et al.: A genetic basis for functional hypothalamic amenorrhea. N Engl J Med 2011; 364(3): 215-25 3 Loucks AB et al.: Low energy availability, not stress of exercise, alters LH pulsatility in exercising women. J Appl Physiol (1985) 1998; 84(1): 37-46 4 De Souza MJ et al.: High frequency of luteal phase deficiency and anovulation in recreational women runners: blunted elevation in follicle-stimulating hormone observed during luteal-follicular transition. J Clin Endocrinol Metab 1998; 83(12): 4220-32 5 Loucks AB, Thuma JR: Luteinizing hormone pulsatility is disrupted at a threshold of energy availability in regularly menstruating women. J Clin Endocrinol Metab 2003; 88(1): 297-311 6 Wade GN et al.: Control of fertility by metabolic cues. Am J Physiol 1996; 270(1 Pt 1): E1-19 7 Kinsey-Jones JS et al.: Down-regulation of hypothalamic kisspeptin and its receptor, Kiss1r, mRNA expression is associated with stress-induced suppression of luteinising hormone secretion in the female rat. J Neuroendocrinol 2009; 21(1): 20-9 8 Misra M: Neuroendocrine mechanisms in athletes. Handb Clin Neurol 2014; 124: 373-86 9 Slater J et al.: Female recreational exercisers at risk for low energy availability. Int J Sport Nutr Exerc Metab 2016; 26(5): 421-7 10 Torstveit MK, Sundgot-Borgen J: The female athlete triad: are elite athletes at increased risk? Med Sci Sports Exerc 2005; 37(2): 184-93 11 Loucks AB et al.: Energy availability in athletes. J Sports Sci 2011; 29 Suppl 1: S7-15 12 Gordon CM et al.: Functional hypothalamic amenorrhea: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2017; 102(5): 1413-39 13 Gibbs JC et al.: Prevalence of individual and combined components of the female athlete triad. Med Sci Sports Exerc 2013; 45(5): 985-96 14 Bachmann GA, Kemmann E: Prevalence of oligomenorrhea and amenorrhea in a college population. Am J Obstet Gynecol 1982; 144(1): 98-102 15 De Souza MJ et al.: High prevalence of subtle and severe menstrual disturbances in exercising women: confirmation using daily hormone measures. Hum Reprod 2010; 25(2): 491-503 16 Rickenlund A et al.: Amenorrhea in female athletes is associated with endothelial dysfunction and unfavorable lipid profile. J Clin Endocrinol Metab 2005; 90(3): 1354-9 17 Tornberg ÅB et al.: Reduced neuromuscular performance in amenorrheic elite endurance athletes. Med Sci Sports Exerc 2017; 49(12): 2478-85 18 Melin A et al.: Energy availability and the female athlete triad in elite endurance athletes. Scand J Med Sci Sports 2015; 25(5): 610-22 19 Koehler K et al.: Less-than-expected weight loss in normal-weight women undergoing caloric restriction and exercise is accompanied by preservation of fat-free mass and metabolic adaptations. Eur J Clin Nutr 2017; 71(3): 365-71 20 Burke LM et al.: Pitfalls of conducting and interpreting estimates of energy availability in free-living athletes. Int J Sport Nutr Exerc Metab 2018; 28(4): 350-63 21 Ackerman KE et al.: Low energy availability surrogates correlate with health and performance consequences of relative energy deficiency in Sport. Br J Sports Med 2019; 53(10): 628-33 22 Petkus DL et al.: The unexplored crossroads of the female athlete triad and iron deficiency: a narrative review. Sports Med 2017; 47(9): 1721-37 23 Drew M et al.: Prevalence of illness, poor mental health and sleep quality and low energy availability prior to the 2016 Summer Olympic Games. Br J Sports Med 2018; 52(1): 47-53 24 Martinsen M, Sundgot-Borgen J: Higher prevalence of eating disorders among adolescent elite athletes than controls. Med Sci Sports Exerc 2013; 45(6): 1188-97 25 Mountjoy M et al.: IOC consensus statement on relative energy deficiency in sport (RED-S): 2018 update. Br J Sports Med 2018; 52(11): 687-97 26 Warren MP: Endocrine manifestations of eating disorders. J Clin Endocrinol Metab 2011; 96(2): 333-43 27 Koltun KJ et al.: Discriminating hypothalamic oligomenorrhea/amenorrhea from hyperandrogenic oligomenorrhea/amenorrhea in exercising women. Appl Physiol Nutr Metab 2020; 45(7): 707-14 28 Rosner W et al.: Challenges to the measurement of estradiol: an endocrine society position statement. J Clin Endocrinol Metab 2013; 98(4): 1376-87 29 von Wolff M, Stute PS: Gynäkologische Endokrinologie und Reproduktionsmedizin. Das Praxisbuch. Schattauer 2013; S. 478 30 Mountjoy M et al.: RED-S CAT. Relative energy deficiency in sport (RED-S) clinical assessment Tool (CAT). Br J Sports Med 2015; 49(7): 421-3 31 Arends JC et al.: Restoration of menses with nonpharmacologic therapy in college athletes with menstrual disturbances: a 5-year retrospective study. Int J Sport Nutr Exerc Metab 2012; 22(2): 98-108 32 Bergeron MF et al.: International Olympic Committee consensus statement on youth athletic development. Br J Sports Med 2015; 49(13): 843-51 33 Melin A et al.: Low-energy density and high fiber intake are dietary concerns in female endurance athletes. Scand J Med Sci Sports 2016; 26(9): 1060-71 34 Berga SL et al.: Recovery of ovarian activity in women with functional hypothalamic amenorrhea who were treated with cognitive behavior therapy. Fertil Steril 2003; 80(4): 976-81 35 Goshtasebi A et al.: Adolescent use of combined hormonal contraception and peak bone mineral density accrual: A meta-analysis of international prospective controlled studies. Clin Endocrinol (Oxf) 2019; 90(4): 517-24 36 Baskaran C et al.: Estrogen replacement improves verbal memory and executive control in oligomenorrheic/amenorrheic athletes in a randomized controlled trial. J Clin Psychiatry 2017; 78(5): e490-7 37 Ackerman KE et al.: Effects of estrogen replacement on bone geometry and microarchitecture in adolescent and young adult oligoamenorrheic athletes: a randomized trial. J Bone Miner Res 2020; 35(2): 248-60 38 Ackerman KE et al.: Oestrogen replacement improves bone mineral density in oligo-amenorrhoeic athletes: a randomised clinical trial. Br J Sports Med 2019; 53(4): 229-36 39 Singhal V et al.: Impact of route of estrogen administration on bone turnover markers in oligoamenorrheic athletes and its mediators. J Clin Endocrinol Metab 2018; 104(5): 1449-58
Das könnte Sie auch interessieren:
Standard oder ein verzichtbarer Mehraufwand?
Die durchschnittliche Patientin mit einer zervikalen intraepithelialen Neoplasie (CIN) ist im reproduktiven Alter, im Mittel 30 Jahre alt und tendenziell werden die Patientinnenimmer jünger.1 Nahezu jede Exzisionsart an der Zervix uteri ist mit einer erhöhten perinatalen Morbidität behaftet. Die LLETZ («large loop excision of the transformation zone») und die LEEP («loop ...
Neues zur Prävention rezidivierender Harnwegsinfektionen
Ob in der Hausarztpraxis oder beim Spezialisten: Harnwegsinfektionen sind häufig. Gemäss dem Expertenbrief No.58 der Schweizerischen Gesellschaft für Gynäkologie und Geburtshilfe ist die ...
Betroffenheit oder Gefährdung erkennen und Hilfe leisten
Die weibliche Genitalbeschneidung (FGM/C) ist infolge der Migration aus praktizierenden Ländern auch in der Schweiz eine Realität. Insbesondere Gesundheitsfachpersonen kommen mit ...