
Abnorm invasive Plazenta erkennen
Klinische Abteilung für Geburtshilfe<br>und feto-maternale Medizin<br>Universitätsklinik für Frauenheilkunde<br>Medizinische Universität Wien<br>E-Mail: kinga.chalubinski@akhwien.at
Die Inzidenz einer abnorm invasiven Plazenta (AIP) hat in den vergangenen Jahren, vorwiegend als Resultat der steigenden Sectiorate, stark zugenommen. Durch gezielte pränatale Abklärung der Risikopatientinnen kann die Häufigkeit von Blutungsnotfällen (unter personell und apparativ suboptimalen Bedingungen) reduziert werden, da die rechtzeitig diagnostizierte AIP eine entsprechende Vorplanung des interdisziplinären Managements ermöglicht.
Die Aussagekraft des Ultraschalls wird in der Literatur mit sehr hoher Sensitivität und Spezifität (91–97%) beschrieben. Die Nomenklatur der Auffälligkeiten wurde jedoch in den publizierten Studien nicht einheitlich definiert und die diagnostische Zuverlässigkeit war von der Erfahrung des Untersuchers abhängig, somit auf eine Beurteilung durch ausgewiesene Experten angewiesen.
Die sonomorphologischen Auffälligkeiten sind zwar sehr typisch, jedoch die exakte AIP-Stufenzuordnung der Implantationsstörung war und ist bis dato meist dem Spezialisten vorbehalten. Bei der derzeit so rapide steigenden Inzidenz ist es jedoch wichtig, dass nicht nur ein Plazentaexperte die abnorm tiefe Invasion erkennt, sondern dass schon in der Primärversorgung ein eventueller Verdacht erhoben und dann die Risikopatientin einem entsprechenden Zentrum zugewiesen wird. Daher wurde 2016 von den Mitgliedern der European Working Group on Abnormally Invasive Placenta (EW-AIP) ein Konsensus mit einer Deskription von typischen Ultraschallmarkern erarbeitet, um eine Klarheit der diagnostischen Kriterien zu erreichen und damit die Diagnosefähigkeit für weniger Erfahrene zu vereinfachen und zu verbessern.
Der erstellten Liste von Ultraschallkriterien entnommen, weisen folgende Auffälligkeiten auf eine Plazentaimplantationsstörung hin, wobei das Invasionsausmaß von der Intensität dieser Marker abhängt.
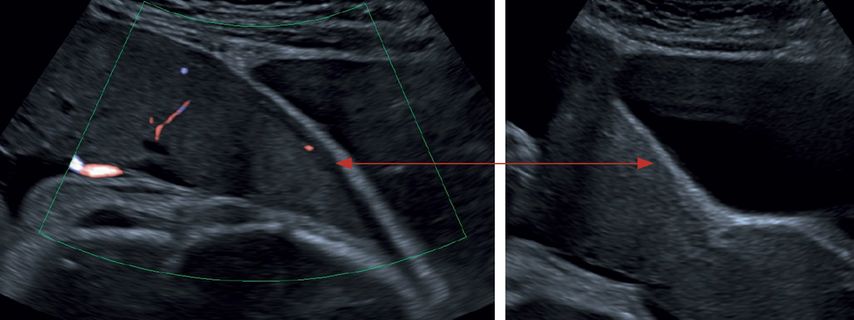
Abb. 1: Verlust der echoarmen subplazentaren Zone, Norm (links) versus Verlust (rechts)
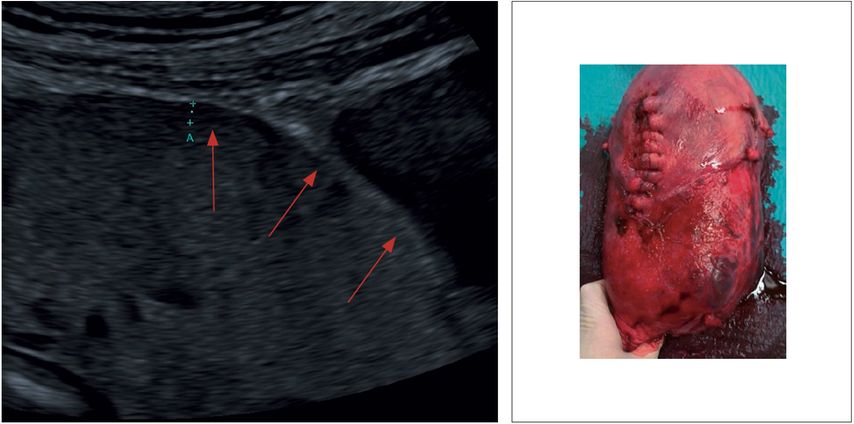
Abb. 2: Ausdünnung oder Verlust der subplazentaren Myometriumschicht
2D (B-Bild)
-
„Loss of ‚clear zone‘“ – Verlust der subplazentaren hypoechogenen Zone (Abb.1)
-
„Myometrial thinning“ – Myometriumschicht unterhalb der Plazenta ist stark verdünnt bzw. nicht mehr nachweisbar (Abb.2)
-
„Abnormal placental lacunae“ – große, irregulär aufgebaute intraplazentare Lakunen mit turbulentem Fluss (Abb.3)
-
„Bladder wall interruption“ – Verlust der hyperdensen Abgrenzung zwischen Uterusserosa und Harnblase (Abb.4)
-
„Placental bulge“ – Ausbuchtung der Plazenta in die Harnblase, wobei die Serosa intakt imponiert, jedoch die Außenlinie verzogen ist (Abb.5)
-
„Focal exophytic mass“ – Durchbruch von Plazentagewebe durch die Uterusserosa (Abb.6)
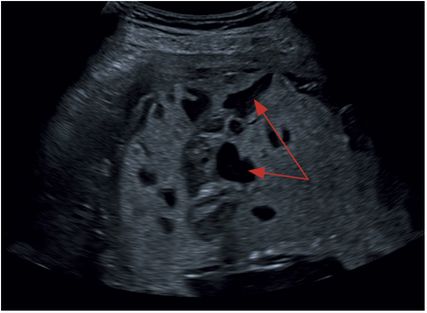
Abb. 3: Zahlreiche intraplazentare Gefäßlakunen
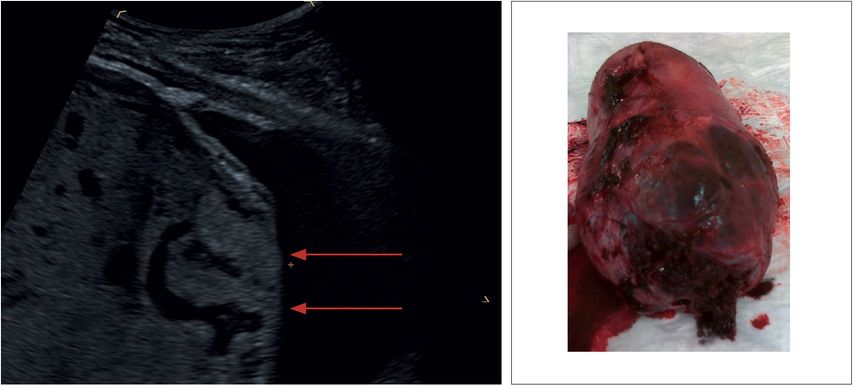
Abb. 4: Verlust/Unterbrechung der hyperechogenen Begrenzung zwischen Uterusserosa und Blasenwand
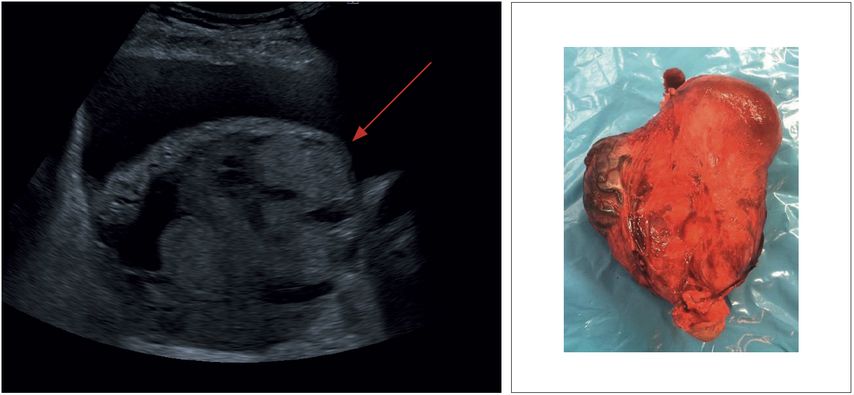
Abb. 5: Bulge: abnormale Ausbuchtung des Plazentagewebes in die Harnblase (Uterusserosa intakt)
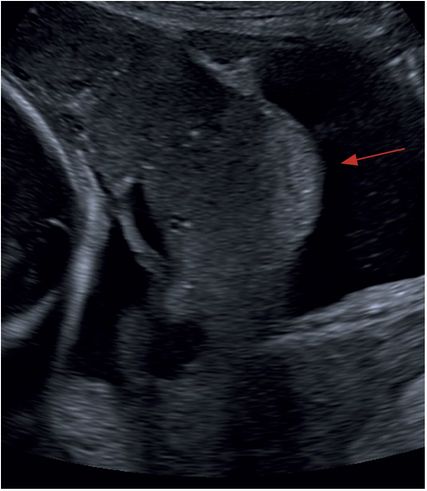
Abb. 6: Durchbruch von Plazentagewebe in die Harnblase
2D (Farbdoppler)
-
„Uterovesical hypervascularity“ – deutliche Neovaskularisation am Übergang der retrovesikalen Uterusserosa und Blasenwand; es zeigen sich zahlreiche Gefäßformationen mit Aliasing-Artefakten im Farbdoppler (Abb.7)
-
„Subplacental hypervascularity“ – verstärkte Durchblutung im Plazentabett mit irregulärem Gefäßverlauf und multidirektionaler Strömung (Abb.8)
-
„Bridging vessels“ – Gefäßausdehnungen über die Plazenta hinaus, welche oft senkrecht durch das Myometrium verlaufen und ggf. in die umgebenden Organe, v.a. in die Harnblase, hineinragen (Abb.9)
-
„Placental lacunae feeder vessels“ – Gefäße mit hohen Flussgeschwindigkeiten, welche vom Myometrium ausgehend in den intraplazentaren Lakunen münden(Abb.10)
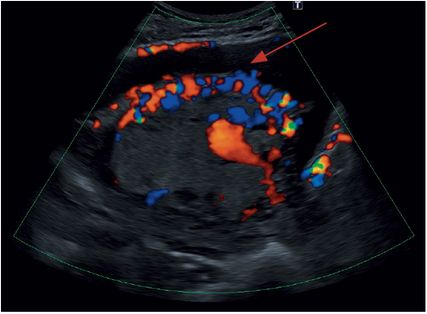
Abb. 7: Uterovesikale Hypervaskularisation
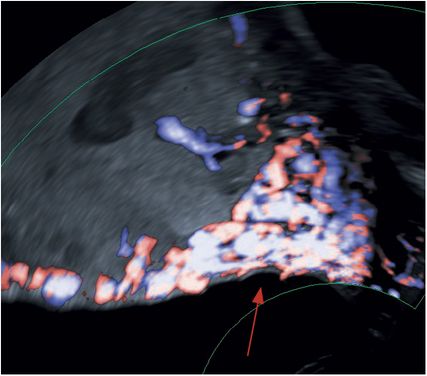
Abb. 8: Subplazentare Hypervaskularisation
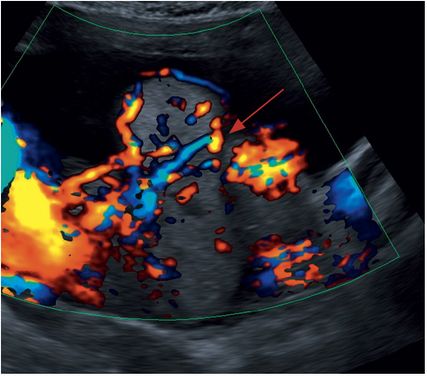
Abb. 9: „Bridging vessels“
Je intensiver die genannten sonomorphologischen Charakteristika imponieren, desto ausgeprägter ist auch das Ausmaß der Implantationsstörung. Somit ist auch schon präpartal eine gröbere Zuordnung der Tiefenausprägung möglich. Eine exakte Einteilung der pathologischen Invasionstiefe kann jedoch erst durch eine makroskopisch-intraoperative sowie eine histopathologische Aufarbeitung des Hysterektomiepräparats erfolgen. Eine Publikation im Int. Journal of Gynaecology & Obstetrics 2019 beschreibt die aktuelle Stufeneinteilung nach FIGO (Fédération Internationale de Gynécologie et d’Obstétrique):
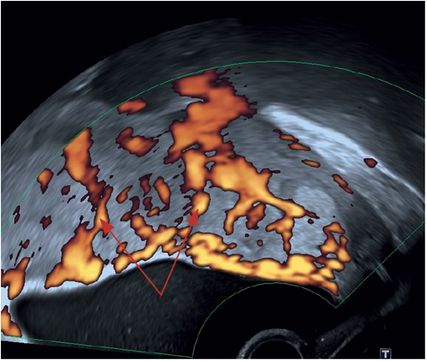
Abb. 10: „Feeder vessels“
-
Grad 1: abnorm adhärente Plazenta (accreta) ohne wesentliche Gefährdung der Mutter
-
Grad 2: abnorm invasive Plazenta (increta)
-
Grad 3: abnorm invasive Plazenta (percreta) mit 3 Unterstufen: a) bis zur Uterusserosa, b) mit Blaseninvasion, c) mit Verbreitung im kleinen Becken
Dank der Standardisierung der sonografischen Charakteristika ist ein diagnostisches Scoring auch im niedergelassenen Bereich im Rahmen der Schwangerenbetreuung möglich. Bei der primären Begutachtung einer Patientin mit anamnestischen Risikofaktoren geht es nicht um eine im Vorhinein hochspezialisierte Untersuchung, sondern um ein Augenmerk auf die Lokalisation und Struktur der Plazenta. Falls es sich um eine Plazenta praevia handelt und/oder die Implantation einem intrakavitären Narbenbereich anliegt, ist auf mögliche Zeichen eines abnorm invasiven Plazentawachstums zu achten, um bei erhobenem Verdacht die Patientin zur weiteren Abklärung und gegebenenfalls auch Betreuungsübernahme an ein tertiäres Zentrum zu überweisen.
Das Zitat von Sally Collins, einer britischen AIP-Expertin aus Oxford, beinhaltet die wesentlichste Conclusio: „Maternal mortality and morbidity associated with AIP are reduced when cases are delivered in a tertiary referral centre with an experienced multi-disciplinary team. Referral to such a team depends on the prenatal diagnosis of AIP by the primary healthcare providers.“
Die Inhalte dieses Artikels waren Thema bei der virtuellen Herbsttagung der Österreichischen Gesellschaft für Gynäkologie und Geburtshilfe (OEGGG) im September 2020.
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
Standard oder ein verzichtbarer Mehraufwand?
Die durchschnittliche Patientin mit einer zervikalen intraepithelialen Neoplasie (CIN) ist im reproduktiven Alter, im Mittel 30 Jahre alt und tendenziell werden die Patientinnenimmer jünger.1 Nahezu jede Exzisionsart an der Zervix uteri ist mit einer erhöhten perinatalen Morbidität behaftet. Die LLETZ («large loop excision of the transformation zone») und die LEEP («loop ...
Neues zur Prävention rezidivierender Harnwegsinfektionen
Ob in der Hausarztpraxis oder beim Spezialisten: Harnwegsinfektionen sind häufig. Gemäss dem Expertenbrief No.58 der Schweizerischen Gesellschaft für Gynäkologie und Geburtshilfe ist die ...
Betroffenheit oder Gefährdung erkennen und Hilfe leisten
Die weibliche Genitalbeschneidung (FGM/C) ist infolge der Migration aus praktizierenden Ländern auch in der Schweiz eine Realität. Insbesondere Gesundheitsfachpersonen kommen mit ...


