Welcher Patient mit Erkrankung des Verdauungstraktes braucht wirklich eine Diät?
Autor:
Prof. Dr. med. Harald Vogelsang
Klinische Abteilung für Gastroenterologie und Hepatologie
Universitätsklinik für Innere Medizin III
Medizinische Universität Wien/Allgemeines Krankenhaus Wien
E-Mail: ordination@vogelsang.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In den letzten Jahren ist der Wunsch der Menschen nach gesunden und heilenden Diäten deutlich grösser geworden. Allerdings ist nur bei einer geringen Zahl der gastrointestinalen Erkrankungen (GI-Erkrankungen) die Wirksamkeit bzw. die Notwendigkeit dieser speziellen Ernährungsweisen wissenschaftlich nachgewiesen.
Keypoints
-
Wird bei einer Zöliakie eine strikte, lebenslange und glutenfreie Diät nicht eingehalten, steigt das Risiko für intestinale Malignome und Lymphome.
-
Bei Nahrungsmittelintoleranz bzw. -malabsorption zeigt sich oft kein gutes Ansprechen auf die Einhaltung nahrungsmittelspezifischer Diäten.
-
Die «6-food elimination diet» kann zu einer starken Symptomreduktion und Befundverbesserung bei eosinophiler Ösophagitis beitragen.
-
Bei vielen GI-Erkrankungen spielt die Diversität des Mikrobioms eine entscheidende Rolle, wobei sich die FODMAP-freie/-arme Diät vor allem beim Reizdarmsyndrom bewährt hat. Die Diätempfehlungen bei CED sind generell im Wandel.
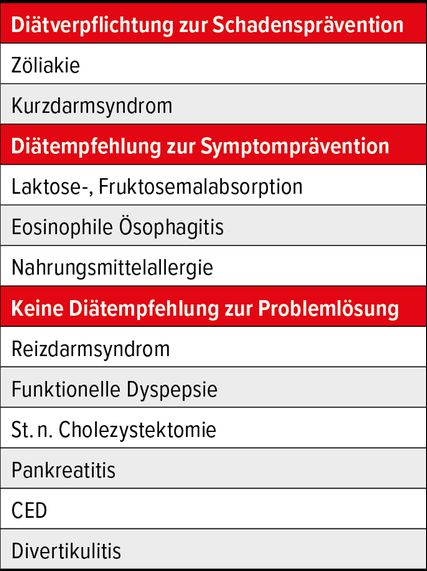
Entsprechend der Literatur kann man die Diätenrelevanz verschiedener GI-Erkrankungen grob in drei Gruppen einteilen (Tab.1).
Zöliakie
Bei der Zöliakie kommt es unter einer strikten glutenfreien Diät zum klinischen Ansprechen und Abheilen der Duodenalschleimhaut.1 Während die spezifischen Antikörper wie IgA-TTG («tissue transglutaminase») und -EMA («endomysial antibodies») meist innerhalb von 3 bis 6 Monaten schwinden, kann die mukosale Normalisierung auch mehr als 2 Jahre (40%) dauern. Die nicht immer vorhandenen Bauchsymptome (nur bei 40% der Diagnosen) – sonst stumme Zöliakie – vergehen beim Erwachsenen innert weniger Wochen bei strikter glutenfreier Diät. Bei Nichteinhalten der Diät kann es zu Komplikationen, wie Mangelzuständen bis zu osteoporotischen Frakturen, Abort und vor allem intestinalen Lymphomen, kommen. Das erhöhte Risiko für intestinale Malignome und Lymphome ist letztendlich das stärkste Argument für die strikte lebenslange glutenfreie Diät, da die Mortalität gemäss neuster Studien in den ersten zwei Jahren unter glutenfreier Diät deutlich zurückgeht.2
Kurzdarmsyndrom
Es gibt verschiedene Typen des Kurzdarmsyndroms, je nach vorangegangener Operation: Jejunostomie, Jejunum-Kolonanastomose, Jejunum-Ileum-Kolonanastomose. Hier gilt besonders für die Jejunostomie mit <100cm Restjejunum eine Gefährdung für eine intestinale Insuffizienz ohne Adaptationsfähigkeit. Bei all diesen Operationen ist bei einem Restdünndarm <2m auf eine genaue «Kurzdarmdiät» zu achten, wobei insbesondere hyperosmolare Zuckerlösungen zu meiden sind, da diese einen Nettoverlust an Flüssigkeit nach sich ziehen können und eher kleine, hochkalorische Mahlzeiten zu empfehlen sind.3 Die Diät richtet sich auch sehr nach der Phase, in der sich der Kurzdarmpatient gerade postoperativ befindet: Hier sind die hypersekretorische Phase (bis 3 Monate postoperativ), die adaptive Phase, die Stabilisierungs- oder die Insuffizienzphase zu berücksichtigen. Aufgrund der Seltenheit und der sehr verschiedenen individuellen Situationen gibt es keine Vergleichsstudien zu den Diäten. Der Sinn der Diäten ist aber pathophysiologisch begründet. Eine Unterstützung durch eine Ernährungsberaterin ist nahezu immer verpflichtend.
Intoleranzen
Laktosemalabsorption
Die Laktosemalabsorption (50-g-Laktose-H2-Test, LCT-Gentest) ist eigentlich keine Erkrankung, sondern eine genetisch autosomal-rezessiv vererbte Veranlagung (in Österreich bei ca. 25% der Bevölkerung). Viele Betroffene verspüren nach der Aufnahme von stark laktosehaltigen Nahrungsmitteln (>15g) aber nur geringe Beschwerden, wie Blähungen, Bauchschmerzen und Diarrhö. Andere leiden mehr, wahrscheinlich durch die spezielle viszerale Hypersensitivität aufgrund eines Reizdarmsyndroms (RDS). Diese Menschen werden allerdings auch durch alleiniges Meiden der Laktose nicht beschwerdefrei, kleine Verbesserungen sind jedoch möglich. Der Nachweis der Laktosemalabsorption allein – oder eher das Auftreten von Symptomen beim Test – korreliert nicht gut mit dem Ansprechen auf eine laktosefreie Diät.4
Fruktosemalabsorption
Die Häufigkeit der Fruktosemalabsorption in der Bevölkerung (25-g-Fruktose-H2-Test; leider kein Gentest verfügbar) dürfte, je nach Kollektiv, zwischen 10 und 40% liegen. Es gilt hier Ähnliches wie bei der Laktoseintoleranz, und zwar dass RDS-Patienten durch alleinige Diät nicht beschwerdefrei werden. Besonders nach Umstellung auf gesunde, obstreiche Kost, wie Äpfel, Birnen, Mangos, Wassermelonen und auch Honig, können Symptome verstärkt auftreten.
Nahrungsmittelallergien
Diese sind im Erwachsenenalter deutlich seltener als im Kindesalter (ca. bei 2–10%) und können teilweise durch den Prick- und IgE-Rast-Test für ausgewählte Nahrungsmittel bestätigt oder mit Mikrochipanalysen genauer spezifiziert werden. Am häufigsten sind Nuss-, Fisch- und Milchallergien.5 Je nach Symptomatik – vom oralen Allergiesyndrom über GI-Symptome bis zur Anaphylaxie – sind die Diäten lockerer bis strikter einzuhalten.
Eosinophile Ösophagitis
Sie wird bei 0,5–1/1000 Personen durch Biopsien aus dem Ösophagus diagnostiziert und kontrolliert.
Wenngleich es bei vielen unter Diät zu keiner Remission kommt, so zeigt eine empirisch oder durch IgE-Test gefundene Diät eine starke Symptom- und Befundverbesserung, meist durch eine «6-food elimination diet» (6-FED) ) ohne Milch, Weizen, Ei, Soja, Nüsse und Fisch. Diese kann evtl. auch auf eine 4- oder 2-FED reduziert werden. Daneben wird die orale Budesonidtherapie – nach primärer Protonenpumpeninhibitorentherapie – aber immer mehr zum Standard.6
Reizdarmsyndrom (RDS)
Obwohl die meisten Patienten mit RDS nach einer heilenden Diät suchen, sind Therapieerfolge selbst nach nachgewiesener Nahrungsmittelmalabsorption/-intoleranz (z.B. Laktose-, Fruktosemalabsorption) durch Diät selten, sondern treten eher nur bei Symptomen während des H2-Tests ein. Auch bei RDS besteht sicher ein Zusammenhang mit dem jeweiligen Darmmikrobiom, weshalb Diäten natürlich einen Einfluss auf Verlauf und Symptome haben. Die meisten positiven Daten gibt es hier für die FODMAP(«fermentable oligo-, di-, monosaccharides and polyols»)-freie/-arme Diät, die auch bei Patienten mit CED- und RDS-Symptomen hilfreich sein kann. Insbesondere Blähungen und Flatulenz können hier verbessert werden.7
Funktionelle Dyspepsie (FD)
Patienten mit FD oder auch funktionellen Oberbauchbeschwerden suchen ebenso nach wirksamen Diäten und es zeigt sich in neueren Studien, dass auch hier die spärlich vorhandene Flora im oberen GI-Trakt von Bedeutung ist. Indikationen für Diäten gibt es hier wenig, ausser beim PDS («postprandial distress syndrome»), wenn vermehrt Beschwerden nach fettreichen Mahlzeiten beschrieben werden.8
«Gastroesophageal reflux disease» (GERD)
Hier gibt es wenig Evidenz für den Erfolg von Diäten, obwohl oft empfohlen. Sinnvoll sind meist eine Gewichtsabnahme oder eher kohlenhydratarme Mahlzeiten, da ohne Berücksichtigung dieser Faktoren mehr Reflux provoziert werden kann.9
Pankreatitis
Üblicherweise müssen Patienten mit Pankreatitis heutzutage keine fettarme Diät mehr einhalten, da es sonst zu Malnutrition und Mangelzuständen kommen könnte. Nur bei nicht kontrollierbarer Steatorrhö mit Symptomen trotz Enzymsubstitution kann dies selten nötig sein.10
Status nach Cholezystektomie
Trotz früherer Empfehlungen gibt es keine Studien, die für eine fettarme Diät nach einer Cholezystektomie sprechen.11
Chronisch-entzündliche Darmerkrankungen (CED)
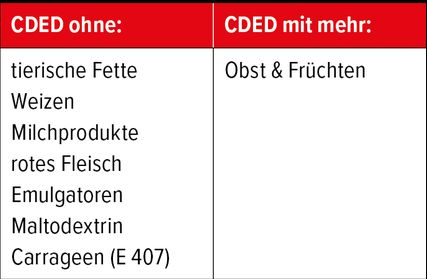
Bei Morbus Crohn und Colitis ulcerosa zeigt sich in den letzten Jahren ein immer stärkerer Zusammenhang zwischen Darmmikrobiom und Entzündung (Genetik, Antibiotika, Stuhltransplantation oder evtl. auch Biofilme). Das Mikrobiom der Erkrankten weist eine geringe Diversität auf und ist in der Zusammensetzung anders als im Vergleich zu gesunden Personen. Es gibt wenige Hinweise auf grosse Erfolge einer Prä-/Probiotikatherapie, aber eine Änderung der Diät führt schon nach wenigen Tagen zur Veränderung des Darmmikrobioms, was Teilerfolge hier erklärt. Spezielle Flüssigdiäten sind im Kindesalter noch immer integrativer Bestandteil der Therapiepalette, bei Erwachsenen aber unbeliebt. Levine et al. zeigten in einigen Studien, dass eine sogenannte CDED («Crohn’s disease exclusion diet») mit und ohne begleitende Flüssigdiät13 bei CED eine Entzündungsreduktion bringt – begleitet von einer Mikrobiomveränderung (Tab.2).12 Bei Colitis ulcerosa wirkte die Diät sogar besser als die fäkale Mikrobiomtransplantation (Remission bei 40% vs. 12%). Die Diätempfehlungen sind aber derzeit eher im Wandel.
Divertikulitis
Hier liegt eine bakterielle Genese, insbesondere beim lokal veränderten Mikrobiom in Divertikeln oder bei septischen Komplikationen, klar auf der Hand. Die Studien zu langfristigen, ballaststoffreichen Diäten sind widersprüchlich.14 Wennhier eine ballstoffreiche Diät gewünscht wird, dann sollten eher Früchte und «Körner» als Gemüse eingenommen werden.15
Literatur:
1 Husby S et al.: AGA clinical practice update on diagnosis and monitoring of celiac disease – changing utility of serology and histologic measures: expert review. Gastroenterology 2019; 156: 885-9 2 Koskinen I et al.: Overall and cause-specific mortality in adult celiac disease and dermatitis herpetiformis diagnosed in the 21st century. Am J Gastroenterol 2020; 115: 1117-24 3 Pironi L et al.: ESPEN guidelines on chronic intestinal failure in adults. Clin Nutr 2016; 35: 247-307 4 Patel NV: «Let food be thy medicine»; diet and supplements in irritable bowel syndrome. Clin Exp Gastroenterol 2021; 14: 377-84 5 Sicherer SH et al.: Food allergy from infancy through adulthood. J Allergy Clin Immunol Pract 2020; 8: 1854-64 6 Gonsalves NP, Aceves SS: Diagnosis and treatment of eosinophilic esophagitis. J Allergy Clin Immunol 2020; 145: 1-7 7 Nordin E et al.: FODMAPs, but not gluten, affect symptoms and the fecal environment in subjects with irritable bowel syndrome. A double blinded-randomized three-way crossover study. Curr Dev Nutr 2021; 5: 601 8 Duncanson K etal.: Mechanisms of food-induced symptom induction and dietary management in functional dyspepsia. Nutrients 2021; 13: 1109 9 Hunt R et al.: World Gastroenterology Organisation Global Guidelines: GERD global perspective on gastroesophageal reflux disease. J Clin Gastro 2017; 51:467-78 10 Arvanitakis M et al.: ESPEN guideline on clinical nutrition in acute and chronic pancreatitis. Clin Nutr 2020; 39: 612-31 11 Blasco YR et al.: Low-fat diet after cholecystectomy: Should it be systematically recommended? Cir Esp 2020; 98: 36-42 12 Levine A et al.: From evidence to clinical strategies with CDED. ECCO 2021; Satellitensymposium Nestlé Health Science 13 Yanai H et al.: Crohn’s disease exclusion diet induces remission in adults with mild to moderate Crohn’s disease: preliminary report from a randomised controlled trial (CDED-AD trial). UEGW 2020; Poster#0595 14 Dahl C et al.: Evidence for dietary fibre modification in the recovery and prevention of reoccurrence of acute, uncomplicated diverticulitis: a systematic literature review. Nutrients 2018; 10: 137 15 Ma W et al.: Intake of dietary fiber, fruits, and vegetables and risk of diverticulitis. Am J Gastroenterol 2019; 114: 1531-8
Das könnte Sie auch interessieren:
Behandlung der Sigmadivertikulitis
Die Divertikulitis gehört zu den häufigsten Krankheitsbildern bei akuten Bauchschmerzen. Die Inzidenz nimmt mit dem Alter stark zu und immer mehr jüngere Patienten erkranken an einer ...
Therapie des Morbus Crohn: bewährte Konzepte und neue Strategien
Welche Behandlungsziele haben Ärzt:innen, die Patient:innen mit Morbus Crohn (MC) behandeln, und haben die Betroffenen die gleichen Ziele? Lassen sich die Therapieziele erreichen, wenn ...
Therapie des Morbus Crohn: Biologikabehandlung optimieren
Prof. Dr. med. Iris Dotan, Rabin Medical Center, Petah Tikva, und Universität Tel Aviv (Israel), zeigte im Rahmen des 9. Postgraduate Course des IBDnet Möglichkeiten auf, wie die ...