Varicella-Zoster-Virus und CED
Autor:
Dr. med. Philipp Schreiner
Oberarzt
Klinik für Gastroenterologie und Hepatologie
Universitätsspital Zürich
Rämistrasse 100
8091 Zürich
E-Mail: philipp.schreiner@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Patienten mit einer chronisch-entzündlichen Darmerkrankung (CED) haben, meistens bedingt durch immunsuppressive Therapien, ein erhöhtes Risiko für virale, bakterielle und opportunistische Infektionen1,2– so auch für eine Infektion mit dem Varicella-Zoster-Virus (VZV).
Keypoints
-
Alle Patienten mit CED sollten entweder doppelt geimpftsein oder positive IgG gegen das Varicella-Zoster-Virus nachweisen.
-
Impfnaive oder Patienten, die die Windpocken nicht durchgemacht haben, sollten nach Exposition mit Varizellen sobald wie möglich eine Postexpositionsprophylaxe erhalten.
-
Patienten mit CED haben ein höheres Risiko für Herpes zoster als die Allgemeinbevölkerung. Zusätzliche Risikofaktoren sindAlter, Ethnie, Geschlecht, Krankheitsaktivität und eine immunsuppressive Therapie.
Eine mögliche virale Komplikation bei immunsuppressiver Therapie und so auch bei chronisch-entzündlichen Darmerkrankungen (CED) ist eine Infektion mit dem Varicella-Zoster-Virus (VZV)3. Da die primäre Varizelleninfektion (Windpocken) und deren Reaktivierung, der Herpes zoster, bei Patienten mit CED mit einer erhöhten Mortalität und Morbidität einhergehen und diese durch eine Impfung vermeidbar ist, ist eine Aufklärung der Patienten sowie der behandelnden Ärzte unabdingbar.
Primäre Varizelleninfektion (Windpocken)
Die primäre Varizelleninfektion ist eine selbstlimitierende, hochkontagiöse (Kontagionsindex fast 1,0),4 aerogene Tröpfcheninfektion, welche im Kindesalter zu einem typischen makulopapulös-vesikulären Exanthem (Sternenhimmelphänomen) führt. In den westlichen Ländern ohne staatliche Impfprogramme machen bis zum Jugendalter 90% der Population eine Serokonversion und somit eine Infektion mit Varizellen durch.5 Die Erkrankung verläuft bei Kindern in den allermeisten Fällen harmlos, geht aber bei Erwachsenen mit einer 25-fach höheren Mortalität (Todesrate 21/100000 Fälle) als im Kindesalter und mit einer Mortalität von bis zu 10% bei Patienten mit einer Immunsuppression einher.6 Zu Patienten mit CED gibt es in der Literatur wenige Daten (23 Fälle), wobei auch hier wegen der zusätzlichen Immunsuppression die Mortalität mit 22% deutlich erhöht ist.3 Präventive Massnahmen sind somit unerlässlich.
Die Guidelines der European Crohn’s and Colitis Organisation (ECCO) empfehlen vor Beginn einer Immunsuppression nur bei einer negativen Anamnese auf Windpocken und dem Fehlen einer dokumentierten Impfung eine serologische Testung.7 Man muss sich aber bewusst sein, dass bis zu 10% der CED-Patienten mit einer positiven Anamnese trotzdem eine negative VZV-Serologie haben und 40% der Patienten nicht wissen, ob in der Kindheiteine Exposition stattgefunden hat.8 Ein Alternative wäre, ein Screening bei allen nicht zweimal gegen Varizellen geimpften Personen auf Varicella-IgG durchzuführen, damit Personen mit einer falsch positiven Anamnese nicht übersehen werden.3
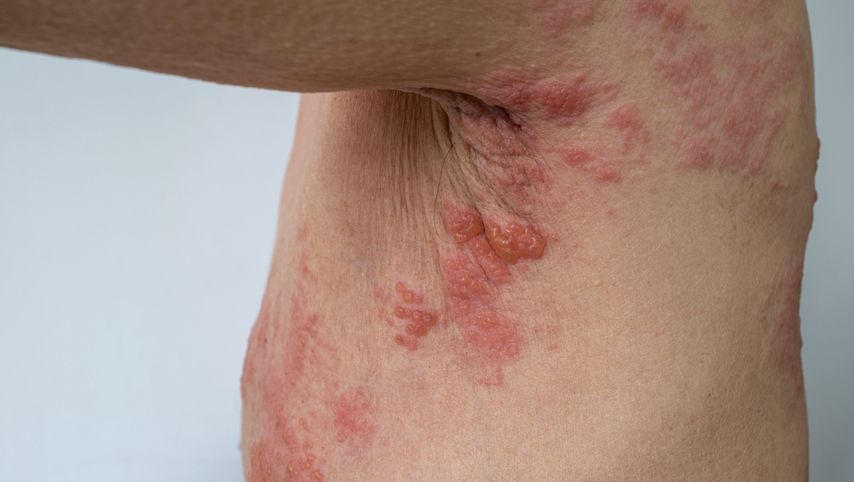
Abb. 1: Reaktivierte Varicella-Zoster-Infektion (Gürtelrose) mit vesikulo-papulösem Ausschlag am Thorax
Behandlung
Da die Windpocken bei Kindern meistens harmlos verlaufen, ist eine spezifische antivirale Therapie nicht notwendig. Im Gegensatz dazu sollten Patienten mit einer Immunsuppression oder solche mit Komplikationen je nach Schweregrad eine antivirale Therapie entweder mit intravenösem Aciclovir oder mit peroralem Valaciclovir erhalten. Da aber auch bei immunkompetenten Erwachsenen die Komplikationsrate deutlich höher ist als bei Kindern, ist häufig auch in diesem Kollektiv eine antivirale Therapie gerechtfertigt. Diese sollte innerhalb von 72 Stunden nach Symptombeginn begonnen werden. Ungeimpfte Erwachsene mit negativer Varizellenanamnese, die Kontakt zu Personen mit Windpocken hatten, sollten wegen der hohen Kontagiosität und der oben beschriebenen Risiken eine Postexpositionsprophylaxe erhalten. Bei Immunkompetenten kann der Lebendimpfstoff (Varivax® oder Varilrix®) innerhalb von 3–5 Tagen verabreicht werden. Bei Immunsupprimierten sollte eine passive Immunisierung mit VZV-Immunglobulinen (VZIG) so bald wie möglich, aber spätestens nach 10 Tagen durchgeführt werden. Da die Immunsuppression die Inkubationszeit verlängern kann und der Schutz durch eine passive Immunisierung nur bei 70% liegt, sollten die Patienten für mindestens 28 Tage auf Symptome achten.
Herpes zoster (Gürtelrose)
Herpes zoster (HZ) beschreibt die Reaktivierung des VZV, welche bei circa 30% der Erwachsenen auftritt und klassischerweise zu einem schmerzhaften vesikulo-papulösen Ausschlag in einem oder zwei Dermatomen im Thoraxbereich führt. Neben der bekannten postherpetischen Neuralgie gibt es weitere neurologische Komplikationen (Meningitis, Enzephalitis), wozu auch der seltene Zoster ophthalmicus zählt. Auch disseminierte Erkrankungen mit einem Befall von mehr als sechs Dermatomen kommen vor. Da die T-Zell-vermittelte Immunität bei der Kontrolle des VZV eine zentrale Rolle spielt und diese im Alter abnimmt, ist in der Allgemeinbevölkerung das Alter der grösste Risikofaktor für eine Reaktivierung.9 Patienten mit einer gestörten T-Zell-vermittelten Immunität, z.B. durch eine Immunsuppression, haben ein 10-fach höheres Risiko für eine Reaktivierung und auch für einen schwereren Verlauf. Neben dem Alter und den verschiedenen Formen von Immunsuppression, hier auch vor allem durch die Januskinase-Inhibitoren (Tab.1), ist die asiatische Ethnie bei CED-Patienten mit einem deutlich erhöhten Risiko für einen HZ assoziiert.10 Anzumerken ist, dass CED-Patienten auch ohne Immunsuppression ein 2-fach erhöhtes Risiko für einen HZ haben und dass das Risiko für eine VZV-Reaktivierung bei einer unkontrollierten Entzündung der CED möglicherweise höher ist als bei Einnahme von gewissen Immunsuppressiva.11 CED-Patienten haben nicht nur ein erhöhtes Risiko für das Auftreten einer Gürtelrose, sondern verzeichnen auch höhere Raten an Komplikationen und Hospitalisationen.12 Interessanterweise wies eine kürzlich publizierte Studie jedochkein Risiko für einen schweren HZ-Verlaufunter der Therapie mit einem TNF-Hemmer nach.13 Im Gegensatz dazu zeigen neuere Daten, dass einige Patienten aber unter Tofacitinib, einem Januskinase-Inhibitor, unter einem Befall von mehreren Dermatomen gelitten und mehrere eine disseminierte Erkrankung durchgemacht haben.14
Behandlung
Im Falle des Auftretens eines HZ sollte bei immunkompetenten Erwachsenen innerhalb von 72 Stunden eine antivirale Therapie mit Valaciclovir für insgesamt 7 Tage begonnen werden. Ob die häufigste Komplikation, die postherpetische Neuralgie, damit jedoch verhindert wird, ist aufgrund der heutigen Datenlage unklar. Patienten mit Immunsuppression sollten unabhängig vom Vorstellungzeitraum (somit auch mehr als 72 Stunden nach Symptombeginn) eine intravenöse Therapie mit Aciclovir erhalten. Da das Risiko für HZ mit einem Impfstoff heutzutage vermindert werden kann, ist eine präventive Massnahme der antiviralen Therapie nach Ausbruch der Erkrankung jedoch vorzuziehen.
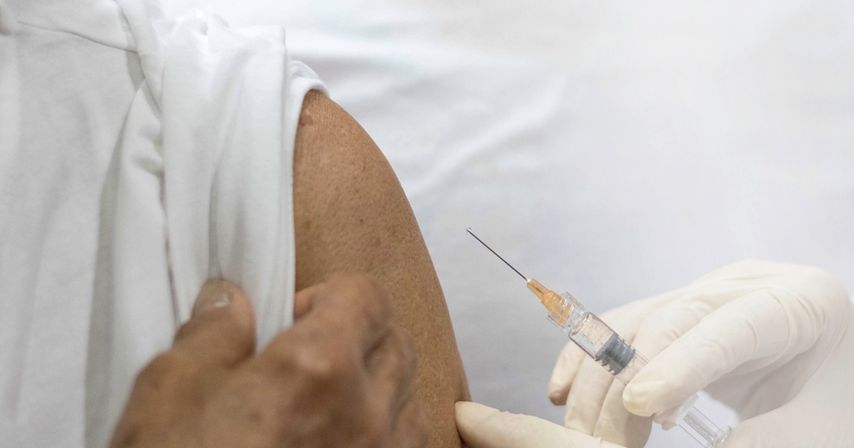
Abb. 2: Seit der Zulassung eines sehr effektiven Totimpfstoffes gegen Herpes zoster können auch (CED-)Patienten mit Immunsuppression geimpft werden
Prävention durch Impfung
Es sind derzeit zwei Impfstoffe erhältlich: der seit mehreren Jahren etablierte Lebendimpfstoff (Zostavax®) und ein neuer rekombinanter Totimpfstoff (Shingrix®), der den älteren Impfstoff in den nächsten Jahren ablösen wird. Zostavax® bietet einen circa 70%igen Schutz gegenüber HZ, wobei die Effektivität im Alter deutlich abnimmt (bei >70-Jährigen nur noch 38% Effektivität). Im Gegensatz dazu hat Shingrix® eine deutlich höhere Effektivität (98%), welche auch im Alter nur wenig abnimmt.15 Ausserdem kann ein Totimpfstoff auch Patienten mit Immunsuppression verabreicht werden, während für Lebendimpfstoffeeine relativeKontraindikation besteht. Obwohl zwischen den gastroenterologischen Fachgesellschaften und der European Medicines Agency (EMA) Uneinigkeit besteht, ab welchem Alter und bei welchen Risikofaktoren eine Impfung mit dem Totimpfstoff indiziert ist, ist diese bei den allermeisten CED-Patienten, v.a. solchen in höherem Alter und/oder mit einer Immunsuppression, gerechtfertigt. Anzumerken ist jedoch, dass die Datenlage hinsichtlich des Totimpfstoffs bei unter 50-jährigen Patienten dürftig ist und es auch spezifisch für CED-Patienten nur wenige Daten gibt. Eine erst kürzlich publizierte retrospektive Studie untermauert jedoch die Sicherheit und Effektivität von Shingrix® bei über 50-jährigen CED-Patienten.16 Man muss sich stets bewusst sein, dass z.B. 40-jährige CED-Patienten ein höheres Risiko für einen HZ als 50-jährige gesunde Personen haben und dass 50-jährige Patienten mit einer Kombinationstherapie (Azathioprin und Anti-TNF) ein höheres Risiko für einen HZ als 60-jährige Patienten mit Mesalazin haben. Ein Vorschlag, welche CED-Patienten geimpft werden sollten, findet sich in Tabelle 2. Obwohl in den letzten Jahren viel über das HZ-Risiko bei CED diskutiert wurde, ist nur etwa ein Fünftel der geeigneten CED-Patienten dagegen geimpft,17 was dazu führt, dass der Herpes zoster die am häufigsten durch eine Impfung vermeidbare Erkrankung ist.12
Fazit
CED-Patienten haben ein erhöhtes Risiko für Komplikationen im Falle einer primären Varizelleninfektion und stellen auch eine Population mit einem erhöhten Risiko für einen Herpes zoster dar. Seronegative Erwachsene sollten bei Exposition gegenüber Windpocken so schnell wie möglich eine Postexpositionsprophylaxe erhalten und brauchen bei Ausbruch der Windpocken zur Verhinderung von Komplikationen eine antivirale Therapie. Zur Verhinderung der Primärinfektion und der Reaktivierung existieren Impfungen, wobei die Impfung gegen HZ heutzutage bei CED-Patienten noch zu wenig genützt wird. Seit der Zulassung eines sehr effektiven Totimpfstoffes gegen HZ, der auch bei Patienten mit Immunsuppression eingesetzt werden kann, darf aber auf steigende Impfzahlen gehofft werden.
Literatur:
1 Kirchgesner J et al.: Risk of serious and opportunistic infections associated with treatment of inflammatory bowel diseases. Gastroenterology 2018; 155: 337-46 2 Irving PM et al.: Risk of common infections in people with inflammatory bowel disease in primary care: a population-based cohort study. BMJ Open Gastroenterol 2021; 8: e000573 3 Schreiner P et al.: Varicella zoster virus in inflammatory bowel disease patients: what every gastroenterologist should know. J Crohns Colitis 2020; doi: 10.1093/ecco-jcc/jjaa132 4 Simpson RE: Infectiousness of communicable diseases in the household (measles, chickenpox, and mumps). Lancet 1952; 2: 549-54 5 Bollaerts K et al.: A systematic review of varicella seroprevalence in European countries before universal childhood immunization: deriving incidence from seroprevalence data. Epidemiol Infect 2017; 145: 2666-77 6 Meyer PA et al.: Varicella mortality: trends before vaccine licensure in the United States, 1970-1994. J Infect Dis 2000; 182: 383-90 7 Kucharzik T et al.: ECCO Guidelines on the prevention, diagnosis, and management of infections in inflammatory bowel disease. J Crohns Colitis 2021; 15: 879-913 8 Kopylov U et al.: Prior varicella zoster virus exposure in IBD patients treated by anti-TNFs and other immunomodulators: implications for serological testing and vaccination guidelines. Aliment Pharmacol Ther 2012; 36: 145-50 9 Hayward AR, Herberger M: Lymphocyte responses to varicella zoster virus in the elderly. J Clin Immunol 1987; 7: 174-8 10 Chang K et al.: Increased risk of herpes zoster infection in patients with inflammatory bowel diseases in Korea. Clin Gastroenterol Hepatol 2018; 16: 1928-36 11 Khan N et al.: Overall and comparative risk of herpes zoster with pharmacotherapy for inflammatory bowel diseases: A nationwide cohort study. Clin Gastroenterol Hepatol 2018; 16: 1919-27 12 Vinsard DG et al.: Vaccine-preventable diseases in hospitalized patients with inflammatory bowel disease: A nationwide cohort analysis. Inflamm Bowel Dis 2019; 25: 1966-73 13 Khan N et al.: The severity of herpes zoster in inflammatory bowel disease patients treated with anti-TNF agents. Inflamm Bowel Dis 2018; 24: 1274-9 14 Winthrop KL et al.: Herpes zoster infection in patients with ulcerative colitis receiving tofacitinib. Inflamm Bowel Dis 2018; 24: 2258-65 15 Cunningham AL et al.: Efficacy of the herpes zoster subunit vaccine in adults 70 years of age or older. N Engl J Med 2016; 375: 1019-32 16 Khan N et al.: Efficacy of recombinant zoster vaccine in patients with inflammatory bowel disease. Clin Gastroenterol Hepatol 2021; 1542-3565 17 Khan N et al.: Frequency of herpes zoster vaccination among inflammatory bowel disease patients. Inflamm Bowel Dis 2019; 25: 345-51
Das könnte Sie auch interessieren:
Behandlung der Sigmadivertikulitis
Die Divertikulitis gehört zu den häufigsten Krankheitsbildern bei akuten Bauchschmerzen. Die Inzidenz nimmt mit dem Alter stark zu und immer mehr jüngere Patienten erkranken an einer ...
Therapie des Morbus Crohn: bewährte Konzepte und neue Strategien
Welche Behandlungsziele haben Ärzt:innen, die Patient:innen mit Morbus Crohn (MC) behandeln, und haben die Betroffenen die gleichen Ziele? Lassen sich die Therapieziele erreichen, wenn ...
Therapie des Morbus Crohn: Biologikabehandlung optimieren
Prof. Dr. med. Iris Dotan, Rabin Medical Center, Petah Tikva, und Universität Tel Aviv (Israel), zeigte im Rahmen des 9. Postgraduate Course des IBDnet Möglichkeiten auf, wie die ...