Von «Smart Start» zu «Smart Stop»
Autor:innen:
Dr. med. Martina Bertschinger
Oberärztin
Medizinische Onkologie und Hämatologie
Kantonsspital Winterthur
E-Mail: martina.bertschinger@ksw.ch
Prof. Dr. med. Ulrich Mey
Departement Innere Medizin
Medizinische Onkologie und Hämatologie, Kantonsspital Graubünden
E-Mail: ulrich.mey@ksgr.ch
Beim Jahreskongress der American Society of Hematology (ASH) wurden einige relevante Updates und neue interessante Studiendaten zur Behandlung von Lymphomen präsentiert. In diesem Artikel stellen wirdas Follow-up zur Glofitamab-Monotherapie bei rezidivierten/refraktären grosszelligen B-Zell-Lymphomen (r/r LBCL), einen neuen Chemotherapie-sparenden Therapieansatz bei unbehandeltem LBCL, eine neue zielgerichtete Kombinationstherapie bei Richter-Transformation sowie Daten zur Kombinationstherapie von Ibrutinib und Venetoclax in der Behandlung des r/r Mantelzelllymphoms vor.
Keypoints
-
Eine zeitlich limitierte Therapie mit dem bispezifischen Antikörper Glofitamab führt zu lang anhaltenden Remissionen bei Patient:innen mit r/r LBCL.
-
Eine Vierfachkombination zielgerichteter Substanzen erreicht hohe Ansprechraten bei Patient:innen mit zuvor unbehandeltem LBCL («Smart Stop»).
-
Die Kombination von Tislelizumab und Zanubrutinib ist eine wirksame und verträgliche Kombinationstherapie für Patient:innen mit Richter-Transformation.
-
Ibrutinib in Kombination mit Venetoclax führt bei Patient:innen mit r/r Mantelzelllymphom zu einer Verlängerung des progressionsfreien Überlebens (PFS).
Update zu Glofitamab-Monotherapie bei r/r LBCL
Bereits am EHA-Jahrestreffen 2022 wurde eine wichtige Phase-II-Studiezum bispezifischen CD20xCD3-2:1-Antikörper Glofitamab präsentiert. In dieser Studie konnte in der Kohorte der r/r LBCL eine hohe Rate an Ansprechen und kompletten Remissionen (ORR und CR) gezeigt werden.1
Martin Hutchings präsentierte am diesjährigen ASH-Jahrestreffen ein erweitertes Follow-up dieser Studie zur Glofitamab-Monotherapie, wobei auch Daten zu Patient:innen mit vorangegangener CAR-T-Zell-Therapie und zum Einfluss des «total metabolic tumor volume» (TMTV) vor Therapiestart gezeigt wurden.2 Zur Erinnerung: In diese Studie wurden Patient:innen mit r/r LBCL mit ≥2 Vortherapien eingeschlossen, inklusive Anti-CD20-Antikörper und einem Anthrazyclin.
Zur Verringerung der Rate des Zytokin-Freisetzungssyndroms (CRS) wurde allen Patient:innen eine Dosis Obinutuzumab in Höhe von 1000mg an Tag 1 verabreicht. Nachfolgend erfolgte die Step-up-Dosierung von Glofitamab im Zyklus 1. Ab dem zweiten Zyklus wurde Glofitamab in therapeutischer Dosis von 30mg («flat dose») für maximal zwölf Zyklen verabreicht. Die eingeschlossenen Patient:innen waren stark vortherapiert (60,4% ≥3 Vortherapien, 33,1% CAR-T-Zell-Therapie, 18,8% autologe Stammzelltransplantation). Nach längerem Follow-up von 24 Monaten hatte sich die Ansprech- und CR-Rate (ORR: 52%; CR: 40%) nicht verändert, da alle Patient:innen die Therapie bereits beendet hatten. Der Grossteil der Patient:innen, die nach drei Zyklen bzw. bei Therapieende eine CR erreicht hatten, war nach 18 bzw. 24 Monaten progressionsfrei (Abb. 1).
Abb. 1: Kaplan-Meier-Kurve mit PFS für Patient:innen mit kompletter Remission (CR), «Non-Responder» (NR) und Patient:innen mit partieller Remission (PR) nach Stoppen der Glofitamab-Monotherapie («end of treatment», EOT; modifiziert nach Hutchings M et al.)2
Bezüglich der Population, die als Vortherapie eine CAR-T-Zell-Therapie erhalten hat, konnte im Vergleich zur Gesamtpopulation kein Unterschied in der CR-Rate (40% vs. 37%) festgestellt werden.
TMVT wurde in der Baseline-PET/CT gemessen und als Grenzwert der zweifache «standard uptake value»(SUV)-Median der Leber definiert. Das mediane Baseline-TMVT in der untersuchten Patient:innenpopulation betrug 128,7ml. Patient:innen mit hohem TMVT (TMVT ≥Median) vor Therapiestart hatten ein deutlich kürzeres PFS im Vergleich zu Patient:innen mit niedrigerem TMVT (11,8 Monate vs. 41,6 Monate). Weiter konnte gezeigt werden, dass mit zunehmendem TMVT (Q1: 0–32mml, Q2: 33–127ml, Q3: 130–366ml, Q4: 383–3822ml) die CRS-Raten ≥Grad 2 deutlich höher sind (2,8% vs. 11,1% vs. 16,7% vs. 38,9%).
Zusammenfassend kann im erweiterten Follow-up zu Glofitamab-Monotherapie festgehalten werden, dass die Therapie bei der Mehrheit der CR-Patient:innen trotz zeitlich limitierter Behandlung zu einer anhaltenden Remission führt und dass ein hohes Tumorvolumen vor Therapiestart sowohl mit einem kürzeren progressionsfreien Überleben wie auch einem höheren Risiko für das Auftreten eines CRS ≥Grad 2 assoziiert ist.
«Smart Stop»: Reduktion der CTx beim unbehandelten LBCL
Basierend auf der vorausgegangenen «Smart Start»-Studie3 wurde am ASH-Jahrestreffen die «Smart Stop»-Studie vorgestellt.4 Die Frage war, ob eine Chemotherapie (CTx) bei Patient:innen mit neu diagnostiziertem LBCL, je nach Ansprechen auf eine rein zielgerichtete Kombinationstherapie, deeskaliert (erste Kohorte mit Reduktion der Chemotherapie auf nur zwei Zyklen CHOP) bzw. sogar komplett weggelassen werden kann (zweite Kohorte). Am Jahrestreffen wurde die vorgeplante Interimsanalyse vorgestellt (wobei die Ergebnisse der komplett chemotherapiefreien zweiten Kohorte noch nicht verfügbar waren).
Eingeschlossen wurden 30 Patient:innen (32–84 Jahre) mit zuvor unbehandeltem LBCL (eingeschlossen primär mediastinales B-Zell-Lymphom und Hodenlymphom). 67% der Patient:innen wiesen einen High-Risk-IPI-Score (3–5) auf, 83% der Patient:innen hatten einen Non-GCB-Typ. Alle Patient:innen erhielten zunächst vier Zyklen LTRA, eine Kombination der Medikamente Lenalidomid, Tafasitamab, Rituximab und Acalabrutinib, mit anschliessendem Restaging mittels PET/CT. In der aktuell vorgestellten Kohorte erhielten Patient:innen mit CR nach vier Zyklen LTRA sechs weitere Zyklen LTRA kombiniert mit nur zwei Zyklen CHOP. Im Falle des Nichterreichens einer CR (partielle Remission [PR], stabile Erkrankung [SD], fortschreitende Erkrankung [PD]) nach der chemotherapiefreien LTRA-Therapie erfolgten sechs Zyklen LTRA plus volle sechs Zyklen CHOP. Der primäre Endpunkt waren die Ansprechrate nach vier Zyklen LTRA und die CR-Rate bei Therapieende.
Nach vier Zyklen LTRA konnten eine ORR von 100% und eine CR-Rate von 63% gezeigt werden. Nach zwei weiteren Zyklen LTRA plus zwei Zyklen CHOP lag die ORR bei 100% und die CR-Rate bei 93,3% und schliesslich bei Therapieende bei jeweils 100%. Die häufigsten Nebenwirkungen waren: Hautausschlag (43%), Neutropenie (87%) und Infektionen (30%).
Zusammengefasst zeigt die «Smart Stop»-Studie, dass eine alleinige zielgerichtete, chemotherapiefreie Therapie mit Lenalidomid, Tafasitamab, Rituximab und Acalabrutinib bei Patient:innen mit unbehandeltem LBCL eine hochwirksame Kombination darstellt. Natürlich muss das längere Follow-up abgewartet werden. Mit grossem Interesse werden die Ergebnisse der zweiten Kohorte der «Smart Stop»-Studie erwartet, bei der bei CR-Patient:innen komplett auf die Chemotherapie verzichtet wird.
Tislelizumab + Zanubrutinib wirksam bei Richter-Transformation
Dr. med. Othman Al-Sawaf präsentierte eine prospektive, multizentrische Phase-II-Studie zur Kombination des BTK-Inhibitors (BTKi) Zanubrutinib mit dem PD-1-Inhibitor Tislelizumab bei Patient:innen mit Richter-Transformation.5
In die einarmige Studie wurden 48 Patient:innen mit einem medianen Alter von 67 Jahren (45–82 Jahre) eingeschlossen. Die Patient:innen hatten im Median drei CLL-gerichtete Vortherapien (1–6). Ein grosser Teil der Patient:innen wies Hochrisikomerkmale auf (34,8% TP53-Alteration, 70,7% unmutierter IGHV-Status, 42,1% komplexer Karyotyp [≥3 Aberrationen]). Hervorzuheben ist, dass sowohl Patient:innen mit unbehandelter Richter-Transformation (79,2%) als auch vortherapierte Patient:innen (20,8%) eingeschlossen werden konnten. 66,7% der Patient:innen waren mit einem BTKi vortherapiert. 95,8% wiesen eine DLBCL-Histologie und 4,2% eine Hodgkin-Lymphom-Histologie auf.
Die Therapie wurde in drei Phasen durchgeführt: Induktion (sechs Zyklen à drei Wochen), Konsolidierung (sechs Zyklen à drei Wochen) und Maintenance (bis Progress). Verabreicht wurde Tislelizumab 200mg jeweils am Tag 1 alle drei Wochen, Zanubrutinib 160mg zweimal täglich. Der primäre Endpunkt war die Ansprechrate nach der Induktionsphase.
Die Ansprechrate nach der Induktionsphase betrug 58,3% (95% CI: 43,2–72,4; p=0,008) mit CR-Rate von 18,8% und PR-Rate von 39,6%. Die mediane Beobachtungszeit beträgt 13,9 Monate, das mittlere PFS 10,0 Monate. Das mittlere OS ist noch unreif. Die Sicherheitsanalyse ergab keine unerwarteten Nebenwirkungen. Die häufigsten Nebenwirkungen von Grad >3 waren Hämatotoxizität (35,1%), Diarrhö (5,3%) und Infektionen (42,2%). Als Folgetherapie bei Progress erhielten 50% der Patient:innen eine Immunchemotherapie, 19% eine allogene SCT, 16,7% einen BTKi oder BCL2i und 14,3% eine andere Therapie.
In dieser Studie konnte gezeigt werden, dass die Kombination von Zanubrutinib und Tislelizumab gut verträglich und mit einer Gesamtansprechrate von 58,3% wirksam ist. Dauer des Ansprechens und PFS sind im Vergleich zu historischen Daten vielversprechend. Schlussendlich bleiben auch hier die reiferen Daten abzuwarten. Zukünftig ist eine Kombination der beiden Substanzen mit einem BCL-2-Inhibitor (Sonrotoclax) geplant.
PFS-Verlängerung durch Add-on Venetoclax zu Ibrutinib beim r/r Mantelzelllymphom
In der randomisierten, doppelblinden Phase-III-Studie SYMPATICO, präsentiert von Michael Wang, MD, wurde die Hinzunahme von Venetoclax zu einer Standardtherapie mit Ibrutinib beim r/r Mantelzelllymphom untersucht.6 Eingeschlossen wurden Patient:innen mit Mantelzelllymphom mit einer bis fünf vorangegangenen Therapien, wobei alle Patient:innen eine vorangegangene Rituximab-haltige Therapie erhalten hatten. Der ECOG-PS betrug 0 bis 2.
Patient:innen im Standardarm erhielten eine Ibrutinib-Monotherapie (560mg pro Tag) und Placebo für 24 Monate und danach Ibrutinib bis zum Progress oder bis zu intolerabler Toxizität. Im experimentellen Arm wurde Ibrutinib 560mg mit Venetoclax 400mg einmal pro Tag für 24 Monate verabreicht, nachdem in den ersten Wochen ein Ramp-up von Venetoclax durchgeführt worden war (Reduktion des Tumorlysesyndrom-Risikos). Nach 24 Monaten wurde die Therapie mit Ibrutinib-Monotherapie fortgeführt.
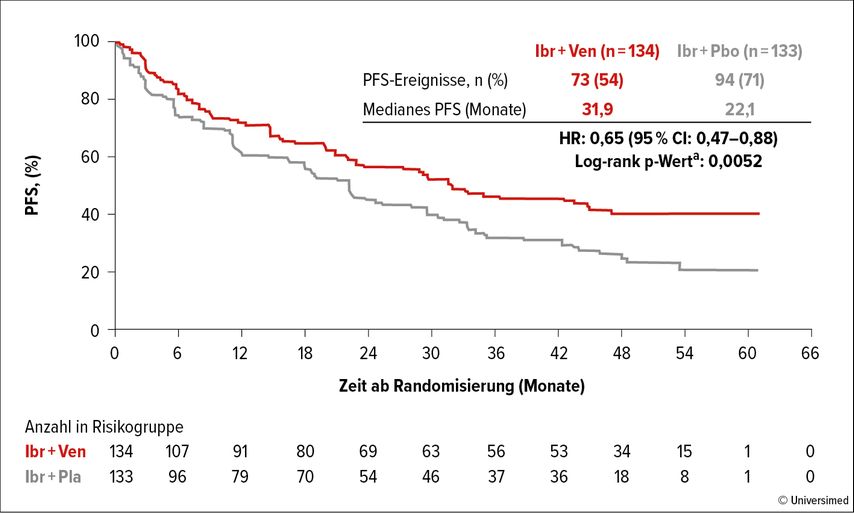
Das mediane Follow-up betrug 51,2 Monate. In beiden Armen hatten 30% der Patient:innen eine TP53-Mutation und im Kombinationsarm gab es etwas mehr High-Risk-Patient:innen nach dem «Mantle Cell Lymphoma International Prognostic Index» (38 vs. 31%). Der primäre Endpunkt, das mediane PFS, konnte durch die Hinzugabe von Venetoclax deutlich verlängert werden (31,9 Monate vs. 22,1 Monate; HR: 0,65 [0,47–0,88]; p=0,0052; Abb. 2). Die Subgruppenanalyse ergab in den vordefinierten Gruppen keine Hinweise auf ein unterschiedliches Ansprechen.
Abb. 2: Die Hinzunahme von Venetoclax (Ven) zur Standardtherapie Ibrutinib (Ibr) bei Patient:innen mit r/r Mantelzelllymphom führt zu einem deutlichen PFS-Unterschied (modifiziert nach Wang M)6
In der aktuellen Interimsanalyse war die Gesamtüberlebenszeit im Kombinationsarm mit 44,9 Monaten vs. 38,6 Monate numerisch länger als im Kontrollarm, wobei der Unterschied bei einem medianen Follow-up von 51,2 Monaten keine statistische Signifikanz erreichte (HR: 0,85; p=0,4368).
Bezüglich der Toxizität waren keine unerwarteten Effekte durch die Kombination zu beobachten. In der Kombinationsgruppe traten häufiger Nebenwirkungen von Grad ≥3 auf (84% vs. 76%), vor allem vermehrte Diarrhö und hämatologische Toxizität. In beiden Therapiegruppen starben je zehn Patient:innen an einer Covid-19-Infektion.
Zusammengefasst zeigt sich für die Kombinationstherapie ein klinisch bedeutsamer und signifikanter PFS-Vorteil, jedoch bisher kein signifikanter OS-Unterschied. Das längere Follow-up dieser Studie wird zeigen, inwiefern diese Kombinationstherapie die derzeitige Therapielandschaft des r/r MCL verändern wird.
Literatur:
1 Dickinson MJ et al.: Glofitamab for relapsed or refractory diffuse large B-cell lymphoma. N Engl J Med 2022; 387(24): 2220-31 2 Hutchings M: Glofitamab monotherapy in relapsed or refractory large B-cell lymphoma: extended follow-up from a pivotal phase II study and subgroup analyses in patients with prior chimeric antigen receptor T-cell therapy and by baseline total metabolic tumor volume. ASH 2023; Abstr. #433 3 Westin J et al.: Smart Start: rituximab, lenalidomide, and ibrutinib in patients with newly diagnosed large B-cell lymphoma. J Clin Oncol 2023; 41(4): 745-55 4 Westin J: Smart Stop: lenalidomide, tafasitamab, rituximab and acalabrutinib alone and with combination chemotherapy for the treatment of newly diagnosed diffuse large B-cell lymphoma. ASH 2023; Abstr. #856 5 Al-Sawaf O et al.: Tislelizumab plus zanubrutinib in patients with Richter transformation: primary endpoint analysis of the prospective multi-center phase-II RT1 trial of the German CLL study group. ASH 2023; Abstr. #204 6 Wang M: Ibrutinib combined with venetoclax in patients with relapsed/refractory mantle cell lymphoma: primary analysis results from the randomized phase 3 SYMPATICO study. ASH 2023; Abstr. #BA-2
Das könnte Sie auch interessieren:
«Kommunikation ist sehr oft Therapie»
Sara Rubinelli, Professorin für Gesundheitswissenschaften mit Schwerpunkt Gesundheitskommunikation an der Fakultät für Gesundheitswissenschaften und Medizin der Universität Luzern, im ...
Schweiz setzt neue Akzente für Frauengesundheit
Der Bundesrat hat diese Woche einen Postulatsbericht verabschiedet, der breiten Handlungsbedarf bei der Gesundheitsversorgung von Frauen aufzeigt. Von BAG bis Swissmedic werden mehrere ...
Studie: Höheres Einkommen senkt Schlaganfallrisiko
Aktuelle Forschungsergebnisse zeigen den Zusammenhang zwischen der Höhe des Einkommens und dem Risiko, an einem Schlaganfall zu sterben.