Mikrobiom-Modulation beim Reizdarm – sinnvoll oder nicht?
Autor:
Prof. Dr. med. Peter C. Konturek
Thüringen-Kliniken „Georgius Agricola“ GmbH Saalfeld
Akademisches Lehrkrankenhaus der Universitätsklinik Jena
E-Mail: pkonturek@thueringen-kliniken.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bei den meisten Patienten mit einem Reizdarmsyndrom kann eine intestinale Dysbiose, d.h. eine qualitative und quantitative Störung des Darmmikrobioms, nachgewiesen werden. Für die Modulation der Mikrobiota stehen verschiedene zielführende Möglichkeiten zur Verfügung.
Keypoints
-
Das Reizdarmsyndrom (RDS)ist die häufigste funktionelle gastrointestinale Erkrankung.
-
Die Pathogenese des Reizdarms ist multifaktoriell, wobei die Störung der Mikrobiota-Hirn-Darm-Achse eine zentrale Rolle spielt. Inzwischen ist gut belegt, dass die intestinale Mikrobiota bedeutend zur Aufrechterhaltung der Homöostase und einer Vielzahl verschiedener physiologischer Prozesse beiträgt.
-
Eine Modulation der Darmmikrobiota mit Probiotika, Antibiotika (Rifaximin), FMT oder FODMAP-Diät ist sinnvoll und führt zu einer signifikanten Linderung der Symptome des RDS.
Das Reizdarmsyndrom ist die häufigste funktionelle Störung des Gastrointestinaltraktes.1 Die Erkrankung wird durch eine Reihe von pathophysiologischen Störungen begleitet, wie erhöhte Permeabilität der intestinalen Barriere, Störung des lokalen Immunsystems, abnormale Sekretion, erhöhte viszerale Sensitivität, pathologische Darmmotilität, veränderte intestinale Mikrobiota und schließlich begleitende psychiatrische Komorbiditäten, wie Depression oder Angststörung.2
Entstehung des Reizdarms und intestinale Dysbiose
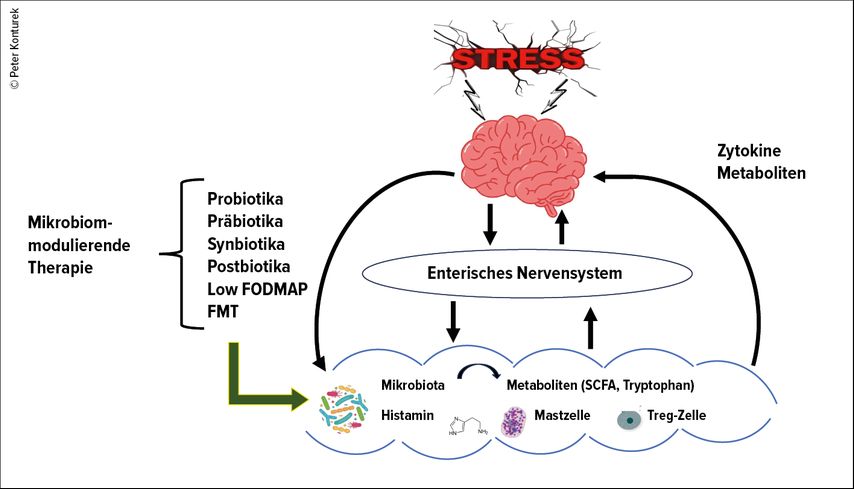
Das Reizdarmsyndrom zeichnet sich in erster Linie durch eine Dysfunktion der Darm-Hirn-Achse (DHA)aus, d.h. einer bidirektionalen Kommunikation zwischen enteralem Nervensystem und zentralem Nervensystem (Abb. 1).3
Abb. 1: Einfluss der intestinalen Dysbiose auf die Darm-Hirn-Achse (DHA) und Mikrobiom-modulierende Therapieoptionen
Bei den meisten Patienten mit einem Reizdarm findet sich eine intestinale Dysbiose, d.h. eine qualitative und quantitative Störung der Mikrobiota, die die Aktivität der DHA negativ beeinflusst. Dazu kommen zahlreiche Veränderungen in der Mikroumwelt der intestinalen Mukosa (z.B. Aktivierung von Mastzellen mit einer verstärkten Histaminfreisetzung, Störungen des angeborenen und adaptiven Immunsystems). Infolge dieser pathologischen Vorgänge entsteht bei den betroffenen Patienten eine Mikroentzündung in der Schleimhaut. All das kann für die Entstehung von Symptomen eines Reizdarms verantwortlich sein.4
Die Entstehung eines Reizdarms ist multifaktoriell. In erster Linie konnten zahlreiche Studien quantitative und qualitative Veränderungen des Darmmikrobioms bei Reizdarm nachweisen. Die Analysen des fäkalen Mikrobioms der Betroffenen zeigen eine signifikante Reduktion von kommensalen Bakterien (wie z.B. Bifidobakterien, Laktobazillen), dagegen sind proentzündliche bakterielle Taxa, wie z.B. Enterobacteriaceae, signifikant erhöht.5
Die Folge der intestinalen Dysbiose sind nicht nur strukturelle Verschiebungen des Darmmikrobioms, sondern auch signifikante Veränderungen in der Produktion von mikrobiellen Metaboliten. Vor Kurzem konnte eine Arbeitsgruppe aus Göteborg zeigen, dass die Metabolitenprofile bei Patienten mit einem Reizdarmsyndrom sich signifikant von denen gesunder Kontrollen unterscheiden.6
Die genauen Mechanismen, die zur intestinalen Dysbiose führen, konnten bislang nicht ausreichend geklärt werden. Die Studien der letzten Jahre liefern eine Reihe von Evidenzen, dass neben der genetischen Prädisposition besonders die Exposition von schwangeren Frauen bzw. Kindern in den ersten Monaten nach der Geburt gegenüber Antibiotika, Stress oder falscher Ernährung den Weg in Richtung Reizdarmsyndrom bahnen kann.7 Auf der anderen Seite spielen auch Infektionen eine enorm wichtige Rolle als Auslöser des Reizdarms; wir sprechen vom sogenannten postinfektiösen Reizdarm.8 Ca. 10% aller Reizdarmfälle können auf diese Ursache zurückgeführt werden. Ein Beispiel dafür ist das sogenannte Post-Covid-Reizdarm-Syndrom. Charakteristisch für diese Störung sind rezidivierende und therapierefraktäre Bauchschmerzen infolge einer erhöhten viszeralen Hypersensitivität und veränderte Darmmotilität.9
Modulation der Mikrobiota
Die Modulation der Mikrobiota stellt ein vielversprechendes Vorgehen beim Reizdarmsyndrom dar (Abb.1). Dazu gehört der Einsatz von Antibiotika, Probiotika, Präbiotika, Synbiotika, Postbiotika und fäkale Mikrobiota-Therapie (FMT).10
Eine aussichtsreiche Therapieoption ist der Einsatz von Rifaximin. Hierbei handelt es sich um ein nicht resorbierbares Breitspektrumantibiotikum, das das Darmmikrobiom positiv moduliert und v.a. bei diarrhöbetontem Reizdarmsyndrom zu Symptombesserung führt.11
Auf der anderen Seite stehen den Ärzten auch zahlreiche Probiotika zur Verfügung. Diese positiven Bakterien verstärken die Barrierefunktion, haben einen positiven Einfluss auf die Immunmodulation, zeigen antientzündliche Effekte und hemmen auch die Invasion von entzündungsfördernden Bakterien.12 Zahlreiche randomisierte Studien mit Probiotika vs. Placebo zeigen einen positiven Effekt dieser Therapie.13
Auch fermentierte Lebensmittel, sogenannte natürliche Probiotika, wie Kimchi, Sauerkraut, Miso, Nato, Rejuvelac, Kombucha, Kefir oder Joghurt, können die Darmbakterien-Komposition und -Funktion positiv beeinflussen.14
Neben den Probiotika spielen Präbiotika eine wichtige Rolle bei der Behandlung der Reizdarmpatienten. Präbiotika sind nicht verdaubare Lebensmittelbestandteile (z.B. Inulin oder Xylooligosaccharide oder Fructooligosaccharide), die ihren Wirt günstig beeinflussen, indem sie das Wachstum und/oder die Aktivität einer oder mehrerer Bakterienarten im Dickdarm gezielt anregen und somit die Gesundheit des Wirts verbessern. Sie stimulieren die Produktion von kurzkettigen Fettsäuren, sie erhöhen die Biomasse im Darm, sie stellen mehr Energie für die Dickdarmzellen bereit und hemmen letztendlich auch das Wachstum von negativen Bakterien und können auch einen positiven Einfluss auf die pH-Wert-Entwicklung im Darm haben. Präbiotika finden wir auch in verschiedenen Lebensmitteln, wie Chicorée, Topinambur, Artischocken, Porree, Zwiebeln oder Schwarzwurzeln. Prä- und Probiotika können auch zusammengebunden werden als Synbiotikum. Damit können wir einen verstärkten Effekt auf die Immunmodulation und auf die metabolischen Reaktionen im Darm erzielen.15
Postbiotika sind eine weitere Option zur Modulation des Darmmikrobioms. Dabei handelt es sich um unbelebte Mikroorganismen bzw. deren Bestandteile oder bestimmte Stoffwechselprodukte (wie z.B. Butyrat). Die Hauptwirkungsweise von Postbiotika ist die Stärkung des lokalen Immunsystems und Verbesserung der Darmbarrierefunktion.16
Die fäkale Mikrobiotatherapie (d.h. die Übertragung von Stuhl eines gesunden Spenders in den Darm einer erkrankten Person mittels Endoskopie oder Kapseln) ist eine weitere Möglichkeit, die Komposition der Darmmikrobiota zu verändern. Die FMT erlaubt in erster Linie die Mikrobiotavielfalt zu verbessern. Allerdings ist dies eine komplexe Methode; es bedarf einer Laboraufbereitung und einer Rekrutierung eines geeigneten und gesunden Spenders.17 Die Metaanalysen zeigen sehr unterschiedliche Ergebnisse von negativen bis zu positiven in Abhängigkeit von der Dosis, der Dauer der Therapie und dem Applikationsweg (oberer vs. unterer Gastrointestinaltrakt).18
Schließlich stellt auch eine Low-FODMAP-Diät, d.h. eine Diät mit wenig fermentierbaren Oligosacchariden, Disacchariden, Monosacchariden und Polyolen eine weitere wichtige Option zur Modulation der Darmmikrobiota dar. Diese Form der diätetischen Therapie hat einen günstigen Effekt auf die Symptome des Reizdarms.19 Die gute Effektivität der Low-FODMAP-Diät bestätigen auch die Metaanalysen zahlreicher Studien. Diese Therapie soll in drei Phasen erfolgen (Elimination, Toleranzfindung und Langzeiternährung). Aus diesem Grund brauchen die Betroffenen eine entsprechende Unterstützung von Diätberatern.
Literatur:
1 Sperber AD: Epidemiology and burden of irritable bowel syndrome: an international perspective. Gastroenterol Clin North Am 2021; 50(3): 489-503 2 Huang KY et al.: Irritable bowel syndrome: Epidemiology, overlap disorders, pathophysiology and treatment. World J Gastroenterol 2023; 29(26): 4120-35 3 Konturek PC, Zopf Y: Therapeutic modulation of intestinal microbiota in irritable bowel syndrome. From probiotics to fecal microbiota therapy. MMW Fortschr Med 2016; 158(4): 12-6 4 Simrén M: Targeting the gut microenvironment in IBS to improve symptoms. Nat Rev Gastroenterol Hepatol 2023; 20(2): 69-70 5 Pittayanon R et al.: Gut microbiota in patients with irritable bowel syndrome – a systematic review. Gastroenterol 2019; 157(1): 97-108 6 Ahluwalia B et al.: A distinct faecal microbiota and metabolite profile linked to bowel habits in patients with irritable bowel syndrome. Cells 2021; 10(6): 1459 7 Zhou GQ et al.: Early life adverse exposures in irritable bowel syndrome: new insights and opportunities. Front Pediatr 2023; 11: 1241801 8 Lupu VV et al.: Emerging role of the gut microbiome in post-infectious irritable bowel syndrome: A literature review. World J Gastroenterol 2023; 29(21): 3241-56 9 Marasco G et al.: Post COVID-19 irritable bowel syndrome. Gut 2022: gutjnl-2022-328483 10 Zhao Y, Zou DW: Gut microbiota and irritable bowel syndrome. J Dig Dis 2023; 24(5): 312-20 11 Goodoory VC, Ford AC: Antibiotics and probiotics for irritable bowel syndrome. Drugs 2023; 83(8): 687-99 12 Mazzawi T: Gut microbiota manipulation in irritable bowel syndrome. Microorganisms 2022; 10(7): 1332 13 Goodoory VC et al.: Efficacy of probiotics in irritable bowel syndrome: systematic review and meta-analysis. Gastroenterol 2023; 0016-5085(23)04838-2 14 Garnås E: Fermented vegetables as a potential treatment for irritable bowel syndrome. Curr Dev Nutr 2023; 7(3): 100039 15 Simon E et al.: Probiotics, prebiotics and synbiotics: implications and beneficial effects against Iirritable bowel syndrome. Nutrients 2021; 13(6): 2112 16 Bednarska O et al.: A postbiotic fermented oat gruel may have a beneficial effect on the colonic mucosal barrier in patients with irritable bowel syndrome. Front Nutr 2022; 9: 1004084 17 Stallmach A et al.: Fecal Microbiota Transfer (FMT) in Germany – status and perspective. Z Gastroenterol 2023; doi: 10.1055/a-2075-2725 18 Myneedu K et al.: Fecal microbiota transplantation in irritable bowel syndrome: A systematic review and meta-analysis. United European Gastroenterol J 2019; 7(8): 1033-1041 19 Liu J et al.: Low-FODMAP Diet for Iirritable bowel syndrome: What we Know and what we have yet to learn. Annu Rev Med 2020; 71: 303-14 20 van Lanen AS et al.: Efficacy of a low-FODMAP diet in adult irritable bowel syndrome: a systematic review and meta-analysis. Eur J Nutr 2021; 60(6): 3505-22
Das könnte Sie auch interessieren:
Behandlung der Sigmadivertikulitis
Die Divertikulitis gehört zu den häufigsten Krankheitsbildern bei akuten Bauchschmerzen. Die Inzidenz nimmt mit dem Alter stark zu und immer mehr jüngere Patienten erkranken an einer ...
Therapie des Morbus Crohn: bewährte Konzepte und neue Strategien
Welche Behandlungsziele haben Ärzt:innen, die Patient:innen mit Morbus Crohn (MC) behandeln, und haben die Betroffenen die gleichen Ziele? Lassen sich die Therapieziele erreichen, wenn ...
Therapie des Morbus Crohn: Biologikabehandlung optimieren
Prof. Dr. med. Iris Dotan, Rabin Medical Center, Petah Tikva, und Universität Tel Aviv (Israel), zeigte im Rahmen des 9. Postgraduate Course des IBDnet Möglichkeiten auf, wie die ...