Kolondivertikulitis: wann operieren?
Autoren: Dr. med. Vaihere Delaune1,2
Dr. med. Nicolas Christian Buchs1
Dr. med. Emilie Liot1
Prof. Dr. med. Frédéric Ris1
1 Service de chirurgie viscérale
Hôpitaux Universitaires de Genève
2 Laboratoire de chirurgie et transplantation Centre Médical Universitaire
Université de Genève
E-Mail: vaihere.delaune@hcuge.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Inzidenz der Divertikulitis ist im Laufe der letzten Jahrzehnte deutlich gestiegen und immer häufiger sind junge Patienten betroffen. Die therapeutische Strategie ist im Zuge dessen konservativer geworden. Dieser Artikel fasst zusammen, welche Aspekte bei der Entscheidung über eine operative Therapie zu berücksichtigen sind oder – anders ausgedrückt – wann operiert werden sollte.
Keypoints
-
Divertikulitiden im Hinchey-Stadium 0 bis II werden in der Regel konservativ behandelt.
-
Die Notoperation umfasst klassischerweise die Resektion des erkrankten Segments entweder mit Anlage eines endständigen Kolostomas oder einer primären Anastomose (+/– Entlastung durch ein doppelläufiges Ileostoma).
-
Die elektive Sigmaresektion dient nicht mehr der Prävention von Komplikationen oder Rezidiven, sondern der Verbesserung der Lebensqualität und ist bei jedem Patienten individuell zu erwägen.
-
Anpassungen der Lebensweise (wenig Konsum von rotem Fleisch, Gewichtsreduktion, Verzicht auf das Rauchen, körperliche Aktivität) sind wirksame Massnahmen zur Prävention von Rezidiven und sollten gefördert werden.
-
Wenn in den letzten 3 Jahren keine Koloskopie durchgeführt wurde, sollte nach einer Divertikulitisepisode unbedingt ein Kolonkarzinom-Screening stattfinden (Prävalenz kolorektaler Karzinome von 1,9% in dieser Population).
Die Divertikelkrankheit des Kolons, die in den 1970er-Jahren erstmals in Erscheinung trat,1 ist in der westlichen Welt heute eine der häufigsten Erkrankungen des Verdauungssystems.2 Sie ist definiert als Kolondivertikulose, die symptomatisch geworden ist (Infektion/Entzündung und/oder Divertikelblutung).3
Die Häufigkeit der Kolondivertikulose nimmt mit dem Alter zu; ihre Prävalenz bei Patienten ab 60 Jahren wird auf etwa 50% geschätzt.4 Bei den über 80-Jährigen liegt sie bei mehr als 70%.4,5 Die Zahl der erfassten Fälle von Kolondivertikulitiden ist in den letzten Jahrzehnten explodiert, vor allem bei jüngeren Patienten: Ihre Inzidenz bei Personen in der 5. Lebensdekade ist in weniger als 30 Jahren (1980–2007) um 132% gestiegen.6 Insgesamt entwickeln zwischen 10 und 35% der Population mit Kolondivertikulose eine Divertikelkrankheit (Infektion/Entzündung oder Blutung).7
Dieser deutliche Anstieg der Inzidenz der Divertikelkrankheit und das hinzugewonnene Wissen haben dazu geführt, dass sich die Behandlungsstrategien im Laufe der Zeit verändert haben. Deshalb ist es wichtig, dass Chirurgen die Indikationen zur operativen Therapie unter Berücksichtigung der aktuellen Publikationen neu definieren und dabei weniger scharfe Trennlinien anwenden als ihre Vorgänger.
Definitionen, Pathophysiologie und Risikofaktoren
Bei den Kolondivertikeln, die in der westlichen Bevölkerung klassischerweise zu finden sind, handelt es sich eigentlich um «falsche» bzw. Pseudodivertikel. Dies sind Ausstülpungen der Mukosa und Submukosa durch Schwachstellen in der Muskulatur des Kolons hindurch, die an den Eintrittspunkten der Vasa recta bestehen. Solche Pseudodivertikel sind meist im Colon descendens und Sigma zu finden, können jedoch im gesamten Kolon auftreten. «Echte» Divertikel, d.h. Ausstülpungen der gesamten Kolonwand (einschliesslich der Muskelschicht), sind in der Regel in der asiatischen Bevölkerung anzutreffen und vorwiegend im Colon ascendens lokalisiert.8
Die genaue Pathophysiologie der Entstehung von Divertikeln ist nicht endgültig geklärt, es gibt jedoch verschiedene Theorien dazu.4 Der verbreitetsten Theorie zufolge ist die Ursache ein anatomisch bedingt erhöhter intraluminaler Druck im Bereich des rektosigmoidalen Übergangs, der durch eine verlangsamte Darmpassage verstärkt wird; die Entstehung der Divertikel soll dabei durch die Alterung und eine zunehmende Elastizität des Gewebes begünstigt werden. Zwei weitere Erklärungsansätze, die in den letzten zehn Jahren zunehmend in den Fokus der Aufmerksamkeit gerückt sind, gehen von einer neurologischen Degeneration des Kolongewebes, die eine ungeordnete Peristaltik mit Erhöhung des intraluminalen Drucks zur Folge haben kann,9 sowie von einer möglichen genetischen Ursache aus.10
Historisch wurde in den Divertikeln festsitzender Kot für die Divertikulitis verantwortlich gemacht, da dieser zu einer Vermehrung von Bakterien und dadurch zu einer Erosion der Mukosa führe. Aktuellere Theorien halten dagegen eine geringgradige chronische Entzündung in Verbindung mit einer Dysbiose des Darms11 oder auch eine ischämische Ursache bei jungen Patienten für möglich.12
Aufgrund der unsicheren Pathophysiologie werden verschiedene Risikofaktoren genannt. Die ballaststoffarme Ernährung, die lange für die Entstehung der Kolondivertikulose mitverantwortlich gemacht wurde,1 scheint eher ein Risikofaktor für die Divertikelkrankheit zu sein, wenn sie in mit einem hohen Fleischkonsum kombiniert ist.13 Anders als lange vermutet, führt der Verzehr von Nüssen und Kernen nicht zu einem erhöhten Risiko für Divertikelblutungen oder -infektionen.7 Weitere Risikofaktoren für die Divertikelkrankheit sind Adipositas, Rauchen (dosisabhängiges Verhältnis),14 Bewegungsmangel und bestimmte Medikamente (Steroide, nichtsteroidale Antirheumatika).4
Diagnostik und Klassifikationder Kolondivertikulitis
In der Regel klagen die Patienten über Schmerzen im linken Unterbauch, die in den mittleren und/oder rechten Unterbauch ausstrahlen können. Damit einher gehen häufig Fieber und ein labormedizinisch nachweisbares Entzündungssyndrom. Allerdings kann die Diagnose anhand dieser Symptome in der Regel nicht gestellt werden (in <50% der Fälle). Die klinischen Zeichen korrelieren kaum mit der Schwere der Infektion.3
Die CT des Abdomens mit intravenöser (+/– oraler und/oder rektaler) Kontrastmittelgabe ist das radiologische Referenzverfahren.15 Durch sie kann die Diagnose bestätigt, die Schwere der Infektion ermittelt und die Behandlung entsprechend angepasst werden. Die Sonografie des Abdomens kann eine Option sein, wenn sie von einem erfahrenen Radiologen durchgeführt wird; dabei besteht jedoch das Risiko, einen allfälligen Abszess zu übersehen, und die Sensitivität mit Blick auf den Nachweis von Differenzialdiagnosen ist nicht allzu hoch. Die MRT bietet eine hohe Sensitivität und Spezifität in der Diagnostik der Divertikulitis, ist jedoch mit hohen Kosten verbunden und in der Notaufnahme oft nicht durchführbar.16 Bei Schwangeren sind Sonografie und/oder MRT des Abdomens aber durchaus akzeptable Verfahren, um die Diagnose einer Divertikulitis zu stellen.
Divertikulitiden lassen sich in zwei wesentliche Kategorien einteilen: unkomplizierte und komplizierte. Bei der unkomplizierten oder einfachen Divertikulitis sind verdickte Kolonwände und eine Infiltration des perikolischen Fettgewebes im Umkreis eines Divertikels zu beobachten. Bei der komplizierten Divertikulitis lassen sich zwei Unterklassen unterscheiden: die akute Divertikulitis mit Bestehen eines Abszesses und/oder von Zeichen einer freien Perforation in die Peritonealhöhle sowie die chronische fistulöse (Harnblase, Vagina, Haut, anderes Organ) oder stenosierende (entzündlicher Pseudotumor) Divertikulitis.3
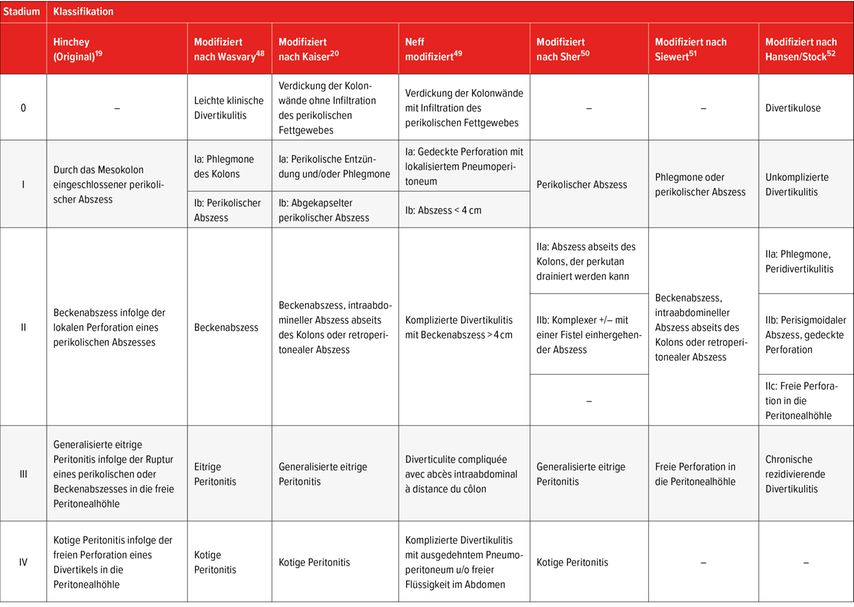
Diese Klassifikation ist jedoch recht grob und gestattet keine differenzierte Betrachtung gewisser Feinheiten, insbesondere hinsichtlich der akuten komplizierten Divertikulitis. Deshalb wurden in den letzten Jahrzehnten noch zahlreiche andere Klassifikationen entwickelt (siehe Überblick in Tabelle 1), um die Behandlung optimal auf die konkrete Situation abstimmen zu können.17,18 Die erste dieser Klassifikationen, die 1978 von Hinchey beschrieben wurde, erforderte eine perioperative Bestimmung des Schweregrads der Divertikulitis;19 inzwischen wurde sie für die CT weiterentwickelt. Unabhängig davon, welche Klassifikation verwendet wird, ist die Unterscheidung zwischen den Stadien III (eitrige Peritonitis) und IV (kotige Peritonitis) nur im Operationssaal möglich. Abbildung 1 gibt einen Überblick über die verschiedenen Stadien.
Tab. 1: Klassifikation der akuten Divertikulitis. Original-Klassifikation nach Hinchey, die 1978 entwickelt wurde und auf einer perioperativen Beurteilung beruhte. Modifizierte, an die CT-Bildgebung angepasste Versionen der Original-Klassifikation. Die Unterscheidung zwischen den Stadien III und IV ist nur im Operationssaal möglich
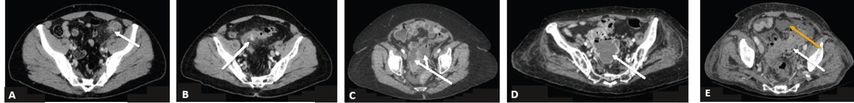
Abb. 1: Illustration der nach Kaiser modifizierten Hinchey-Klassifikation.
A: Hinchey 0 – Verdickung der Kolonwand ohne Infiltration des perikolischen Fettgewebes (Pfeil). B: Hinchey 1a – Verdickung der Kolonwand im Umkreis eines Divertikels mit Infiltration des perikolischen Fettgewebes (Pfeil). C: Hinchey 1b – abgekapselter perikolischer Abszess (Pfeile). D: Hinchey 2 – Beckenabszess (Pfeil). E: Hinchey 3 oder 4 – Divertikulitis-bedingte Verdickung der Sigmawand (weisser Pfeil), freie Flüssigkeit (gelber Pfeil)
Bei der im weiteren Verlauf dieses Textes verwendeten «Hinchey»-Klassifikation handelt es sich um die nach Kaiser modifizierte Hinchey-Klassifikation.20
Therapie der akuten Episode
Konservative Therapie
Die konservative Behandlung ist in erster Linie bei unkomplizierter Divertikulitis (Hinchey 0 und Ia) oder komplizierter Divertikulitis mit Abszess (Hinchey Ib oder II) indiziert.
Bei Divertikulitiden im Hinchey-Stadium 0 und Ia entscheiden sich immer mehr Zentren für eine ambulante Behandlung der Patienten mit einer oralen Antibiose.21 In drei randomisierten Studien wurde sogar eine noch zurückhaltendere, rein entzündungshemmende Therapie (ohne Antibiotika) untersucht, die sich bei leichten Formen als nicht unterlegen erwiesen hat.22–24 Dieses Ergebnis wird durch aktuelle Metaanalysen bestätigt,25–27 sodass diese Therapie inzwischen von mehreren Fachgesellschaften und nationalen Leitlinien empfohlen wird, insbesondere in den skandinavischen Ländern und den Niederlanden.3,28
Bei abszedierten Divertikulitiden (Hinchey Ib und II) kommt bei stabilen Patienten als Erstlinientherapie in der Regel eine Antibiose zum Einsatz. Diese kann mit einer bildgesteuerten Drainage kombiniert werden, wenn der Abszess grösser als 4cm und radiologisch zugänglich ist.3 Diese konservative Akutbehandlung ist in etwa 80% der Fälle wirksam.28
Notfallmässige operative Therapie
Die notfallmässige operative Therapie einer akuten Episode ist im Fall eines ungünstigen Verlaufs einer konservativ behandelten Divertikulitis, bei ausbleibender Besserung einer abszedierten Divertikulitis trotz bildgesteuerter Drainage und optimaler Antibiose (ca. 15–32% der Patienten28), bei hämodynamischer Instabilität und/oder im Fall einer Peritonitis indiziert.
Die Wahl des Zugangs und des Operationsverfahrens ist nach wie vor sehr umstritten. Traditionell wurde zur notfallmässigen Behandlung komplizierter Divertikulitiden eine Notoperation mit Sigmaresektion und Anlage eines endständigen Kolostomas im linken Unterbauch nach Hartmann empfohlen. Bis zu 50% der so behandelten Patienten behalten ihr Stoma jedoch lebenslang.29,30 Mehrere randomisierte Studien haben gezeigt, dass bei hämodynamisch stabilen Patienten ohne schwere Begleiterkrankungen, die eine generalisierte Peritonitis hatten, eine Sigmaresektion mit direkter Anastomose in Verbindung mit einem Entlastungs-Ileostoma nicht nur hinsichtlich der Morbidität und der Mortalität vergleichbar war, sondern dass bei diesen Patienten auch deutlich häufiger die Darmkontinuität wiederhergestellt werden konnte.31–33 Die Komplikationsrate steigt allerdings beträchtlich, wenn die primäre Anastomosierung notfallmässig von einem Chirurgen ohne Spezialisierung auf Kolorektalchirurgie durchgeführt wird.34 Im Übrigen scheint in einigen ausgewählten Fällen eine «Damage-Control»-Notoperation mit Resektion des betroffenen Darmsegments und anschliessender Revisionsoperation nach 36–48 Stunden mit direkter Anastomose eine Möglichkeit zu sein.35 Trotz dieser ermutigenden Ergebnisse kommt die Hartmann-Operation mit Anlage eines Kolostomas nach wie vor am häufigsten zum Einsatz36 und die Wahl des Verfahrens ist weiterhin von der Einschätzung des Chirurgen, seiner Spezialisierung, den vor Ort verfügbaren Ressourcen und seiner Erfahrung abhängig,3,28 auch wenn die aktuellen Empfehlungen in Richtung einer direkten Wiederherstellung der Kontinuität gehen.
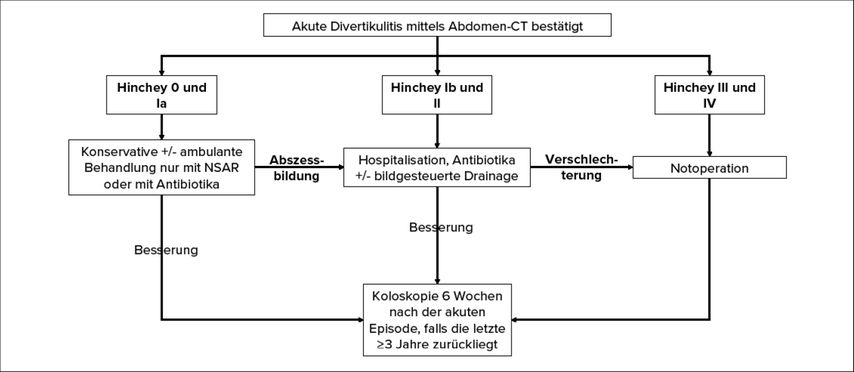
Bei eitriger Peritonitis (Hinchey III) findet die Organerhaltung allein mit laparoskopischer Lavage immer mehr Befürworter. In den aktuellen Leitlinien wird jedoch weiterhin die Kolonresektion als Goldstandard empfohlen. Tatsächlich ist es in den randomisierten Studien zur laparoskopischen Lavage nicht gelungen, deren Überlegenheit gegenüber der konventionellen Therapie nachzuweisen; stattdessen wurden ähnliche Komplikationsraten, eine erhöhte Morbidität und ein Risiko der Nichterkennung maligner Erkrankungen beobachtet.37–39 Diese Strategie ist somit nur in sehr ausgewählten Fällen eine valide Option. Die Therapie der akuten Divertikulitis ist in Abbildung 2 zusammenfasst.
Abb. 2: Therapiealgorithmus für die akute Divertikulitis entsprechend der nach Kaiser modifizierten Hinchey-Klassifikation
Operationsindikationen nach der akuten Episode
Das elektive Operationsverfahren der Wahl ist heute, wenn möglich, die minimal invasive (laparoskopische) Sigmaresektion. Sie umfasst die Resektion von Sigma und rektosigmoidalem Übergang mit direkter kolorektaler Anastomose (prinzipiell ohne Stoma). In jedem Fall muss bei einer ersten Divertikulitis-Episode oder einer komplizierten Divertikulitis mit Abszess 6 Wochen nach der akuten Episode eine Kontrollkoloskopie stattfinden, sofern innerhalb der letzten 3 Jahre keine Koloskopie durchgeführt wurde, damit eine allfällige maligne Grunderkrankung nicht übersehen wird.40
Nach Abklingen der akuten Episode gibt es formal zwei Indikationen zur elektiven Operation: chronische Komplikationen der Divertikulitis (Kolonstenose; Fistel zwischen Kolon und einem anderen Organ) oder Nachweis eines Karzinoms bei der Koloskopie.
Die relativen Operationsindikationen sind individuell für jeden Patienten zu beurteilen:
Anzahl akuter Episoden
Die grösste Veränderung der chirurgischen Strategie in den letzten 20 Jahren betrifft die Indikation zu einer elektiven Operation nach mehreren unkomplizierten Divertikulitis-Episoden. Das Dogma, nach zwei Episoden operieren zu müssen, wurde nach und nach abgelegt und durch eine Beurteilung anhand der Auswirkungen auf die Lebensqualität der Patienten ersetzt. Dieses Dogma ist aus der Befürchtung erwachsen, die Zahl der Rezidive und das Risiko einer Perforation mit daraus resultierendem Stoma seien nach zwei Episoden erhöht. Inzwischen ist jedoch erwiesen, dass das Perforationsrisiko nicht mit der Zahl der Schübe ansteigt41,42 und dass das Rezidivrisiko nach zwei akuten Schüben vernachlässigbar ist.43 So ist das Ziel der Komplikationsprävention allmählich dem Ziel einer Verbesserung der Lebensqualität der Patienten gewichen. Die elektive operative Therapie der Divertikelkrankheit verbessert die Lebensqualität von Patienten mit häufig rezidivierender Divertikulitis erheblich und reduziert das Rezidivrisiko auf weniger als 5%, ist jedoch in etwa 10% der Fälle mit schweren Komplikationen verbunden.44
Immunsuppression
Bei immunsupprimierten Patienten ist die Indikation zu einer «prophylaktischen» Operation nach einer ersten Divertikulitis-Episode nach wie vor umstritten. Zwar gibt es Hinweise darauf, dass das klinische Bild bei transplantierten und/oder über längere Zeit mit Kortikoiden behandelten Patienten schwerwiegender ist,45,46 bei diesen Patienten besteht postoperativ jedoch auch ein erhöhtes Morbiditäts- und Mortalitätsrisiko, weshalb die Behandlung personalisiert werden muss.
Persistierende Schmerzen
Eine erste akute Episode mit Abszess und/oder eine über die akute Episode hinaus persistierende Schmerzsymptomatik sind relative Indikationen für eine elektive Operation, die in jedem Fall individuell bewertet und diskutiert werden müssen. Dieser Punkt ist von entscheidender Bedeutung, denn bei Patienten mit bekanntem Reizdarm besteht nach Kolonresektion ein erhöhtes relatives Risiko eines Wiederauftretens der Schmerzen.47
Die Indikation zu einer elektiven Operation nach einer oder mehreren Divertikulitis-Episoden (Tab. 2) ist somit für jeden Patienten in Abhängigkeit von seinen Begleiterkrankungen, der Zahl der Episoden und den Auswirkungen dieser Episoden auf seine Lebensqualität zu bewerten.3,28
Fazit
Die Inzidenz der Divertikelkrankheit steigt seit ihrer Erstbeschreibung in den 1970er-Jahren stetig an, insbesondere bei immer jüngeren Patienten. Aus diesem Grund ist die Behandlungsstrategie in den letzten Jahren deutlich konservativer geworden. Die Indikation zu einer elektiven Operation ist nicht mehr auf die Prävention von Rezidiven oder die Entwicklung schwerer Formen ausgerichtet, sondern auf die Auswirkungen auf die Lebensqualität und/oder das Auftreten von Komplikationen nach Abklingen der akuten Episode (Schmerzen, Stenose, Fistel). Im Fall einer Peritonitis oder eines ungünstigen Verlaufs einer Divertikulitis ist die notfallmässige operative Therapie jedoch nach wie vor notwendig.
Aufgrund der erhöhten Prävalenz von kolorektalen Karzinomen in dieser Population (1,9%) sollte bei Patienten, bei denen in den letzten 3 Jahren keine Koloskopie durchgeführt wurde, 6 Wochen nach der akuten Episode eine Koloskopie gemacht werden.
Literatur:
1 Burkitt DP et al.: JAMA 1974; 229: 1068-74 2 Strate LL, Morris AM: Gastroenterology 2019; 156: 1282-98.e1 3 Schultz JK et al.: Colorectal Dis 2020; 22 (Suppl 2): 5-28 4 Feuerstein JD, Falchuk KR: Mayo Clin Proc 2016; 91: 1094-104 5 Everhart JE, Ruhl CE: Gastroenterology 2009; 136: 741-54 6 Bharucha AE et al.: Am J Gastroenterol 2015; 110: 1589-96 7 Strate LL et al.: JAMA 2008; 300: 907-14 8 Tursi A et al.: Aliment Pharmacol Ther 2015; 42: 664-84 9 Wedel T et al.: Neurogastroenterol Motil 2010; 22: 407-e94 10 Granlund J et al.: Aliment Pharmacol Ther 2012; 35: 1103-7 11 Simpson J et al.: Br J Surg 2003; 90: 899-908 12 Piscopo N, Ellul P: Ulster Med J 2020; 89: 83-8 13 Crowe FL et al.: BMJ 2011; 343: d4131 14 Peery AF: N C Med J 2016; 77: 220-2 15 Laméris W et al.: Eur Radiol 2008; 18: 2498-511 16 Heverhagen JT et al.: Dis Colon Rectum 2008; 51: 1810-5 17 Stocchi L: World J Gastroenterol 2010; 16: 804-17 18 Bates DDB et al.: Abdom Radiol 2018; 43: 2060-5 19 Hinchey EJ et al.: Adv Surg 1978; 12: 85-109 20 Kaiser AM et al.: Am J Gastroenterol 2005; 100: 910-7 21 Biondo S et al.: Ann Surg 2014; 259: 38-44 22 Chabok A et al.: Br J Surg 2012; 99: 532-9 23 Daniels L et al.: Br J Surg 2017; 104: 52-61 24 Mora-López L et al.: Ann Surg 2021; 274: e435 25 Au S, Aly EH: Dis Colon Rectum 2019; 62: 1533-47 26 Desai M et al.: al.: Br J Surg 2020; 107: 1062-9 27 van Dijk ST et al.: Observational versus antibiotic treatment for uncomplicated diverticulitis: an individual-patient data meta-analysis. Br J Surg 2020; 107: 1062-9 28 Hall J et al.: Dis Colon Rectum 2020; 63: 728-47 29 Salem L et al.: Dis Colon Rectum 2005; 48: 988-95 30 Roig JV et al.: Cir Esp 2018; 96: 283-91 31 Oberkofler CE et al.: Ann Surg 2012; 256: 819-26; discussion 826-827 32 Bridoux V et al.: J Am Coll Surg 2017; 225: 798-805 33 Lambrichts DPV et al.: Lancet Gastroenterol Hepatol 2019; 4: 599-610 34 Goldstone RN et al.: Dis Colon Rectum 2019; 62: 71-8 35 Faes S et al.: BJS Open 2021; 5: zrab106 36 Cauley CE et al.: Dis Colon Rectum 2018; 61: 586-92 37 Angenete E et al.: Ann Surg 2016; 263: 117-22 38 Schultz JKet al.: JAMA 2015;314:1364-75 39 Vennix S et al.: Lancet 2015; 386: 1269-77 40 Meyer J et al.: Clin Gastroenterol Hepatol 2019; 17: 1448-56.e17 41 Buchs NC et al.: Br J Surg 2013; 100: 976-9 42 Buc E et al.: Gastroentérologie Clin Biol 2007; 31: 35-46 43 Broderick-Villa G et al.: Arch Surg 2005; 140: 576-81; discussion 581-3 44 Santos A et al.: JAMA Surg 2021; 156: 129-36 45 Hwang SS et al.: Dis Colon Rectum 2010; 53: 1699-707 46 Oor JE et al.: J Gastrointest Surg Off J Soc Surg Aliment Tract 2014; 18: 2038-46 47 Choi KK et al.: Am Surg 2020; 86: 49-55 48 Wasvary H et al.: Am Surg 1999; 65: 632-5; discussion 636 49 Mora Lopez L et al.: Colorectal Dis 2013; 15: 1442-7 50 Sher ME et al.: Surg Endosc 1997; 11: 264-7 51 Siewert JR et al.: Chirurg 1995; 66: 1182-9 52 Hansen O et al.: Chirurg 1998; 69: 443-9
Das könnte Sie auch interessieren:
Das kardiovaskuläre Risiko von IBD-Patienten
Eine aktive IBD erhöht das Risiko für kardiovaskuläre Erkrankungen, während bestehende kardiovaskuläre Probleme die Wahl der Medikation erschweren. Das Ziel ist es, die richtige Balance ...
Aktuelle Studien aus Gastroenterologie und Hepatologie
Am Jahreskongress der Schweizerischen Gesellschaft für Gastroenterologie (SSG) und der Swiss Association for the Study of the Liver (SASL) vom 11. bis 12. September 2025 in Interlaken ...
Neues aus der Gastroenterologie
Nicht jede Alkoholisierung ist auf Alkoholkonsum zurückzuführen. Beim sogenannten Eigenbrauer-Syndrom kommt es infolge pathologischer Auffälligkeiten des Darmmikrobioms zur endogenen ...