Wie therapiere ich fortgeschrittene kutane T-Zell-Lymphome?
Autor:
Prof. Dr. Rudolf Stadler
Leiter Dermatopathologie
Universitätsklinik für Dermatologie
Johannes Wesling Klinikum, Minden
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Je weiter kutane T-Zell-Lymphome fortschreiten, desto geringer die Überlebenszeit der Patienten. Es gilt daher, therapeutische Maßnahmen rechtzeitig zu setzen. Bewährt haben sich die Kombination verschiedener Behandlungsoptionen und Einleitung systemischer Therapien. Zur Verfügung stehen unter anderem Immunmodulatoren, Antibiotika und Strahlentherapie.
Keypoints
-
Anti-CCR4-Antikörper Mogamulizumab und Fusionstoxin Brentuximab-Vedotin ermöglichen zielgerichtete Antikörpertherapie.
-
Die Strahlentherapie nach Niedrigdosis-Schema zeigt sehr gute Remissionen bei geringen Rezidiven.
-
Eine Antibiotikatherapie hilft, pathogene Überwucherungen bei ulzerierten Tumoren zu verhindern.
-
Einziger kurativer Ansatz bleibt in Ausnahmefällen die allogene Stammzelltransplantation.
Kutane T-Zell-Lymphome sind eine heterogene Gruppe von Non-Hodgkin-Lymphomen, hauptsächlich repräsentiert durch das kutane T-Zell-Lymphom vom Typ der Mycosis fungoides und der leukämischen Variante dem Sézary-Syndrom in mehr als 60% der Fälle.1 In den frühen Stadien entspricht die Überlebenszeit des kutanen T-Zell-Lymphoms vom Typ der Mycosis fungoides dem der Normalbevölkerung, während mit dem Tumorstadium das mittlere Überleben unter fünf Jahre- und bei viszeralem Befall unter zwei Jahre sinkt, und für das Sézary-Syndrom unter vier Jahren liegt.2 Dies bedeutet einerseits, den Progress früher Stadien in fortgeschrittene zu verhindern, und andererseits, komplexe systemische Therapien und Kombinationstherapien zu initiieren, um das Schicksal der betroffenen Patienten nachhaltig zu beeinflussen.
Mit der internationalen PROCLIPI-Studie („prospective cutaneous lymphoma international prognostic index“) konnte anhand von 1486 Patienten (77,6% der Gesamtkohorte) gezeigt werden, dass 7% der Betroffenen per anno progredient sind und sich in ein fortgeschrittenes Stadium entwickeln.3 Hierbei sind signifikante Risikofaktoren: eine Lymphknotenbeteiligung egal welchen N-Stadiums, ein erhöhter LDH-Wert sowie das Vorhandensein von ausgedehnten Plaques, die großzellige Transformation und das Alter des Patienten. Sonderformen, wie z.B. die follikulotrope Mycosis fungoides waren nicht mit einer erhöhten Stadiumprogression assoziiert (EORTC/CLTF meeting Marseille).
Das Stadium bestimmt die Therapie
Die stadiengerechte Behandlung des kutanen T-Zell-Lymphoms wird von allen nationalen, europäischen und internationalen Leitlinien empfohlen.4 Für die Systemtherapie der fortgeschrittenen Mycosis fungoides und des Sézary-Syndroms stehen Immunmodulatoren wie das spezifische RXR-Retinoid Bexaroten und rekombinantes Interferon (IFN) zur Verfügung und für das Sézary-Syndrom die extrakorporale Photopherese. Als Ersatz für das bisher eingesetzte rekombinante IFN-α wird pegyliertes (PEG-)IFN in Europa verwendet. Darüber hinaus erlebt die Strahlentherapie mit Niedrigdosis-Ansätzen eine Renaissance in der Therapie des fortgeschrittenen frühen kutanen T-Zell-Lymphoms wie auch die Ganzkörperstrahlentherapie nach dem Niedrigdosis-Schema.6
Ein wesentlicher Fortschritt in der Systemtherapie des fortgeschrittenen kutanen T-Zell-Lymphoms basiert auf einer zielgerichteten Antikörpertherapie, in erster Linie auf Mogamulizumab, einem Anti-CCR4-Antikörper und auf dem Fusionstoxin Brentuximab vedotin. In den USA stehen zudem HDAC-Inhibitoren, wie Romidepsin und Vorinostat, die in Europa keine Zulassung erhalten haben, zur Verfügung. Als Monochemotherapeutika haben sich vor allen Dingen in den letzten Jahren Gemcitabin und pegyliertes Doxorubicin etabliert. CHOP und CHOP-ähnliche Schemata gelten als Zweit- und Drittlinien-Therapie. Darüber hinaus steht für Betroffene mit fortgeschrittenen kutanen T-Zell-Lymphomen als möglicher kurativer Ansatz mit sorgfältiger Indikationsstellung die allogene Stammzelltransplantation zur Verfügung. Dies bedeutet jedoch ein sehr verantwortliches ärztliches Handeln, da mit dieser Therapie eine erhebliche Letalität verbunden sein kann.7
Zur Therapie des fortgeschrittenen kutanen T-Zell-Lymphoms sind generelle Prinzipien in der Behandlung zu beachten. Es sollte ein individuelles therapeutisches Konzept erstellt werden, das berücksichtigt, ob es sich um ein frühes, fortgeschrittenes oder spät fortgeschrittenes kutanes T-Zell-Lymphom handelt.
Stellenwert der Hautpflege
Die Hautpflege spielt bei fortgeschrittenen kutanen T-Zell-Lymphomen eine besondere Rolle. Es gilt das residente Mikrobiom zu konservieren und pathogene Überwucherungen des Hautorgans zu verhindern. Parallel hierzu ist eine hochkalorische Substitutionstherapie zur Vermeidung einer Tumorkachexie oder gegebenenfalls auch eine parenterale Substitution erforderlich. Der Einsatz einer systemischen Antibiotikatherapie ist bei disseminiert ulzerierten Tumoren, die mit pathogenen Keimen besiedelt sind, indiziert. In Einzelfällen befinden sich die Patienten im einem immundefizitären Zustand. Das Immunsystem sollte in diesen Fällen mit Immunglobulinen stabilisiert werden. Insgesamt sollten zytotoxische Substanzen möglichst nur kurzfristig eingesetzt oder ihr Einsatz vermieden werden.
Auch 2021 gibt es nicht den einen richtigen Weg, die fortgeschrittene Mycosis fungoides oder das Sézary-Syndrom zu behandeln, aber es gilt, Behandlungsfehler zu vermeiden. Dies beinhaltet keine Therapieverzögerung sondern den rechtzeitigen Einsatz Haut gerichteter Therapien in Kombination mit immunmodulierenden Systemtherapeutika. Darüber hinaus ist der Einsatz von Antibiotika bei ulzerierten Tumoren zu erwägen, um die Keimbelastung zu reduzieren. Lindahl et al. haben 2019 darüber berichtet, dass Antibiotika in der Lage sind, nicht nur das Tumorwachstum fortgeschrittener kutaner T-Zell-Lymphom zu stoppen, sondern auch die Patienten in einen stabilen Zustand zu überführen.8Staphylococcus aureus-Exotoxine sind in der Lage, über Phosphorylisierung von Interleukin-2-Rezeptoren die Proliferation maligner kutaner T-Zell-Lymphome zu beschleunigen. Die Blockade der Toxinsekretion führt, wie von Lindahl gezeigt, zu einer Regression der kutanen Tumorproliferate. Patienten wurden mit Cefuroxin (1,5g) und Metronidazol (0,5g) dreimal pro Tag für 10 Tage systemisch behandelt, gefolgt von einer oralen Anwendung von Amoxicillin und Clavulansäure (500/125mg) dreimal pro Tag für 14 Tage. Hieraufhin zeigte sich eine Rückbildung der Tumorlast und Krankheitsentität sowie eine Abnahme der Anteile maligner T-Zell-Klone.8
Fallbericht
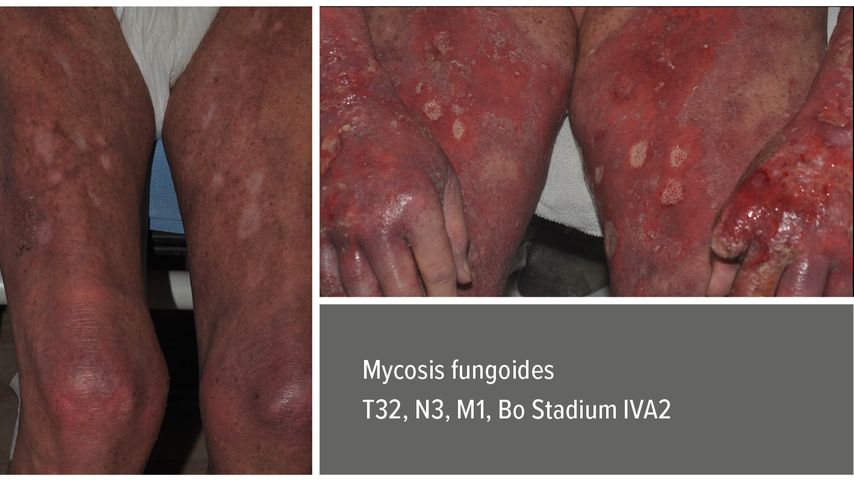
Als Beispiel möchte ich Ihnen einen Patienten mit Mycosis fungoides, T3 N3 M1 B0, Stadium IVA2, präsentieren, der mit einer komplexen Systemtherapie des genannten Antibiotikaschemas, Immunglobuline einmal wöchentlich 2g/kg Körpergewicht, begleitet von einer parenteralen Substitutionstherapie und Mogamulizumab (CCR4-Antikörper) systemisch behandelt wurde. Unter dieser Komplexbehandlung kam es zur Rückbildung der ausgedehnten Ulzerationen und Tumoren mit einer fast kompletten Remission. Der schwer gezeichnete, bettlägerige Patient konnte das Klinikum in aufrechtem Gang verlassen und befindet sich jetzt seit über einem Jahr in partieller Remission (Abb. 1).
Abb. 1: 70-jähriger Mann, komplexe Therapie, Antibiotikaschema nach Lindahl, Immunglobuline und Mogamulizumab, komplette Rückbildung der spezifischen Hauterscheinungen
Zusätzliche Therapieoptionen
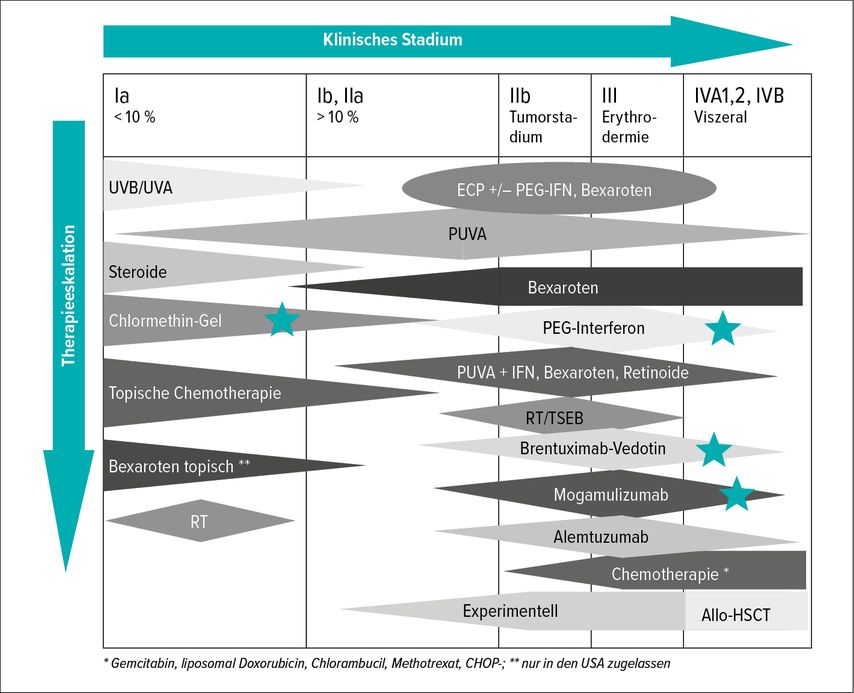
Die Haut gerichteten und Systemtherapien der gerade aktualisierten deutschen S2k-Leitlinie 2021 Kutane Lymphome9 sind in Abbildung 2 dargestellt. Sie können unter www.AWMF.org aufgerufen werden. Als neu aufgenommen in diese Leitlinie gilt die Lokaltherapie mit Chlormethin-Gel sowie PEG-IFN, das in der bekannten rekombinanten Form von der Firma Hoffmann-La Roche nicht mehr zur Verfügung gestellt wird. Es wird nach Studienergebnissen, die von Schiller et al. veröffentlich wurden, mit einer Dosis von 135–270μg subkutan pro Woche eingesetzt.10
Unter den auf die Haut gerichteten Therapien, insbesondere in frühen Tumorstadien, hat sich die Niedrigdosis-Therapie mit 2x4 Gy pro Tumorläsion oder 4–9 Gy oder auch 8Gy durchgesetzt. In allen publizierten Studien wurden komplette Remissionsraten von 92–94% erreicht bei nur geringen Rezidivraten.
Die Ganzkörperstrahlentherapie („total skin electron beam“, TSEB) ist indiziert ab >30% Beteiligung der Körperoberfläche. In der in den letzten Jahren entwickelten 6-Feld-Technik konnte gezeigt werden, dass auch niedrige Dosen 12 Gy versus früher 30 Gy TSEB zu einer dramatischen Erscheinungsfreiheit bei den Betroffenen geführt hat bis zu allgemeinen Ansprechraten von 96%.
Im Stadium IIIA für das fortgeschrittene Tumorstadium stehen dann von den klassischen Therapeutika Gemcitabin als low-dose-Therapie und pegyliertes Doxorubicin zur Verfügung. Im Stadium IIIA/B der Mycosis fungoides wird als Erstlinien-Therapie die extracorporale Photopherese kombiniert mit PEG-IFN-α 135μg pro Woche oder Bexaroten 150–300mg/m2 Körperoberfläche empfohlen wie auch die Ganzkörperbestrahlung.
Als Zweitlinien-Therapie wird heutzutage Mogamulizumab als Therapie der Wahl, bei Versagen der vorausgegangenen Systemtherapien oder Haut gerichteten Therapien angesehen. Seit mehr als einem Jahr ist Mogamulizumab, ein humanisierter CCR4-Antikörper als Zweitlinien-Therapie zur Behandlung des kutanen T-Zell-Lymphoms zugelassen. In der bisher größten, jemals durchgeführten, randomisierten Mogamulizumab-Studie (MAVORIC) zeigte vor allen Dingen für das Blutkompartiment Ansprechraten von 60% bei systemischer Verabreichung als Infusionstherapie in einer Dosis von 1mg/kg Körpergewicht an Tag 1, 8, 15 und 22 eines 28-tägigen Zyklus, gefolgt von zweiwöchiger Applikation an Tag 1 und 15. Die Wirkung zeigte sich unbeeinflusst von vorausgegangenen Therapien. Insofern gilt gerade Mogamulizumab als Therapeutikum der Wahl, zurzeit noch als Zweitlinien-Therapie für erythroderme Stadien der Mycosis fungoides wie für das Sézary-Syndrom.11 Das Fusionstoxin Brentuximab-Vedotin hat die Möglichkeiten in der Therapie des fortgeschrittenen kutanen T-Zell-Lymphoms wesentlich bereichert. In der kontrolliert durchgeführten Phase-III-ALCANZA-Studie, die Brentuximab-Vedotin versus Standardwahl des behandelnden Arztes mit Methotrexat oder Bexaroten verglich, überzeugte die Verumgruppe mit einem beeindruckenden progressionsfreien Überleben von 16,7 Monaten. In einer Subgruppenanalyse zeigte sich keine Korrelation zwischen dem Ansprechen der Mycosis fungoides auf Brentuximab-Vedotin und der CD30-Expression. Die CD30-Expression in den einzelnen Tumoren ist sehr heterogen von 0 bis weit über 50%, so dass vor Indikationsstellung mehrere kleine Hautbiopsien zur Bestimmung der CD30-Expression entnommen wurden.12 Es zeigte sich jedoch eine Tendenz, dass je höher die CD30-Expression pro Tumorentität ist, desto länger auch das erscheinungsfreie Intervall. Gerade mit dem Fusionstoxin Brentuximab-Vedotin ergeben sich zahlreiche Kombinationsmöglichkeiten bei fortgeschrittenen kutanen T-Zell-Lymphomen wie etwa die Tumorexzision, Niedrigdosis-Strahlentherapie, systemische PUVA-Therapie, Chlormethin-Gel-Anwendungen.13
In der Zukunft werden eine Reihe neuer Antikörper, die zurzeit evaluiert werden, zur Verfügung stehen, wie Lakutamab, das CD158k als Zielstruktur adressiert,14 oder auch Antikörper gegen das Molekül CD47. Beim Sézary-Syndrom steht als Drittlinien-Therapie Alemtuzumab mit Zielstruktur Anti-CD52 zur Verfügung. Auch der Einsatz von Immuncheckpoint-Molekülen gegen das kutane T-Zell-Lymphom wird zurzeit intensiv geprüft, wobei hier noch zahlreiche Fragen offen sind, wie etwa welche Patienten wirklich von einem solchen Therapieansatz profitieren würden.
Zum Abschluss noch ein Wort zur Erhaltungstherapie. Da auch bis zum jetzigen Zeitpunkt keine kurative Therapie zur Verfügung steht – mit Ausnahme der allogenen Knochenmarktransplantation in Einzelfällen – gilt es, die erreichte Remission zu konservieren. Hierzu wird zurzeit die größte, jemals durchgeführte Erhaltungstherapie-Studie (RESMAIN) mit Resminostat (HDAC-Inhibitor) durchgeführt.15 Die Studie steht mit dem Einschluss von 190 Patienten kurz vor ihrem Rekrutierungsziel. Mit einer endgültigen Auswertung ist im Jahr 2023 zu rechnen.
Literatur:
1 Willemze R et al.: The 2018 update of the WHO-EORTC classification for primary cutaneous lymphomas. Blood 2019; 133(16): 1703-14 2 Quaglino P et al.: Phenotypical markers, molecular mutations, and immune microenvironment as targets for new treatments in patients with mycosis fungoides and/or Sézary syndrome. J Invest Dermatol 2021; 141(3): 484-95 3 Scarisbrick JJ et al.: The PROCLIPI international registry of early-stage mycosis fungoides identifies substantial diagnostic delay in most patients. Br J Dermatol 2019; 181(2): 350-57 4 Trautinger F et al.: European organisation for research and treatment of cancer consensus recommendations for the treatment of mycosis fungoides/Sézary syndrome - Update 2017. Eur J Cancer 2017; 77: 57-74 5 Dummer R et al.: Cutaneous T cell lymphoma. Nat Rev Dis Primers 2021; 7(1): 61 6 Elsayad K et al.: Low-dose total skin electron beam therapy: Quality of life improvement and clinical impact of maintenance and adjuvant treatment in patients with mycosis fungoides or Sezary syndrome. Strahlenther Onkol 2020; 196(1): 77-84 7 Quaglino P et al.: Global patterns of care in advanced stage mycosis fungoides/Sezary syndrome: a multicenter retrospective follow-up study from the Cutaneous Lymphoma International Consortium. Ann Oncol 2017; 28: 2517-25 8 Lindahl LM et al.: Antibiotics inhibit tumor and disease activity in cutaneous T-cell lymphoma. Blood 2019; 134(13): 1072-83 9 S2k-Leitlinie Kutane Lymphome (ICD10 C82-C86): https://www.awmf.org/leitlinien/detail/ll/032-027.html , [letzter Zugriff: 16. Dez. 2021] 10 Schiller M et al.: Dose-escalation study evaluating pegylated interferon alpha-2a in patients with cutaneous T-cell lymphoma. J Eur Acad Dermatol Venereol 2017; 31(11): 1841-47 11 Kim YH et al.: Mogamulizumab versus vorinostat in previously treated cutaneous T-cell lymphom (MAVORIC): an international, open-label randomised, controlled phase 3 trial. Lancet Oncol 2018; 19: 1192-204 12 Prince HM et al.: Brentuximab vedotin or physician’s choice in CD30-positive cutaneous T-cell lymphoma (ALCANZA): an international, open-label, randomised, phase 3, multicentre trial. Lancet 2017; 390: 555–66 13 Wehkamp U et al.: Management der Chlormethin-Gel-Behandlung bei Patienten mit Mycosis fungoides in zwei deutschen Hautlymphom-Zentren. J Dtsch Dermatol Ges. 2021; 19(7): 1057-60 14 Bagot M et al.: IPH4102, a first-in-class anti-KIR3DL2 monoclonal antibody, in patients with relapsed or refractory cutaneous T-cell lymphoma: an international, first-in-human, open-label, phase 1 trial. Lancet Oncol 2019; 20(8): 1160-70 15 Stadler R, Scarisbrick JJ: Maintenance therapy in patients with mycosis fungoides or Sézary syndrome: A neglected topic. Eur J Cancer 2021; 142: 38-47
Das könnte Sie auch interessieren:
«Was wir brauchen, ist Aufklärung auf allen Ebenen»
Aufgrund der Seltenheit des hereditären Angioödems (HAE) dauert es oft lange, bis Betroffene eine korrekte Diagnose erhalten. Die Schweizer HAE-Vereinigung setzt sich seit fast 25 Jahren ...
«Wir reden in der Medizin zu wenig über Sex»
Wer im Kontext von Haut und Sexualität primär an sexuell übertragbare Infektionen (STI) denkt, könnte überrascht werden. Denn das Thema Sexualität ist gesundheitlich aus ganz ...
Die menschliche Haut in der modernen Kunst
Dr. Ralph Ubl, Professor für neuere Kunstgeschichte an der Universität Basel, stellte sich der schwierigen Herausforderung, einem Raum voller erwartungsvoller Dermatologen das Organ Haut ...