Wie Neutrophile und NETs die Inflammation beeinflussen
Bericht:
Martha-Luise Storre
Die Funktionen von Neutrophilen sind vielseitig. So spielen sie eine essenzielle Rolle bei der Immunabwehr. Jedoch können Neutrophile über verschiedene Wirkmechanismen das Entstehen oder Voranschreiten von Hauterkrankungen oder Allergien begünstigen. Es folgt ein Überblick über die zugrunde liegenden Mechanismen und darüber, welche Indikationen davon besonders betroffen sind.
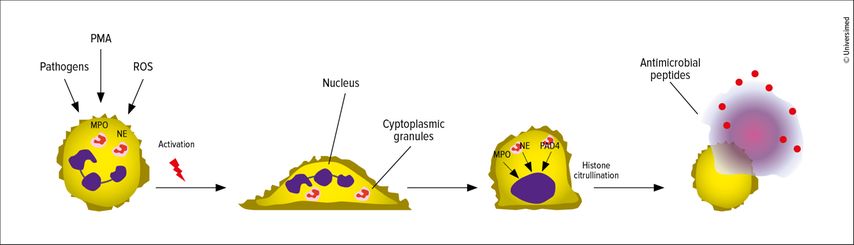
Neutrophile sind ein Teil des angeborenen Immunsystems und stellen die häufigsten weissen Blutkörperchen dar. Sie stehen an vorderster Front bei der Abwehr von Pathogenen wie Bakterien, Viren oder Pilzen, sei es durch Degranulation, Phagozytose oder «neutrophil extracellular traps» (NETs). Für die sogenannte NETose schleusen die Neutrophilen ihr Chromatin aus und nutzen es als eine Art Fischernetz, um Pathogene einzufangen, zu immobilisieren und vermutlich auch zu eliminieren, wie Prof. Dr. med. Luise Erpenbeck von der Klinik für Hautkrankheiten des Universitätsklinikums Münster erklärte. Bei der NET-Bildung handelt es sich laut der Expertin um einen hochinteressanten Vorgang: Die Aktivierung der Neutrophilen erfolgt durch Pathogene. Im weiteren Verlauf wandern Enzyme in den Zellkern ein und modifizieren dort die Histone, sodass das Chromatin zunächst innerhalb der Zelle expandiert. Sobald die Zelle platzt, wird das NET gemeinsam mit antimikrobiellen Substanzen freigesetzt (s. Abb. 1).1Dass Pathogene auf diese Art von Neutrophilen immobilisiert werden können, sei an sich ein sinnvoller Vorgang. Wenn jedoch das Gleichgewicht kippt und zu viel Neutrophilenaktivierung oder ein gestörter Abbau der NETs vorliegen, können daraus verschiedene Erkrankungen entstehen, erklärte Erpenbeck. Hierzu zählen unter anderem Psoriasis, Gicht, diverse Autoimmun- sowie allergische Erkrankungen.2
Wirkmechanismen von Neutrophilen
Die Neutrophilen können das Entzündungsgeschehen unter anderem bei Hauterkrankungen über vier verschiedene Mechanismen beeinflussen: als Quelle von Autoantigenen, durch Freisetzung von proinflammatorischen Substanzen, Crosstalk mit weiteren Zellen des Immunsystems oder durch Antigenpräsentation. Im Folgenden sollen diese Mechanismen anhand von Beispielerkrankungen erläutert werden.
Neutrophile als Quelle von Autoantigenen
Ein prominentes Exempel für Neutrophile als Quelle von Autoantigenen ist der systemische Lupus erythematodes. Bei dieser Autoimmunerkrankung liegen Autoantikörper gegen nukleäre Antigene vor. Im weiteren Verlauf kommt es zu Ablagerungen von Immunkomplexen sowie Inflammation und Organschäden. Bei Lupuspatientinnen und -patienten werden vermehrt NETs gebildet, vor allem von neutrophilen Granulozyten geringerer Dichte («low density granulocytes», LDG). Diese LDGs produzieren besonders viele NETs.3 Das im extrazellulären Raum freigesetzte Chromatin enthält Doppelstranggene, aber auch andere Antigene, auf die das Immunsystem reagieren kann, wie zum Beispiel citrullinierte Histone, das antimikrobielle Peptid LL37, Myeloperoxidase (MPO) und neutrophile Elastase (NE). Liegt bei immunkompetenten Personen ein Infekt vor, werden zahlreiche NETs gebildet, aber auch schnell wieder abgebaut. Bei Lupuspatient:innen liegt häufig ein gestörter NET-Abbau vor, zum Beispiel aufgrund von intrinsischen DNase-I-Inhibitoren oder einer Stabilisierung der NETs durch Autoantikörper oder Komplexbildung mit LL37, führte Erpenbeck aus. Interessant für die Klinik sei, dass der Abbaudefekt der NETs mit dem Grad der Lupusnephritis korreliert, so die Expertin.
Freisetzung proinflammatorischer Substanzen
Ein zweiter Mechanismus, der zum Beispiel bei der Psoriasis eine wichtige Rolle spielt, ist die Freisetzung proinflammatorischer Substanzen. Neutrophile seien wie kleine Kraftwerke, die sehr viele Zytokine, Interferone, reaktive Sauerstoffspezies und potenziell gewebsschädigende Enzyme wie Myeloperoxidase und neutrophile Elastase enthalten, rief Erpenbeck in Erinnerung. Lange Zeit sei nicht klar gewesen, ob die histologisch zum Beispiel in inflammatorischen Infiltraten in der Dermis nachweisbaren Neutrophilen und NETs nur ein Bystander-Effekt sind oder auch zur Pathogenese der Psoriasis beitragen. Eine Studie konnte zeigen, dass Neutrophile bei der NET-Bildung RNA-LL37 und DNA-LL37-Komplexe freisetzen.4 Vor allem RNA, die in NETs und psoriatischer, aber nicht in gesunder Haut reichlich vorhanden ist, löste im Komplex mit dem antimikrobiellen Peptid LL37 eine TLR8/TLR13-vermittelte Zytokin- und NET-Freisetzung aus. Dies resultiert laut den Autoren in einem positiven Feedback-Loop, der dazu führt, dass sich die Entzündung selbst unterhält.
Zusätzlich können Neutrophile unter anderem bei der NET-Bildung Interleukin(IL)-17, IL-8, IL-6, TNF-α und IL-1β freisetzen.4 In einem murinen Modell der Psoriasis untersuchte die Forschungsgruppe um Erpenbeck, ob man NETs hemmen und daraus einen therapeutischen Nutzen ziehen kann.5 Dafür wurde den Mäusen IL-23 allein oder in Kombination mit DNase I, was den Abbau von NETs unterstützt, intradermal gespritzt. Es zeigte sich, dass unter der Kombination die Mäuse keine Entzündung in den Ohren entwickelten. Lag bereits eine Entzündung vor, hatte die Gabe von DNase I einen therapeutischen Nutzen. Somit erscheinen Neutrophile und NETs als attraktive therapeutische Ziele. «Durch die uns für die Psoriasis zur Verfügung stehenden Therapien erreichen wir Neutrophile bereits gut, wenn auch nicht besonders spezifisch», führte die Dermatologin aus. So zeigte eine 2018 publizierte Arbeit, dass Fumarate die Funktion von Neutrophilen sowie NETs modulieren und herunterregulieren.6 Im Zusammenhang mit der Freisetzung proinflammatorischer Zytokine durch Neutrophile verwies Erpenbeck auch auf eine Studie zur Defizienz des IL-36-Rezeptor-Antagonisten, des sogenannten DITRA-Syndroms. Auch hier zeigte sich in einem Mausmodell, dass eine NET-Inhibition die Symptome mildert und proinflammatorische Zytokine in der Haut signifikant reduziert.7
Crosstalk zwischen Immunzellen
Beim dritten Neutrophilen-Mechanismus findet ein Crosstalk mit weiteren Zellen des Immunsystems statt. Kommen in der Haut vermehrt proinflammatorische Zytokine vor, findet eine stärkere Entzündungsreaktion statt. Das zeigt sich auch im Mausmodell mit Kontaktallergie:8 Werden die Neutrophilen depletiert, dann verläuft die Effektorphase, in der sich das Kontaktekzem entwickelt, wesentlich schwächer. Interessanterweise sind die Neutrophilen auch in der Sensibilisierungsphase wichtig: Mastzellen setzen gerichtet TNF-βfrei, was Neutrophile dazu veranlasst, in die Dermis einzuwandern. Das dort von den Neutrophilen gebildete IL-1 sowie weitere proinflammatorische Zytokine sorgen dafür, dass die dendritischen Zellen in dieser Sensibilisierungsphase der Kontaktallergie in die Lymphknoten wandern und dort eine Allergie auslösen oder weiter vorantreiben. Eine Depletion der Neutrophilen war auch in der Sensibilisierungsphase effektiv.9
Präsentation von Antigenen
Auch bei IgE-vermittelten Allergien vom Soforttyp spielen Neutrophile eine Rolle. Zwar gehören sie zum angeborenen Immunsystem, sie können aber auch als Antigen-präsentierende Zelle fungieren, wie Erpenbeck den vierten Mechanismus erläuterte. Neutrophile können Antigene aufnehmen, prozessieren, präsentieren (HLA-DR) und allergenspezifische T-Zellen aktivieren. In der Spätphase der allergischen Soforttypreaktion können Eosinophile, T-Zellen und auch Neutrophile in der Haut akkumulieren und so zu einer Amplifikation von allergenspezifischer, zellvermittelter Entzündung beitragen.10
Also weg mit den Neutrophilen?
In den vier vorgestellten Mechanismen waren sie doch nur schädlich. Ganz so einfach ist es nicht, erklärte Erpenbeck. Neutrophile sind wichtig für die Immunabwehr, v.a. hinsichtlich Pilz- und bakterieller Infektionen. Zudem handele es sich um eine sehr heterogene Zellpopulation mit sowohl pro- als auch antiinflammatorischer Wirkung, und das abhängig vom Zeitverlauf. Es sei inzwischen bekannt, dass Neutrophile nicht nur Zytokine freisetzen, sondern auch degradieren können. Sie sind also für die Eindämmung und Auflösung von Inflammation sowie den Abbau von Zytokinen essenziell.11
Quelle:
52. DDG-Tagung am 27. April 2023 in Berlin
Literatur:
1 Erpenbeck L et al.: Neutrophil extracellular traps: protagonists of cancer progression? Oncogene 2017;36(18): 2483-90 2 Sollberger G et al.: Neutrophil extracellular traps: the biology of chromatin externalization. Dev Cell 2018; 44(5):542-53 3 Mistry P et al.: Transcriptomic, epigenetic, and functional analyses implicate neutrophil diversity in the pathogenesis of systemic lupus erythematosus. Proc Natl Acad Sci U S A 2019; 116(50):25222-8 4 Herster F et al.: Neutrophil extracellular trap-associated RNA and LL37 enable self-amplifying inflammation in psoriasis. Nat Commun 2020; 11(1):105 5 Hollstein MM et al.: Targeting neutrophil extracellular traps (NETs) ameliorates inflammation in murine psoriasiform dermatitis. J Dermatol Sci 2023; 109(3):143-6 6 Hoffmann JHO et al.: Dimethyl fumarate modulates neutrophil extracellular trap formation in a glutathione- and superoxide-dependent manner. Br J Dermatol 2018; 178(1):207-14 7 Watanabe S et al.: Neutrophil extracellular traps are induced in a psoriasis model of interleukin-36 receptor antagonist-deficient mice. Sci Rep 2020; 10(1):20149 8 Weber FC et al.: Neutrophils are required for both the sensitization and elicitation phase of contact hypersensitivity. J Exp Med 2015;212(1):15-22 9 Dudeck J et al.: Directional mast cell degranulation of tumor necrosis factor into blood vessels primes neutrophil extravasation. Immunity 2021;54(3):468-83.e5 10 Polak D et al.: Neutrophils promote T-cell-mediated inflammation in allergy. J Allergy Clin Immunol 2019; 143(5):1923-5.e3 11 Hahn J et al.: Aggregated neutrophil extracellular traps resolve inflammation by proteolysis of cytokines and chemokines and protection from antiproteases. FASEB J 2019; 33(1):1401-14
Das könnte Sie auch interessieren:
Laserbehandlung von Basalzellkarzinomen
Die chirurgische Exzision ist nach wie vor Goldstandard bei der Behandlung des Basalzellkarzinoms (BCC). Bei Tumoren mit niedrigem Rezidivrisiko kann auch eine nichtinvasive ...
Praxiserfahrungsbericht mit Mikrowellentherapie
Vor nicht ganz zwei Jahren, in der Ausgabe 6/2023, berichteten wir erstmals über unsere Erfahrungen mit der Swift®-Mikrowellentherapie bei lange bestehenden und therapieresistenten ...
Die menschliche Haut in der modernen Kunst
Dr. Ralph Ubl, Professor für neuere Kunstgeschichte an der Universität Basel, stellte sich der schwierigen Herausforderung, einem Raum voller erwartungsvoller Dermatologen das Organ Haut ...