Inhalative Kortikosteroide bei Asthma – was macht einen Unterschied?
Autoren:
Dr. Abhinav Singla
Prof. Dr. Jens Schreiber
Universitätsklinik für Pneumologie
Universitätsklinikum der Otto-von-Guericke-Universität
Magdeburg
E-Mail: abhinav.singla@med.ovgu.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Pathophysiologie des Asthmas ist sehr komplex und die Therapie hat sich in den letzten Jahrzehnten grundlegend gewandelt – von verschiedenen inhalativen Kortikosteroiden (ICS) über unterschiedliche Inhalatoren bis zu „single inhaler maintenance and reliever therapy“ (SMART) und „anti-inflammatory reliever therapy“ (AIR). In diesem Artikel diskutieren wir den Stellenwert der ICS und einen Paradigmenwechsel in der Therapie.
Keypoints
-
ICS sind eine Grundlage der Asthmatherapie.
-
Neben festen Applikationsschemata wurden variable Therapiekonzepte entwickelt, die sich an der Variabilität des Krankheitsverlaufs orientieren.
-
Der (S)MART-Ansatz, bestehend aus einer ICS/Formoterol-Kombination für die Behandlung der Stufen 3 bis 5, hat sich für geeignete Patienten als überlegen erwiesen.
-
Die rein bedarfsorientierte Applikation von ICS/Formoterol-Fixkombinationen bietet auch bei leichtem Asthma in den Therapiestufen 1 und 2 als AIR-Therapie relevante Vorteile.
-
Es gibt keine Indikation für eine SABA-Monotherapie mehr.
Asthma ist eine heterogene, multifaktorielle, chronisch-entzündliche Erkrankung der Atemwege, die meist durch eine bronchiale Hyperreagibilität und/oder eine variable Atemwegsobstruktion charakterisiert ist und sich klinisch durch respiratorische Symptome (Luftnot, Brustenge, Giemen, Husten) wechselnder Intensität und Häufigkeit äußern kann.1
Entwicklung der Therapie des Asthmas
Systemische Kortikosteroide wurden um das Jahr 1950 aufgrund ihrer Effektivität für die Behandlung des Asthmas entdeckt. Etwa zur gleichen Zeit wurden auch inhalative Beta-2-Agonisten zur symptomatischenLinderung der Erkrankung eingeführt. Wegen der mit systemischen Kortikosteroiden verbundenen Nebenwirkungen wurde die Asthmatherapie jedoch zunächst überwiegend mit Beta-2-Sympathomimetika durchgeführt. Allerdings stellte sich bald heraus, dass inhalative Beta-2-Agonisten-Therapie bei alleiniger Anwendung mit einer erhöhten Mortalität verbunden war. In dieser Zeit wurden auch systemisch wirkende Sympathomimetika wie orales Ephedrin, intravenöses Adrenalin oder auch inhalatives Adrenalin, Anticholinergika wie inhalatives Scopolamin und Methylxanthine wie Koffein oder Theophyllin angewandt, um akute und lebensbedrohliche Atemwegsobstruktionen zu behandeln.
Diese Therapien zielten noch nicht auf die damals noch weitgehend unbekannten Pathomechanismen des Asthmas ab und hatten keinen langfristigen therapeutischen Nutzen. Um 1970 wurde das erste inhalative Kortikosteroid (ICS) Beclomethason entwickelt, das zunächst allein und später in Kombination mit inhalativen Beta-2-Agonisten zur Behandlung von Asthma eingesetzt wurde.2
Zu dieser Zeit stand die Bronchokonstriktion im Zentrum der pathophysiologischen Konzepte, die Relevanz der chronischen Inflammation wurde erst in den Folgejahren zunehmend besser verstanden. Deshalb waren die frühen Therapien auf die Linderung von Symptomen ausgerichtet und es gab noch kein Konzept für eine antiinflammatorische Langzeittherapie der Erkrankung.
Mit dem Fortschreiten des Verständnisses von Asthma wurden die Therapien weiterentwickelt und die Medikamente in Controller und Reliever eingeteilt, entsprechend zur Krankheitskontrolle und symptomatischen Therapie. Zu den Controllern zaählen vor allem die ICS, die die Asthmatherapie revolutioniert haben und auch heute unverändert die Grundlage der antiinflammatorischen Asthmatherapie darstellen. Sie werden entweder allein oder vorzugsweise in Kombination mit lang wirksamen Beta-2-Agonisten (LABA) eingesetzt. Zu den Controllern gehören auch die Leukotrienrezeptor-Antagonisten (LTRA), die allerdings bei der großen Mehrzahl der Patienten eine im Vergleich zu den ICS geringere Wirksamkeit aufweisen. Sie spielen deshalb und aufgrund von möglichen relevanten Nebenwirkungen eine untergeordnete Rolle in der modernen Asthmatherapie.1
Mit zunehmend besserem Verständnis der entzündlichen Pathomechanismen des Asthmas wurden in den beiden letzten Dekaden subkutan oder intravenös applizierbare monoklonale Antikörper für Patienten mit schwerem und trotz ausgeschöpfter inhalativer Therapie unkontrolliertem Asthma entwickelt. Diese Biologika zielen auf spezifische Entzündungswege ab und werden bei Patienten eingesetzt, bei denen die Standardtherapie nicht ausreicht. Die aktuellen Leitlinien fordern den Einsatz von Biologika vor einer systemischen Applikation von Glukokortikosteroiden. Letztere dürfen in der Dauertherapie nur bei Unwirksamkeit von Biologika eingesetzt werden.
Mit der Entwicklung der Biologika ist fürviele Patienten mit einem schweren Asthmaeine komplette Krankheitsremission zu einem realistischen Therapieziel geworden. Gerade die Biologika können auch sehr effektiv auf häufige mit dem Asthma assoziierte Komorbiditäten, wie chronische Rhinosinusitis mit Nasenpolypen, chronische Urtikaria und atopische Dermatitis, wirken. Weiterhin besteht bei Patienten mit einer relevanten IgE-vermittelten Allergie mit der Allergen-Immuntherapie (AIT), die entweder sublingual oder subkutan appliziert wird, eine unterstützende Option zur Reduktion dieses Pathomechanismus und zur Verbesserung der Krankheitskontrolle.2
Ziele der Asthmaremission sind die dauerhafte Abwesenheit von Asthmasymptomen, die dauerhafte Vermeidung von Asthmaexazerbationen, stabile Lungenfunktionstests und kein Bedarf an systemischen Kortikosteroiden zur Behandlung von Asthma.2Damit eröffnen sich Möglichkeiten einer individuell zugeschnittenen Behandlung des Asthmas. Grundlage bleibt jedoch bei nahezu allen Patienten über alle Schweregrade und Therapiestufen hinweg die inhalative Applikation von ICS in unterschiedlicher Dosierung. Angesichts des breiten Spektrums an ICS-Molekülen, unterschiedlichen Dosierungen, unterschiedlichen Kombinationspartnern, unterschiedlichen Anwendungskonzepten (Erhaltungstherapie und/oder Bedarfstherapie) sowie unterschiedlichen Devices gibt es eine Vielzahl von Variablen, deren klinische Bedeutung oft unklar ist. In dieser Übersicht soll deshalb versucht werden, klinische relevante Aspekte in der Anwendung von ICS und ihrer Kombinationspartner darzustellen.
ICS und Beta-2-Sympathomimetika
Schon Anfang der 2000er-Jahre wurde gezeigt, dass ICS bereits in niedriger Dosierung die Mortalität beim Asthma erheblich senken.3 Im Gegensatz dazu haben Studien ergeben, dass eine Monotherapie und/oder ein Abusus von kurzwirksamen Beta-2-Agonisten (SABA) mit einem erhöhten Risiko für Exazerbationen und einer erhöhten Mortalität verbunden waren.4,5 Später wurde das auch bei langwirksamen Beta-2-Agonisten (LABA) in der Monotherapie beobachtet.6
Nachdem die erste LABA/ICS-Kombination bereits Mitte der 1980er-Jahre auf den Markt gekommen war, folgten in den 1990er-Jahren und danach Untersuchungen, in denen die Wirksamkeit und Sicherheit einer ICS/LABA-Kombinationstherapie mit der eigenständigen ICS- oder LABA-Therapie verglichen wurde. So konnte in einer Schlüsselstudie, der FACET-Studie, gezeigt werden, dass eine Kombination von niedrig dosiertem Budesonid mit Formoterol (LABA/ICS) einer höheren ICS-Dosis hinsichtlich der Lungenfunktion überlegen ist, eine höhere ICS-Dosierung jedoch Vorteile in der Prävention von Exazerbationen zeigt.7
Später ergab die GOAL-Studie an über 3400 Patienten mit leichtem bis mittelschwerem Asthma aber auch, dass trotz Kombinationstherapie mit LABA und ICS in hoher Dosierung ein relevanter Anteil der Patienten in einem einjährigen Beobachtungszeitraum keine vollständige Krankheitskontrolle erreicht hatte.8 Es bestand somit die klinische Notwendigkeit für zusätzliche Therapieoptionen und/oder Therapiekonzepte. Dies führte unter anderem zur Entwicklung des Konzepts der „single inhaler maintenance and reliever therapy“,(S)MART, für die Behandlung von Asthma. Dieses Therapiekonzept wird auch kurz als MART („maintenance and reliever therapy“) bezeichnet, da das „S“ in SMART ursprünglich für den Handelsnamen der Formoterol/Budesonid-Fixkombination stand, mit der die ersten großen Studien durchgeführt wurden. Nachdem die Ergebnisse in weiteren Studien mit anderen ICS bestätigt worden waren, stand das „S“ nunmehr für „single inhaler“. Im klinischen Alltag werden SMART und MART synonym verwendet.
Die „single inhaler maintenance and reliever therapy“ ([S]MART)
Bei diesem Therapiekonzept erfolgt eine Dauertherapie („maintenance“) mit Applikation einer ICS/Formoterol-Kombination in einem Device2x täglich. Von den LABA kommt dafür nur Formoterol infrage, da es sowohl eine lange Wirkdauer als auch einen schnellen Wirkeintritt hat – ein sogenannter schnell und langwirkenderBeta-2-Agonist. Bei Bedarf, also symptomorientiert, inhalieren die Patienten die gleiche ICS/LABA-Kombination zusätzlich als Reliever. Dieses Therapiekonzept basiert auf der Tatsache, dass die bronchiale Inflammation bereits einige Tage vor einer klinischen Verschlechterung zunimmt und eine frühzeitige Erhöhung der antiinflammatorischen ICS-Therapie diese Verschlechterung verhindern oder zumindest abmildern kann.
Eine (S)MART-Therapie ermöglicht es somit, vor dem Hintergrund einer antiinflammatorischen Basisbehandlung die Intensität der entzündungshemmenden ICS-Therapie dem Krankheitsverlauf anzupassen. In mehreren großen Studien wurde die Überlegenheit einer (S)MART-Therapie gegenüber konventionellen Applikationsschemata nachgewiesen. Es konnte eine relevante Reduktion sowohl der Gesamtzahl von Exazerbationen als auch der Anzahl von schweren Exazerbationen gezeigt werden.9
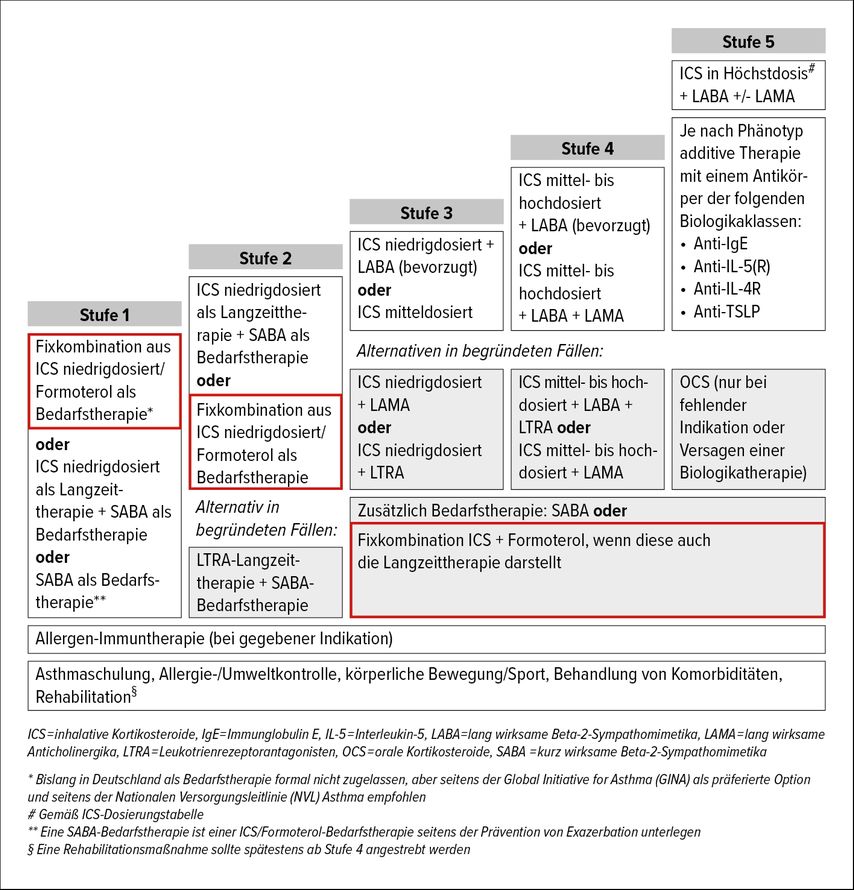
Die (S)MART-Therapie wurde ursprünglich für Patienten mit mittelschwerem bis schwerem Asthma in den Behandlungsstufen III bis V entwickelt und wird in den aktuellen nationalen und internationalen Leitlinien auch in diesen Therapiestufen empfohlen. Es gibt eine überwältigende Evidenz zum Nutzen dieser Therapie in diesen Therapiestufen.
Die „anti-inflammatory reliever therapy“ (AIR)
Zur inhalativen Therapie von Patienten mit leichtem Asthma (Stufe 1) wurde über viele Jahre eine rein symptomorientierte inhalative Applikation eines SABA empfohlen. Allerdings ist bekannt, dass eine Beta-2-Sympathomimetika-Monotherapie die Krankheitskontrolle verschlechtern und die Exazerbationsrate und Mortalität erhöhen kann.4 Auch bei leichtem Asthma können schwere Exazerbationen auftreten.
Somit erschien es plausibel, in Analogie zum (S)MART-Konzept bei Patienten mit einem leichten Asthma eine rein bedarfsorientierte inhalative Therapie mit einer ICS/Formoterol-Kombination zu prüfen. Dieses Therapiekonzept wird als AIR(„anti-inflammatory reliever“)-Therapie bezeichnet. Auch hier ist es auf gund seiner schnellen und langen Wirksamkeit erforderlich, dass Formoterol als LABA verwendet wird. Eine SABA/ICS-Kombination (Salbutamol/Beclomethason) in einem Inhalator wurde in einer Studie untersucht,10 diese Kombination ist in der EU jedoch noch nicht zugelassen.
In mehreren großen Studien wurde gezeigt, dass die AIR-Therapie in allen relevanten Endpunkten sowohl einer bedarfsorientierten SABA-Monotherapie in der Stufe I als auch in der Stufe II der bisher üblichen ICS-Dauertherapiemit SABA bei Bedarf überlegen ist. Die ersten Studien, die das gezeigt haben, waren die SYGMA-Studien.11 Deshalb wird die AIR-Therapie in den nationalen und internationalen Leitlinien für Patienten in den Behandlungsstufen 1 und 2 empfohlen.1,12 Trotz der hohen Evidenz für eine AIR-Therapie bei leichtem Asthma und der klaren Leitlinienempfehlungen wurden die dafür zur Verfügung stehenden Kombinationspräparate in der EU für diese Therapie bisher nicht zugelassen, was für die verordnenden Ärzte ein Dilemma darstellt.
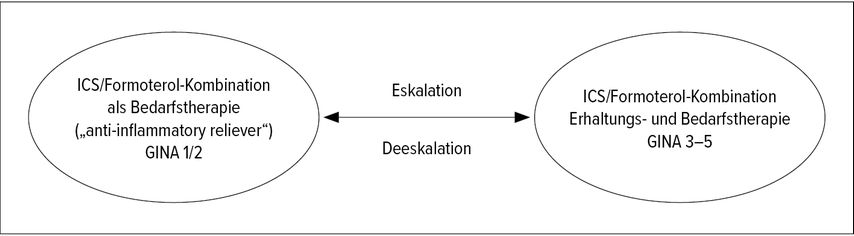
Der Stellenwert der beiden variablen, am Krankheitsverlauf und an der Intensität der bronchialen Inflammation orientierten ICS/Formoterol-Therapiekonzepte (AIR und [S]MART) im aktuellen Stufenschema der Asthmatherapie für Erwachsene ist in Abbildung 1 dargestellt. Je nach Schweregrad und Verlauf der Erkrankung kann ein Wechsel zwischen den beiden Therapiemodalitäten im Sinne einer Eskalation bzw. Deeskalation sinnvoll sein (Abb. 2).
Abb. 2: Eskalation (AIR→[S]MART) und Deeskalation ([S]MART→AIR) der Kombination aus ICS/Formoterol in Abhängigkeit vom Krankheitsverlauf (modifiziert nach Lipworth B et al. 2020)17
Obwohl die Kombinationstherapie aus ICS/LABA inzwischen als Standard etabliert ist, stellen sich weitere Fragen:
Ist (S)MART für jeden Asthmapatienten geeignet?
Nach adäquater Aufklärung wird es möglich sein, die Mehrzahl der Patienten damit adäquat zu behandeln. Es bleibt aber eine individuelle Entscheidung, die mit den Patienten im Sinne eines „shared decision making“ entsprechend besprochen werden muss. Wenn Patienten mit einer anderen leitliniengerechten Therapie eine gute Krankheitskontrolle erreicht haben, dann gibt es keinen Grund, diese zu verändern. Andere Patienten bevorzugen ein starres Therapieschema, und viele Patienten haben zudem das Bedürfnis, neben ihrer inhalativen Dauertherapie als weitere Option für „Notfälle“ ein weiteres Medikament, meist ein SABA, zur Verfügung zu haben, was ein zusätzliches Gefühl der Sicherheit vermittelt.
Ist jede ICS/LABA-Kombinationen für (S)MART geeignet?
Wie bereits dargestellt, erfordert diese Therapie ein LABA mit einem schnellen Wirkeintritt und einer langen Wirksamkeit. Das ist bei Formoterol der Fall. Deshalb findet sich im Stufenschema auch ausschließlich Formoterol als LABA für die bedarfsorientierte Applikation mit einem ICS (Abb.1). Hinsichtlich des ICS-Kombi-nationspartners wurde in fast allen (S)MART-Studien Budesonid verwendet. Eine Studie verwendete Beclometason mit ähnlicher Effektivität.
Kann (S)MART mit ICS/Formoterol als Bedarfstherapie und einem alternativen ICS/LABA als Erhaltungstherapie verordnet werden?
Bei Patienten, die eine Erhaltungstherapie mit anderen ICS/LABA-Kombinationen als ICS/Formoterol erhalten, wird die Verwendung von ICS/Formoterol als Bedarfstherapie nicht empfohlen, da es für die Effektivität und Sicherheit einer derartigen Mischung keine Evidenz gibt und eine Verwechslungsgefahr durch die Patienten nicht auszuschließen ist.
Kann die (S)MART-Therapie deeskaliert werden?
In der Asthmatherapie ist es erforderlich, beim Erreichen einer guten Krankheitskontrolle, meist nach einem halben Jahr, die Therapie entsprechend dem Stufenschema zu deeskalieren. Dies gilt in erster Linie für die ICS-Dosis. Es wurde gezeigt, dass dieses Vorgehen sicher ist, allerdings birgt jede Dosisreduktion das Risiko für einen Verlust der Asthmakontrolle. Dies gilt auch für das (S)MART-Konzept, das es ermöglicht, bei geeigneten Patienten mit leichtem Asthma die Therapie zu einem reinen AIR-Konzept zu deeskalieren. Bei Patienten mit einer hohen saisonalen Variabilität des Krankheitsverlaufs bieten die variablen Therapieschemata die Möglichkeit, die Therapieintensität dem Krankheitsverlauf anzupassen.
Ist eine (S)MART-Therapie für Patienten mit schwerem Asthma und einer Biologikatherapie geeignet?
Die relevanten Studien zur (S)MART-Therapie wurden vor der Zulassung der Biologika durchgeführt. Es gibt jedoch keinen plausiblen Grund, diesen Patienten die Vorteile dieser Therapie vorzuenthalten, und alle klinische Erfahrung spricht dafür, dass auch die Patienten unter einer Biologikatherapie davon profitieren. Entsprechend wird sie in den aktuellen Leitlinien auch empfohlen.
Sind AIR und (S)MART für Kinder und Jugendliche geeignet?
Entsprechend der Evidenz und den Zulassungen können Kinder und Jugendliche ab 12 Jahren ab Behandlungsstufe 3 nach GINA(Global Initiative for Asthma)-Klassifikation (oder ab Behandlungsstufe 4 nach der S2k-Leitlinie Asthma) bedarfsorientiert mit einer Fixkombination aus ICS+Formoterol behandelt werden, wenn diese auch die Langzeittherapie darstellt. Ebenfalls ab 12 Jahren ist in den Stufen 1 und 2 in der GINA-Klassifikation eine rein bedarfsorientierte Applikation einer Fixkombination aus niedrig dosiertem ICS +Formoterol leitliniengerecht möglich, wobei auch hier auf die fehlende Zulassung dieser Therapie in der EU hingewiesen werden soll.
Soll die ICS- bzw. (S)MART-Therapie nach der Einleitung einerBiologikatherapiedeeskaliert werden?
Eine Frage, die sich in der Klinik häufig stellt, ist, ob die ICS- bzw. (S)MART-Therapie nach der Einleitung von Biologika deeskaliert werden kann. Die meisten nationalen und internationalen Leitlinien empfehlen, dass Biologika erst dann angewendet werden sollten, wenn eine unzureichende Kontrolle des Asthmas unter der höchsten ICS-Dosis vorliegt. Die kürzlich veröffentlichte SHAMAL-Studie zeigt, dass die Dosis der ICS reduziert werden kann, ohne dass es zu Exazerbationen unter den Biologika kommt. Es gibt jedoch bisher keine Empfehlung für die Reduzierung der ICS-Therapie unter Biologika.13
Verschiedene ICS – sind sie alle gleich?
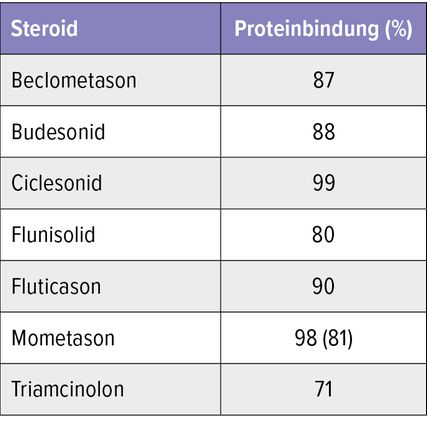
Tab. 1: Proteinbindung von inhalativen Kortikosteroiden (modifiziert nach Baptist AP, Reddy RC 2009)14
Die zur Verfügung stehenden, molekular unterschiedlichen ICS, wie Budesonid, Beclomethason, Ciclesonid, Flunisolid, Fluticason, Mometason und Triamcinolon, unterscheiden sich hinsichtlich der Pharmakokinetik, z.B. der Rezeptoraffinität und der Proteinbindung, und haben damit unterschiedliche Wirkstärken. So gibt es beispielsweise eine enge Korrelation zwischen der Rezeptoraffinität und der therapeutischen Effektivität. Tabelle 1 zeigt die Unterschiede in der Proteinbindung. Hinsichtlich der Pharmakodynamik, der intrazellulären Signalwege und letztlich der Mechanismen der antiinflammatorischen Wirksamkeit sind die ICS jedoch vergleichbar.
Dosisabhängigkeit der ICS – Wirkungen und Nebenwirkungen
Hinsichtlich der therapeutisch erwünschten positiven Effekte, wie Verbesserung der Asthmakontrolle, Verbesserung der Lungenfunktion, Reduktion der Zahl der Exazerbationen und Verringerung der bronchialen Hyperreaktivität, sind die Dosis-Wirkungs-Beziehungen nicht linear. Eine hohe Effektivität wird bereits bei recht niedrigen Dosierungen erreicht, der zusätzliche Nutzen nimmt bei weiterer Dosissteigerung immer langsamer zu und kann bei hohen Dosen ein Plateau erreichen. So hat eine Studie von Beasley et al. gezeigt, dass 80% des bei 1000μg/d erzielten Nutzens bereits bei einer Dosis von 70–180μg/d und 90% bei einer Dosis von 100–250μg/d erreicht wurden, sodass eine weitere Erhöhung keinen relevanten Vorteil mehr darstellte.15
Dem steht gegenüber, dass auch eine inhalative und damit lokale ICS-Therapie systemische Effekte hat und damit Nebenwirkungen verursachen kann. So wurde gezeigt, dass gemessen an der Inzidenz einer Nebenniereninsuffizienz eine tägliche Dosis von 1000μg ICS einer Dosis von 2–5mg oralem Prednison entspricht. Zu den Nebenwirkungen gehören u.a. die Entwicklung und Verschlimmerung eines Diabetes mellitus, die Entwicklungeines Katarakts, eine Begünstigung von Osteoporose und Frakturen sowie eine geringe Verminderung des Längenwachstum bei Kindern.16 Bei diesen unerwünschten systemischen ICS-Effekten sind die Dosis-Wirkungs-Beziehungen durch ein höheres Maß an Linearität gekennzeichnet als die lokalen bronchialen Wirkungen.
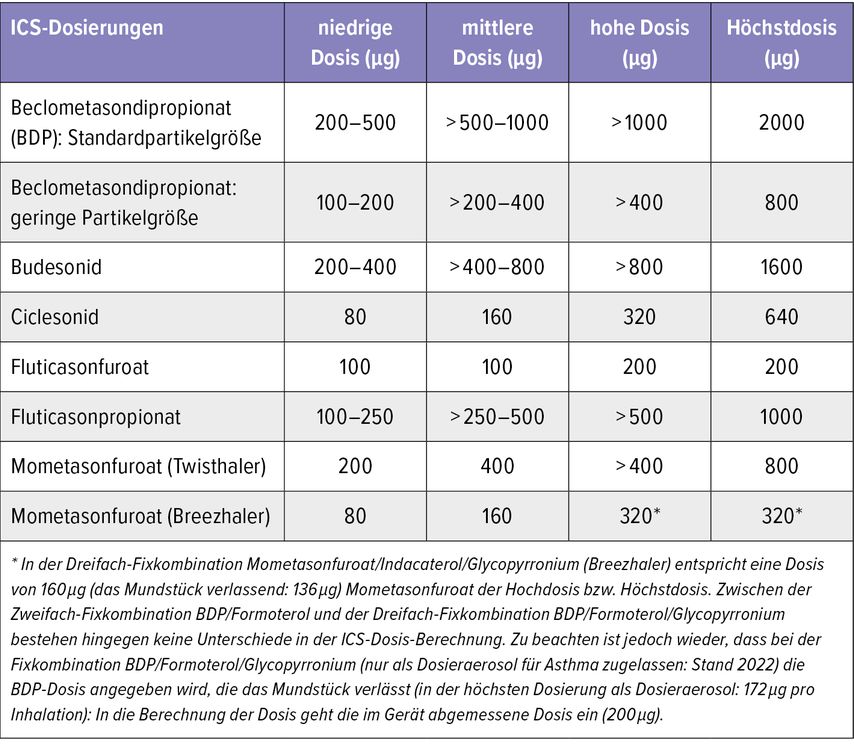
Daher ist es wichtig, die für den angestrebten therapeutischen Nutzen jeweils niedrigste ICS-Dosis zu finden und anzuwenden. Dabei hat es sich bewährt, die unterschiedlichen Präparate in niedrige, mittlere, hohe Dosis und Höchstdosis einzuteilen (Tab. 2). Die Unterschiede zwischen den Substanzen sind neben den bereits beschriebenen pharmakokinetischen Variablen auch durch physikalische Unterschiede wie die Teilchengröße bedingt. Relevant sind auch die Art der Verabreichung (z.B. Dosieraerosol oder Pulverinhalation) und die Korrektheit der Anwendung durch den Patienten.
Neben den unerwünschten systemischen Wirkungen können ICS auch lokale Nebenwirkungen verursachen – vor allem Heiserkeit durch eine reversible Myopathie der Stimmbänder und die oropharyngeale Candidiasis. Sind Dosisreduktion und Mundspülungen in dieser Situation nicht ausreichend effektiv, kann es sinnvoll sein, ein Medikament wie Ciclesonide zu wählen, das ein Prodrug ist und erst auf der Bronchialschleimhaut durch Esterasen aktiviert wird.
Methoden der inhalativen Applikation von ICS
Derzeit gibt es drei Methoden, um ICS bronchopulmonal topisch zu applizieren: Dosieraerosole („metered-dose inhaler“; MDI), Trockenpulverinhalatoren („dry powder inhaler; DPI) und Vernebler.
Bei den MDI sind die Medikamente entweder in einem verflüssigten, unter Druck stehenden Treibmittel gelöst oder suspendiert. Durch Auslösen des MDI wird eine definierte Menge des Treibmittels in ein Aerosol umgewandelt, das mit hoher Geschwindigkeit aus der Öffnung austritt. Bei den MDI muss der Patient die tiefe Inspiration gut mit der Auslösung des MDI koordinieren, was einem Teil der Patienten schwerfällt. Fehler bei der Anwendung können die applizierte ICS-Dosis erheblich beeinflussen. Bei MDI kann gerade bei Kindern oder älteren Menschen die Anwendung von Spacern Abhilfe schaffen und sowohl die effektiv inhalierte ICS-Dosis verbessern als auch v.a. lokale Nebenwirkungen minimieren.
Bei Trockenpulverinhalation (DPI) werden die Freisetzung und die Verteilung des Medikaments durch die Einatmung der Patienten getriggert, das Medikament wird durch die eingeatmete Luft mitgerissen, weshalb keine Synchronisation zwischen Einatmung und Deviceauslösung erforderlich ist. Trotzdem sind auch bei DPI Fehlanwendungen möglich, die die eingeatmete Medikamentenmenge ungünstig beeinflussen können.
Für die überwiegende Zahl der Asthmapatienten ist eine suffiziente Therapie mit MDI oder DPI möglich. Bei korrekter Anwendung ist die Effektivität ähnlich. Es sollte nach Möglichkeit aber vermieden werden, DPI und MDI zu kombinieren, da sie unterschiedliche Atemmanöver erfordern, was einem Teil der Patienten Schwierigkeiten bereiten kann.
Vernebler wandeln eine flüssige Lösung oder Suspension in ein Aerosol um, indem sie entweder einen Druckluftstrahl oder Ultraschallenergie verwenden. Die Aerosolfahne wird dann über ein Mundstück an den Patienten abgegeben. Gesichtsmasken sollten aufgrund der hohen nasalen und kutanen und vergleichsweise geringen bronchialen Deposition vermieden werden und haben allenfalls bei jüngeren Kindern einen Stellenwert. Vernebler stellen nur geringe Anforderungen an die Inhalationstechnik der Patienten. Sie werden daher in der Regel nur Patienten verschrieben, die weder ein MDI noch einen DPI verwenden können, z.B. geriatrischen Personen.
Literatur:
1 Lommatzsch M et al.: S2k-Leitlinie zur fachärztlichen Diagnostik und Therapie von Asthma 2023. Pneumologie 2023; 77(08):461-5432 Lommatzsch M et al.: Disease-modifying anti-asthmatic drugs. Lancet 2022; 399(10335): 1664-8 3 Suissa S et al.: Low-dose inhaled corticosteroids and the prevention of death from asthma. New Engl Med 2000; 343(5): 332-6 4 Nwaru BI et al.: Overuse of short-acting β(2)-agonists in asthma is associated with increased risk of exacerbation and mortality: a nationwide cohort study of the global SABINA programme. Eur Resp J 2020; 55(4): 1901872 5 Nelson HS et al.: The Salmeterol Multicenter Asthma Research Trial: a comparison of usual pharmacotherapy for asthma or usual pharmacotherapy plus salmeterol. Chest 2006; 129(1): 15-26 6 Weatherall M et al.: Meta-analysis of the risk of mortality with salmeterol and the effect of concomitant inhaled corticosteroid therapy. Thorax 2010; 65(1): 39-43 7 Pauwels Romain A et al.: Effect of inhaled formoterol and budesonide on exacerbations of asthma. New Engl J Med 1997; 337(20): 1405-11 8 Bateman ED et al.: Can guideline-defined asthma control be achieved? Am J Resp Crit Care Med2004; 170(8): 836-44 9 Rabe KF et al.: Effect of budesonide in combination with formoterol for reliever therapy in asthma exacerbations: a randomised controlled, double-blind study. Lancet 2006; 368(9537): 744-53 10 Papi A et al.: Rescue use of beclomethasone and albuterol in a single inhaler for mild asthma. New Engl J Medicine 2007; 356(20): 2040-52 11 O’Byrne PM et al.: Inhaled combined budesonide–formoterol as needed in mild asthma. New Engl J Med 2018; 378(20): 1865-76 12 Alberto P et al.: European Respiratory Society short guidelines for the use of as-needed ICS/formoterol in mild asthma. Eur Resp J 2023; 62(4): 2300047 13 Jackson DJ et al.: Reduction of daily maintenance inhaled corticosteroids in patients with severe eosinophilic asthma treated with benralizumab (SHAMAL): a randomised, multicentre, open-label, phase 4 study. Lancet 2024; 403(10423): 271-81 14 Baptist AP, Reddy RC: Inhaled corticosteroids for asthma: are they all the same? J Clin Pharm Ther 2009; 34(1): 1-12 15 Beasley R et al.: Inhaled corticosteroid therapy in adult asthma. Time for a new therapeutic dose terminology. Am J Respir Crit Care Med 2019; 199(12): 1471-7 16 Heffler E et al.: Inhaled corticosteroids safety and adverse effects in patients with asthma. J Allergy Clin Immunol Pract 2018; 6(3): 776-81 17 Lipworth B et al.: Anti-inflammatory reliever therapy for asthma. Ann Allergy Asthma Immunol 2020; 124(1): 13-5
Das könnte Sie auch interessieren:
Pathobiologie und Genetik der pulmonalen Hypertonie
Für die 7. Weltkonferenz für pulmonale Hypertonie (World Symposium on Pulmonary Hypertension; WSPH) 2024 beschäftigten sich zwei Task-Forces aus 17 internationalen Experten allein mit ...
COPD: State of the Art
Vom reaktiven zum proaktiven Management – Präventivmassnahmen werden in der Versorgung von COPD-Patient:innen immer wichtiger. Das unterstreichen auch die Aktualisierungen im GOLD-Report ...