Immunprofiling maligner Melanome mittels Bildanalyse & künstlicher Intelligenz
Autoren:
Prof. Dr. med. Viktor Kölzer
OÄ Dr. med. Dr. sc. nat. Anna Bettina Sobottka-Brillout
Institut für Pathologie und Molekularpathologie
Universitätsspital Zürich
E-Mail: viktor.koelzer@usz.ch
Tumorinfiltrierende CD8+ T-Zellen gewinnen zusehends als zusätzlicher Biomarker für das Ansprechen auf immunonkologische Therapien an Bedeutung. In der Routine-Diagnostik werden sie jedoch bislang noch nicht evaluiert. Das standardisierte Verfahren zur Erhebung tumorinfiltrierender CD8+ T-Zellen weist zudem noch einige Mängel auf. Ein von den Autoren etablierter diagnostischer Algorithmus könnte dem Abhilfe schaffen.
Keypoints
-
Digitale Pathologie zusammen mit KI-basierter Auswertung erlaubt eine robuste, quantitative und reproduzierbare Messung tumorinfiltrierender CD8+ T-Zellen, deren Vorhandensein das Ansprechen auf immunonkologische Behandlungen wesentlich beeinflusst.
-
Unser Algorithmus übersetzt die gemessenen Dichten tumorinfiltrierender CD8+ T- Zellen in den jeweiligen Tumorkompartimenten in die klinisch-relevante Immundiagnosen «hot» bzw. «inflamed» oder «cold» bzw. «immune excluded/desert».
-
Die Berücksichtigung und Messung des sogenannten intratumoralen Tumorzentrumkompartiments erlauben die Evaluation von klinisch relevanten Metastasenbiopsien, selbst wenn die Tumorinvasionsfront nicht erfasst wurde.
Hintergrund
Tumorinfiltrierende CD8+ T-Zellen werden zurzeit als ein wichtiger zusätzlicher prädiktiver Biomarker in der Immunonkologie diskutiert. Sie gehören nicht nur zu den immunologischen Schlüsselzellen in der Tumorzelleradikation, sondern stellen einen der Hauptangriffspunkte («targets») für die Therapie mit Immuncheckpoint-Inhibitoren (ICI) dar. Nichtsdestotrotz werden tumorinfiltrierende CD8+ T-Zellen nicht routinemässig untersucht, zudem fehlen bislang reproduzierbare, robuste und quantitative Auswertungsmethoden. Wir haben deshalb mittels digitaler Pathologie, Bildanalyse und dem Einsatz von künstlicher Intelligenz (KI) einen diagnostischen Algorithmus etabliert, der die räumliche Verteilung tumorinfiltrierender CD8+ T-Zellen in den etablierten Tumorkompartimenten quantitativ analysiert und in die klinisch relevanten Immundiagnosen übersetzt.
Relevanz tumorinfiltrierender CD8+ T-Zellen
Die Therapie mit ICI hat das Überleben bei vielen Tumorentitäten signifikant verlängert, speziell beim malignen Melanom.1–4 Zu den etablierten prädiktiven immunonkologischen Biomarkern gehören derzeit eine hohe Tumormutationslast («tumor mutational burden»), Mikrosatelliteninstabilität (MSI) und die Expression von «programmed cell death 1 ligand 1» (PD-L1). Nichtsdestotrotz profitieren nicht alle Patienten mit vermeintlich positiver Prädiktion auf ICI. Ein Grund dafür scheint in der Zusammensetzung des Tumorimmuninfiltrates zu liegen. Verschiedene Studien haben gezeigt, dass Tumoren mit einer hohen Dichte tumorinfiltrierender CD8+ T-Zellen besser auf Immuntherapie ansprechen als Tumoren mit niedriger Infiltrationsdichte. Darauf basierend können Tumoren in folgende klinischrelevante Kategorien klassifiziert werden: entzündet («inflamed») entsprechend klinisch «heiss» («hot») mit gutem Ansprechen auf ICI, im Gegensatz zu «immun ausgeschlossenen» («immune excluded») und «immun verlassenen» («immune desert») bzw. klinisch «kalten» («cold») Tumoren.5 Aus immunologischer Sicht ist dieses Konzept gut nachvollziehbar. CD8+ T-Zellen sind essenziell für die T-Zell-mediierte Zytotoxizität unter Voraussetzung eines direkten Kontakts der zytotoxischen CD8+ T-Zelle mit der Tumorzelle. Im immunsuppressiven Tumormikromilieu kommt es jedoch gehäuft zu einer Erschöpfung («exhaustion») der T-Zell-Effektorpopulation. Diese dysfunktionalen CD8+ T-Zellen mit Expression von Immuncheckpoints können jedoch pharmakologisch reaktiviert werden und stellen deshalb einen der Hauptangriffspunkte für die Therapie mit ICI dar.
Trotz dieser Erkenntnisse werden tumorinfiltrierende CD8+ T-Zellen bislang nicht in der Routine-Diagnostik evaluiert. Die International Immune Oncology Biomarker Working Group stellt die derzeitige Referenz für die standardisierte Auswertung tumorinfiltrierender Lymphozyten (TILs).6–8 Dazu werden TILs lichtmikroskopisch in den zwei definierten Tumorkompartimenten in Standardfärbungen (Hematoxylin und Eosin, H&E) ausgewertet, und zwar im Tumorzentrum («tumor center») und an der Invasionsfront («invasive margin»). Diese Empfehlungen sind für die standardisierte und vergleichbare TIL-Auswertung essenziell, vernachlässigen jedoch aufgrund der H&E-basierten Herangehensweise sowohl die gezielte Analyse CD8+ tumorinfiltrierender Zellen als auch die weitere Unterteilung des Tumorzentrums in das neoplastische und stromale Kompartiment mit hoher Detailauflösung.
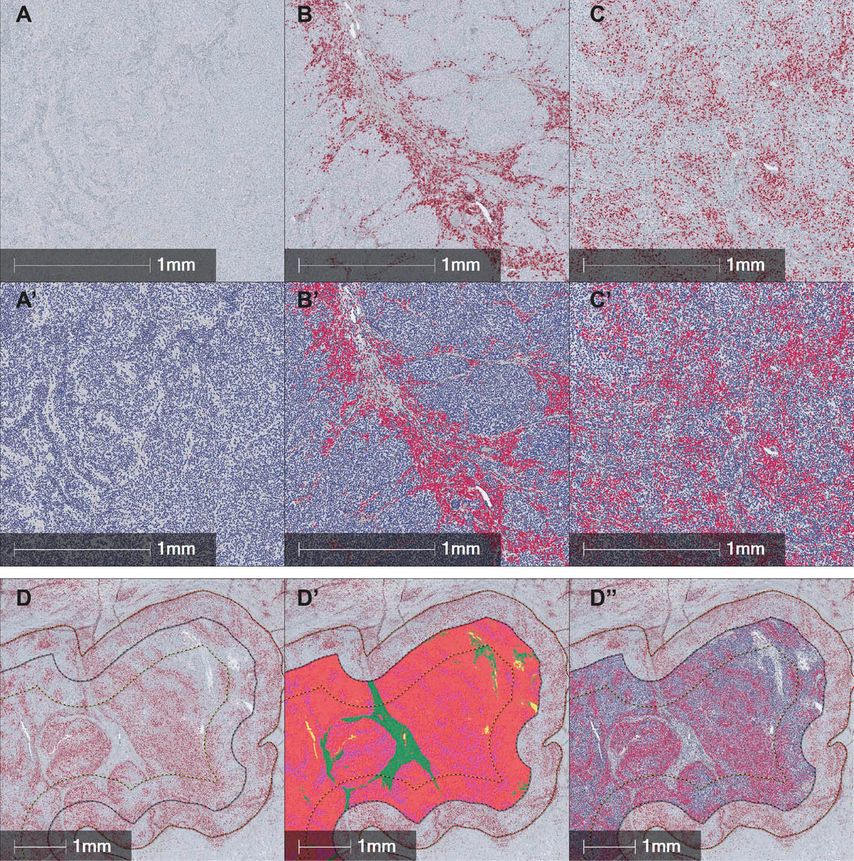
Digitale Pathologie zur Etablierung einer Immundiagnose
Wir haben deshalb einen diagnostischen Algorithmus etabliert, der basierend auf digitaler Pathologie und Bildanalyse die Dichte immunhistochemisch gefärbter tumorinfiltrierender CD8+ T-Zellen in den jeweiligen Tumorkompartimenten misst. Dazu haben wir zunächst die klinisch relevanten Immundiagnosen in Melanommetastasen der Tumor-Profiler-Kohorte9 durch zwei Pathologen als Grundwahrheit etabliert. Für die Entwicklung der digitalen Auswertung wurden die Schnittpräparate digitalisiert und die Tumorregionen annotiert. Mittels Verfahren des maschinellen Lernens wurde die Bildinformation in Tumoranteile und nichtneoplastische Komponenten aufgegliedert, die Gesamtfläche gemessen, und es wurden die Anzahl und räumliche Lokalisation jeder einzelnen CD8+ T-Zelle im Tumorareal definiert (Abb. 1). Die Robustheit der präanalytischen und analytischen Prozesse konnten wir in einer unabhängigen Validierungskohorte bestätigen. Die gemessene räumliche Infiltrationsdichte der CD8+ T-Zellen in jedem einzelnen Kompartiment wurde anschliessend in die klinisch relevanten Immundiagnosen «hot» (entzündet oder «inflamed») bzw. «cold» (immun ausgeschlossenen oder «immune excluded» bzw. immun verlassenen oder «immune desert») übersetzt. Basierend auf unserem vorgeschlagenen diagnostischen Algorithmus konnten wir die Immundiagnosen in der unabhängigen Validierungskohorte metastasierter Melanome mit hoher Sensitivität, Präzision und Spezifität etablieren. Wir haben zudem festgestellt, dass die Evaluation des intratumoralen Tumorzentrums, also das tumorzelluläre Tumorzentrumkompartiment ohne intervenierendes Stroma, für die Etablierung der Immundiagnose ausreicht. Dies ist speziell dann wichtig, wenn der invasive Tumorrand («invasive margin») nicht erfasst wurde, wie oft im Fall von Fernmetastasen, bei denen häufig nur Biopsiematerial zur Diagnosesicherung zur Verfügung steht.
Abb. 1: Visualisierung und digitale Quantifizierung von CD8+ zytotoxischen T-Zellen in Melanommetastasen. Abwesenheit von T-Zellen in immunverlassenen Tumoren («immune desert») (A und A’), Akkumulation von T-Zellen an der Invasionsfront oder im intratumoralen Stroma ohne wirksame Invasion in immunausgeschlossene Tumoren («immune excluded») (B und B’) und Infiltration von T-Zellen in das Tumorparenchym bei entzündeten Tumoren («inflamed») (C und C’). Digitale Annotation des Tumorzentrums in Melanommetastasen mit 1mm invasivem Rand gemäss den Empfehlungen der International Immune Oncology Biomarker Working Group (D). KI-basierte Segmentierung (D’) von Melanommetastasen in Tumor (rot), entzündetes Stroma (lila) und desmoplastisches Stroma (grün); Ausschluss von optischen Leeräumen (gelb) und wenn vorhanden, Melaninpigment (braun), Einblutungen und Nekrosen (orange). Zellsegmentierung und Bewertung bei Einzelzellauflösung (D’’) zur Bewertung der CD8 +-Infiltration pro mm2 in jedem Kompartiment und Gewebetyp
Zusammenfassung
Wir stellen eine quantitative, robuste und reproduzierbare Methode zur Messung tumorinfiltrierender CD8+ T-Zellen in Melanomen vor, basierend auf digitaler Pathologie und KI-gestützter Bildanalyse. Dazu berücksichtigen wir die räumliche Verteilung der CD8+-Infiltrationsdichte in den etablierten Tumorkompartimenten und übersetzen unsere Messungen in die klinisch relevanten Immundiagnosen. Die Hinzunahme des intratumoralen Tumorzentrumskompartiments ermöglicht darüber hinaus die Evaluation klinischrelevanter Biopsien aus Melanommetastasen, in denen die Invasionsfront nicht erfasst ist.
Literatur:
1 Wolchok JD et al.: N Engl J Med 2017; 377(14): 1345-56 2 Weber JS et al.: Lancet Oncol 2015; 16(4): 375-84 3 Larkin J et al.: N Engl J Med 2015; 373(1): 23-34 4 Robert C et al.: Lancet Oncol 2019; 20(9): 1239-51 5 Hegde PS et al.: Clin Cancer Res 2016; 22(8): 1865-74 6 Amgad M et al.: NPJ Breast Cancer 2020; 6:1 6 7 Denkert C et al.: Mod Pathol 2016; 29(10): 1155-64 8 Salgado R et al.: Ann Oncol 2015; 26(2): 259-71 9 Irmisch A et al.: Cancer Cell 2021; 39(3): 288-93
Das könnte Sie auch interessieren:
Kombinationstherapie mit plättchenreichem Plasma und Hyaluronsäure
Hochwertiges autologes plättchenreiches Plasma (PRP) verfügt von Natur aus über einen komplex zusammengesetzten Cocktail aus zahlreichen bioaktiven Substanzen. Gegenüber dem Vollblut ...
Chronische Wunde – Alltag im Ausnahmezustand?
Chronische Wunden sind nicht nur ein medizinisches, sondern auch ein „alltägliches“ Problem. Sie durchbrechen Routinen, verändern das Selbstbild und verlangen von den Betroffenen eine ...
Die menschliche Haut in der modernen Kunst
Dr. Ralph Ubl, Professor für neuere Kunstgeschichte an der Universität Basel, stellte sich der schwierigen Herausforderung, einem Raum voller erwartungsvoller Dermatologen das Organ Haut ...