Präexpositionsprophylaxe einer HIV-Infektion in Österreich
Autor:
Dr. David Chromy
Abteilung für Dermatologie
Medizinische Universität Wien
E-Mail: david.chromy@meduniwien.ac.at
Die Wirksamkeit der Präexpositionsprophylaxe (PrEP) des humanen Immundefizienzvirus (HIV) wurde erstmals vor zehn Jahren demonstriert. Als Dauerprophylaxe findet sie weltweit zunehmend Anwendung im Kampf gegen HIV-Infektionen. Spätestens seit der generischen Verfügbarkeit ist die PrEP auch in Österreich angekommen. Dies bleibt jedoch nicht ohne Folgen: Die Rate an ungeschütztem Geschlechtsverkehr ist im Steigen begriffen – und somit auch die Anzahl anderer sexuell übertragbarer Erkrankungen.
Keypoints
-
Eine PrEP schützt vor einer HIV-Infektion.
-
In Österreich ist die PrEP für MSM und Transgender sinnvoll, die ungeschützt und/oder unter Gebrauch stimulierender Substanzen Geschlechtsverkehr praktizieren oder in den letzten 12 Monaten eine Geschlechtskrankheit oder Bedarf an HIV-Postexpositionsprophylaxe hatten.
-
Erste Ergebnisse unsere Beobachtungsstudie zeigen, dass 29% zumindest eine sexuell übertragbare Erkrankung zum Einschlusszeitpunkt hatten. Damit folgt die hiesige Prävalenz dem internationalen Trend.
-
Während die PrEP eine effektive Schutzmaßnahme gegen eine HIV-Infektion darstellt, bedarf es einer konsequenten Überwachung sexuell übertragbarer Erkrankungen bei dieser Patientengruppe, um auch asymptomatische Geschlechtskrankheiten frühzeitig zu erkennen.
Am 30. Dezember 2010 veröffentlichten RM Grant et al. im „New England Journal of Medicine“ die Daten der iPrEx-Studie: Die Kombinationstherapie aus Emtricitabin (FTC) und TenofovirdisoproxilFumarat (TDF) einmal täglich verglichen mit Placebo hatte zu einer signifikanten Reduktion der Inzidenz von HIV-Infektionen unter Männern, die Sex mit Männern haben (MSM), und Transgender-Personen geführt.1 Die Idee einer Chemoprophylaxe zur Prävention einer HIV-Infektion kannte man bereits aus dem postexpositionellen Setting2 – eine Anwendung, die auch heute beispielsweise im Zusammenhang mitNadelstichverletzungen bekannt ist und praktiziert wird.
Mit der Zulassung der PrEP (2012 durch die Food and Drug Administration [FDA], 2016 durch die European Medicines Agency [EMA]) wurde jedoch ein völlig neuer Meilenstein in der Bekämpfung von HIV-Infektionen gesetzt, wovon insbesondere Hochrisikokollektive – in Ländern mit hohem Einkommen sind dies vorwiegend MSM – profitieren sollten. Konsequente Anwendung von Kondomen zum Schutz vor einer HIV-Infektion hatte sich unter MSM nicht flächendeckend durchsetzen können und das Phänomen „Serosorting“, wobei nur mit Partnern desselben serologischen Status verkehrt werden sollte, verursachte vermutlich mehr Schaden als Nutzen.3
Unter dem Handelsnamen Truvada® war die Fixkombination aus FTC/TDF bereits als Bestandteil einer antiretroviralen Therapie (ART) am Markt etabliert und nun wurde das Label um die Indikation PrEP erweitert. Damit wurde erstmalig die Möglichkeit geschaffen, dass sich Betroffene eigenständig und effektiv vor einer HIV-Infektion schützen können – schließlich musste man sich bis zu diesem Zeitpunkt beim Sex darauf verlassen, dass entweder das Kondom (vom Sexpartner) durchgehend korrekt angewandt wurde oder der HIV-Status quasi tagesaktuell bekannt negativ war. Andernfalls bestand beim Sex fortwährend das Risiko, sich mit HIV zu infizieren. Diese permanente Ungewissheit hatte in den 2000er-Jahren sogar den einen oder anderen dazu getrieben, sich wissentlich mit HIV zu infizieren, schlichtweg um die Last der permanenten Ungewissheit zu beseitigen.4 Auch die Gewissheit, dass unter HIV-Therapie eine Übertragung de facto ausgeschlossen ist, basierend auf den Daten der Studien PARTNER, PARTNER2 sowie HPTN 0525–7 und über Fachgesellschaften, die World Health Organization (WHO), Nicht-Regierungs-Organisationen“ (NGOs) und soziale Median unter dem Slogan „U=U“ („undetectable equals untransmittable“) weltweit publik gemacht, konnte sich erst im Laufe der letzten Jahre etablieren und baut naturgemäß auf einer niedrigen Dunkelziffer an HIV-Positiven sowie einer flächendeckenden Versorgung mit ART auf.
Herausforderungen der PrEP
Seit der Marktreife stand die PrEP allerdings auch vielfach in der Kritik. Insbesondere die hohen Kosten des unter Patentschutz stehenden Präparats verunmöglichte vielerorts die praktische Anwendung (Kosten von Truvada® in Österrreich: knapp 1000 € pro Monatspackung). Nach der Zulassung der PrEP dominierten daher – wenn überhaupt verfügbar – Importe aus Fernost8 und Plätze in klinischen Studien, welche PrEP zur Verfügung stellten, waren unter MSM heiß umkämpft. Erst als 2017 FTC/TDF außerhalb der USA generisch vermarktet werden durfte, konnte sich die PrEP in Europa weitläufig etablieren.8 Mittlerweile ist in vielen Ländern Europas (z.B. auch Deutschland) PrEP als Leistung der Sozialversicherung beziehbar; in Österreich ist sie als präventivmedizinische Maßnahme bis dato weiterhin eine Privatleistung und kann in ausgewählten Apotheken zu einem Monatspreis von 59 € auf Rezept bezogen werden.
Als weiterer Kritikpunkt an PrEP wurde insbesondere in öffentlichen Diskussionen immer wieder genannt, dass Risikogruppen wie MSM oder Transgender-Personen schlichtweg Kondome verwenden könnten, anstatt den eigenen Organismus über einen längeren Zeitraum gegenüber einer Chemoprophylaxe zu exponieren. Hier ist jedoch entgegenzuhalten, dass (i) die Daten der letzten 40 Jahre uns leider eine mangelnde Akzeptanz des Kondoms aufzeigen9 und (ii) PrEP die bis dato einzige etablierte Präventivmaßnahme gegen eine HIV-Infektion darstellt, bei der die Kontrolle gänzlich beim Anwender liegt.
In den vergangenen Jahren kam zunehmend eine weitere Problematik im Kontext der PrEP auf, bekannt unter dem Stichwort „risk compensation“.10 Unter „risk compensation“ versteht man ein gesteigertes Risikoverhalten auf Basis eines reduzierten Gesamtrisikos. In die Praxis übersetzt bedeutet dies: Unter der Prämisse der PrEP-Einnahme wird häufiger ungeschützter Geschlechtsverkehr praktiziert. Tatsächlich wird die PrEP leider von ihren Anwendern manchmal als Freibrief für ungeschützten Verkehr gesehen – eine Entwicklung fast schon konträr zur Idee des zusätzlichen und eigenmächtigen Schutzes.
Diese Dynamik spiegelt sich auch ganz deutlich in der Prävalenz sowie der Inzidenz von sexuell übertragbaren Infektionen (STI) wider. Als 2019 auf der International AIDS Society (IAS) Conference on HIV Science in Mexico City JJ Ong die Daten eines Reviews11 über die Häufigkeit von STI unter PrEP-Anwendern präsentierte, ging ein erstauntes Raunen durch den Saal. Das Resultat von 88 inkludierten Studien war bemerkenswert: Bereits zum Zeitpunkt der PrEP-Initiierung litten 10,8% der Anwender unter einer Infektion mit Chlamydia trachomatis, 11,6% unter Neisseria gonorrhoeae, 17,2% unter Mycoplasma genitalium und 5% unter Treponema pallidum.11 ImFall von Chlamydia trachomatis ist zudem die hohe Rate der Serovare L1–L3 und des damit einhergehenden Lymphogranuloma venereum (LGV) zu nennen. Eine französische Arbeit berichtete von LGV bei 18,7% aller Chlamydia-trachomatis-Infektionen unter PrEP-Anwendern12 und auch in Österreich wurde rezent ein Anteil von 47,6% LGV unter Chlamydia-trachomatis-infizierten MSM publiziert.13 All dem ist entgegenzuhalten, dass bei laufender PrEP-Einnahme ein STI-Screening alle 3 Monate durchzuführen bzw. dessen Durchführung empfohlen ist.Mehr Testungen führen unweigerlich auch zu mehr Diagnosestellungen – die deutliche Durchseuchung sei dennoch nicht von der Hand zu weisen.
JM Molina et al. zeigten 2018, dass eine Postexpositionsprophylaxe mit Doxycyclin nach ungeschütztem Geschlechtsverkehr bei „MSM on PrEP“ signifikant das Auftreten von Chlamydia trachomatis und Treponema pallidum reduziert (nicht jedoch von Neisseria gonorrhoeae).14 Einzug in die internationalen Guidelines und damit in die klinische Praxis hat diese Maßnahme aufgrund des ohnehin sehr hohen Antibiotikaaufwandes in dieser Patientengruppe allerdings noch nicht gefunden. Prospektive Studien zu einer Dauerprophylaxe mit Doxycyclin ergänzend zur HIV-PrEP werden derzeit durchgeführt.15 Die aktuelle Empfehlung sieht ganz klar vor, regelmäßig zu testen und bei Diagnosestellung gegebenenfalls zu therapieren;16 also eine „Testandtreat“-Strategie, die sich Modellierungen zufolge ebenfalls als effektiv im Kampf gegen STI unter PrEP-Anwendern erweist.10 Das primäre Ziel der PrEP darf im Kontext der Begleiterscheinungen jedoch nicht aus den Augen gelassen werden: nämlich die Reduktion der HIV-Neuinfektionen. In Österreich entfallen über 50% der HIV-Neudiagnosen auf die Risikogruppe der MSM9 und jene Gruppe kann durch PrEP ganz klar vor HIV und somit vor all den weitreichenden Konsequenzen dieser Infektion geschützt werden.
Am Beispiel der Infektion mit dem Hepatitis-C-Virus (HCV) lässt sich zudem folgendes Phänomen beobachten: Seit etwa 20 Jahren nimmt die Rate der HCV-Infektionen unter HIV-positiven MSM in Ländern mit hohem Einkommen konstant im Sinne einer Epidemie zu.17,18 HCV-Infektionen werden auch dem Spektrum der STI zugeordnet; HCV-Infizierte sind verhältnismäßig wenig kontagiös und in Relation gesehen treten Infektionen eher selten auf.11Meist bedarf es eines maximalen Risikoverhaltens (z.B. ungeschützter Analverkehr, Fisting, Sex unter stimulierenden Substanzen, intravenöser Drogengebrauch), damit es zur Übertragung kommt.19 Dass sich rezente Berichte über eine Zunahme der HCV-Infektionen unter HIV-negativen „MSM on PrEP“20 häufen, vermag im ersten Moment zu beunruhigen. Andererseits zeigt dies jedoch auf, dass Personen mit einem maximalen Risikoverhalten durch die Einnahme von PrEP im HIV-negativen Status gehalten werden können und zugleich durch die Screening-Untersuchungen bei ihnen rascher eine HCV-Infektion diagnostiziert werden kann.
Empfehlung der WHO
Die WHO empfiehlt eine PrEP für Personengruppen mit einer HIV-Inzidenz von mehr als 3 pro 100 Personenjahren und aktivem Risikoverhalten bzgl. der Ansteckung mit HIV.21 Dies trifft in Österreich und den allermeisten Ländern mit hohem Einkommen auf die Gruppe der MSM und Transgender zu. In der Anwendung wird zudem differenziert zwischen „daily PrEP“ (tägliche Einnahme für einen konstanten Spiegel) und „on-demand PrEP“ (Off-label-Verwendung; hier wird gemäß Schema vor und nach einem Risikokontakt die PrEP eingenommen).
Eine Monatspackung PrEP ist in Österreich ab 59 € erhältlich. Genaue Zahlen, wie viele Personen in Österreich tatsächlich PrEP verwenden, liegen aktuell nicht vor. Konsequente Surveillance-Arbeit sollte einen integralen Bestandteil in der Betreuung von Personen „on PrEP“ ausmachen und wird auch dezidiert in den Behandlungsrichtlinien empfohlen.16
Erste Ergebnisse einer Kohortenstudie der MedUni Wien
Während in Österreich bei HIV-Positiven auf eine hervorragende epidemiologische Aufarbeitung im Rahmen der „Austrian HIV Cohort Study“ (AHIVCOS) zurückgegriffen werden kann,9 fehlen bisher vergleichbare Daten für PrEP-Anwender. Daher wurde an der Universitätsklinik für Dermatologie,Medizinische Universität Wien, 2020 eine observative Kohortenstudie initiiert, um diese Lücke zu schließen. Die ersten Ergebnisse ein halbes Jahr nach Studienstart wurden auf der Jahrestagung der Österreichischen Gesellschaft für Dermatologie und Venerologie (ÖGDV) 2020 präsentiert.
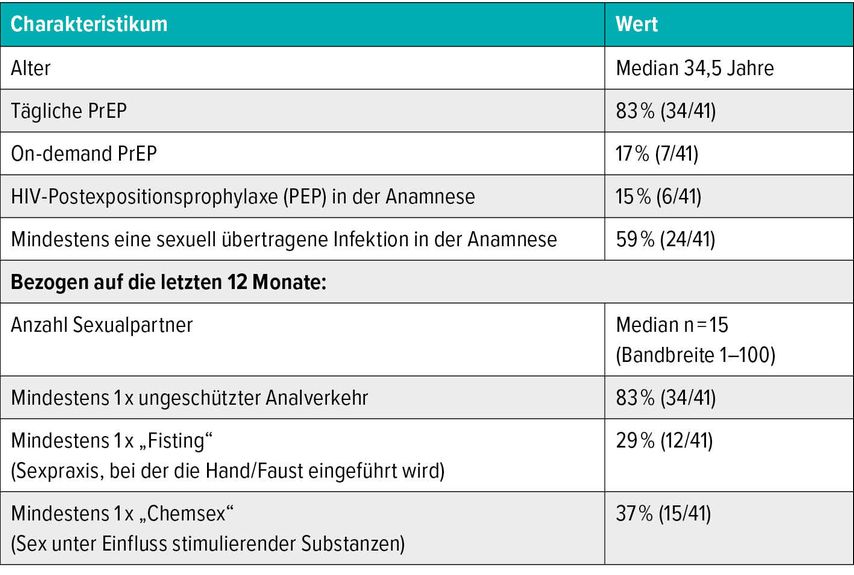
Von Juli bis November 2020 wurden insgesamt 41 Patienten eingeschlossen, das mediane Alter betrug 34,5 Jahre und alle Patienten waren der Gruppe der MSM zuzuordnen (Tab. 1). Zum Zeitpunkt des Einschlusses und anschließend alle drei Monate erfolgen Abstriche des Pharynx, der Urethra sowie anal zur Diagnostik von Neisseria gonorrhoeae, Chlamydia trachomatis und Mycoplasma genitalium sowie eine Blutabnahme zur HIV-, Syphilis- und Virushepatitis-Serologie. Auch eine durch Fragen strukturierte Anamnese wird erhoben und einmal jährlich wird die Diagnostik um Abstriche auf das humane Papillomavirus (HPV), eine anale Zytologie sowie eine Stuhltestung auf Parasiten, pathogene Keime und Helicobacter pylori erweitert.
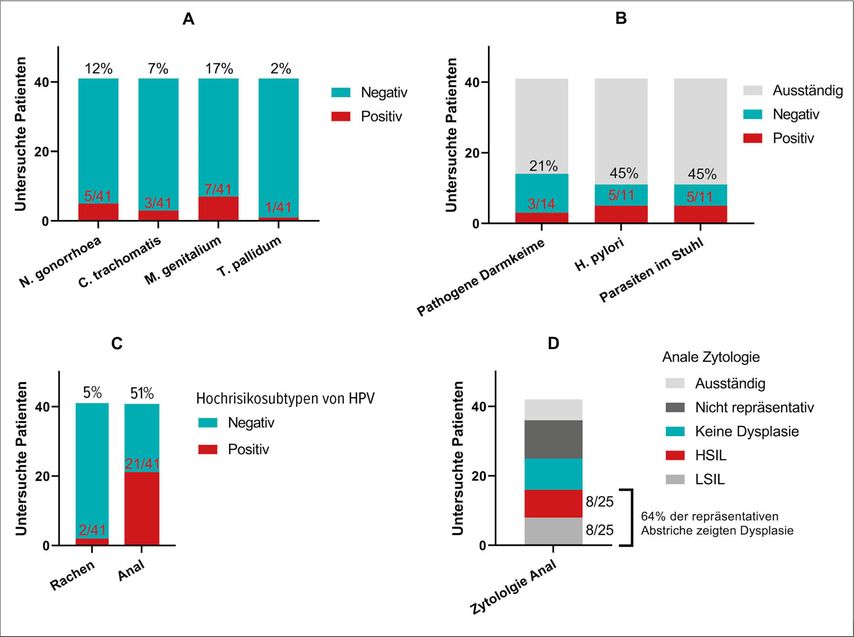
Zum Einschlusszeitpunkt wiesen 12% der Patienten eine Infektion mit Neisseria gonorrhoeae, 7% mit Chlamydia trachomatis, 17% mit Mycoplasma genitalium und 2% mit Treponema pallidum auf (Abb. 1A). Sämtliche Infektionen waren zum Zeitpunkt der Diagnosestellung asymptomatisch. Die Stuhluntersuchungen lagen erst von einer limitierten Anzahl von Personen vor. 21% (3/14) konnten als Ausscheider von pathogenen Darmerregern (enteropathogener E. coli, Campylobacter jejuni, Noroviren) identifiziert werden; Helicobacter pylori fand sich bei 45% (5/11) und ebenfalls 45% (5/11) wiesen eine Infektion mit mindestens einem Parasiten (Blastocystis sp., Endolimax nana und Entamoeba coli/dispar) auf (Abb. 1B). Im Analabstrich konnte bei 51% mindestens ein HPV-Hochrisiko-Subtyp gefunden werden und 64% der analen Zytologien demonstrierten zumindest eine niedriggradige Dysplasie (Abb. 1C+D). Der Anteil an festgestellten STIs an unserem Zentrum zum Zeitpunkt des Studieneinschlusses folgt somit dem internationalen Trend.11
Abb. 1: Panel A zeigt den Anteil an Patienten, die zum Einschlusszeitpunkt in mindestens einem der drei Abstriche (pharyngeal, urethral, anal) ein positives Ergebnis für den jeweiligen Erreger hatten oder im Fall von T. pallidum eine Serologie passend zu einer floriden Infektion. Auf Panel B finden sich die Ergebnisse der bisherigen Stuhluntersuchungen, wobei pathogene Darmkeime mittels eines „gastrointestinalen Panels“ einer Breitspektrum-Polymerase-Kettenreaktion (PCR) erfasst wurden. Hochrisikosubtypen des humanen Papillomavirus (HPV) wurden pharyngeal und anal untersucht (C) und „low-grade squamous intraepithelial lesions“ (LSIL) oder „high-grade squamous intraepithelial lesions“ (HSIL) fanden sich in der Mehrheit der Analabstriche (D)
Zu betonen ist an dieser Stelle, dass insgesamt 29% aller Personen zumindest eine STI hatte und diese allesamt asymptomatisch waren. Dies untermauert die Notwendigkeit eines konsequenten STI-Screenings bei PrEP-Anwendern.
Zugleich müssen allerdings strukturelle Hürden in der österreichweiten Etablierung der PrEP beleuchtet werden. Denn wie bereits erwähnt fällt eine PrEP als Präventivmaßnahme hierzulande in den Bereich der Privatleistungen. Dies inkludiert nicht nur die Medikation, sondern auch die deutlich kostenintensiveren Screening-Untersuchungen. Kann oder will ein PrEP-Anwender hierfür nicht aufkommen, steht man als Behandler vor dem Dilemma, entweder die Dauerprophylaxe zu beenden und damit eine HIV-Infektion zu riskierenoder die Behandlung weiter zu verordnen,mit dem Risiko, das Auftreten von STIzu übersehen. Auch der Preis von 59 € für eine Monatspackung ist ein Exklusivangebot einer Handvoll von Apotheken österreichweit und vorwiegend auf den urbanen Raum beschränkt; in den meisten Apotheken liegen die Kosten der PrEP bis dato beim Preis des generischen FTC/TDF, nämlich bei knapp über 200 €.
Fazit
Abschließend lässt sagen, dass die PrEP als effektive Maßnahme der HIV-Prävention nun auch in Österreich angelangt ist. Eine engmaschige Betreuung der PrEP-Anwender ist ganz wesentlich, um STI frühzeitig zu diagnostizieren und deren Verbreitung zu minimieren. Um dies zu ermöglichen, braucht es einen niederschwelligen und kostengünstigen oder kostenlosen Zugang sowohl zur Medikation als auch zu den damit einhergehenden Untersuchungen.
Literatur:
1 Grant RM et al.: N Engl J Med 2010; 363(27): 2587-99 2 Cardo DM et al.: N Engl J Med 1997; 337(21): 1485-90 3 Arenas-Pinto A et al.: Antivir Ther 2020; 25(1): 55-9 4 Mao L et al.: Sex Transm Infect 2011; 87(6): 489-93 5 Cohen MS et al.: N Engl J Med 2011; 365(6): 493-505 6 Cohen MS et al.: N Engl J Med 2016; 375(9): 830-9 7 Rodger AJ et al.: Lancet 2019; 393(10189): 2428-38 8 Hayes R et al.: Euro Surveill 2019; 24(41): 1900598 9 Leierer G et al.: Austrian HIV Cohort Study 2019 10 Reitsema M et al.: Aids 2020; 34(4): 621-30 11 Ong JJ et al.: JAMA Net Open 2019; 2(12): e1917134 12 Peuchant O et al.: Sex Transm Infect 2020; 96(8): 615-7 13 Cole MJ et al.: Sex Transm Infect 2020; 96(2): 137-42 14 Molina JM et al.: Lancet Infect Dis 2018; 18(3): 308-17 15 ClinicalTrials.gov: 2019. Online unter https://clinicaltrials.gov/ct2/show/NCT03709459?cond=NCT03709459. Abgerufen am 24. Jänner 2021 16 Ryom L et al.: HIV Med 2020; 21(10): 617-24 17 Danta M et al.: AIDS 2007; 21(8): 983-91 18 Chromy D et al.: J Hepatol 2019; 70(1): e40-e1 19 Chromy D et al.: Clin Infect Dis 2020; 71(5): 1292-9 20 Bradshaw D et al.: J Viral Hepat 2020; 27(7): 721-30 21 WHO: WHO Reference Number: WHO/HIV/2015.48
Das könnte Sie auch interessieren:
«Was wir brauchen, ist Aufklärung auf allen Ebenen»
Aufgrund der Seltenheit des hereditären Angioödems (HAE) dauert es oft lange, bis Betroffene eine korrekte Diagnose erhalten. Die Schweizer HAE-Vereinigung setzt sich seit fast 25 Jahren ...
«Wir reden in der Medizin zu wenig über Sex»
Wer im Kontext von Haut und Sexualität primär an sexuell übertragbare Infektionen (STI) denkt, könnte überrascht werden. Denn das Thema Sexualität ist gesundheitlich aus ganz ...
Die menschliche Haut in der modernen Kunst
Dr. Ralph Ubl, Professor für neuere Kunstgeschichte an der Universität Basel, stellte sich der schwierigen Herausforderung, einem Raum voller erwartungsvoller Dermatologen das Organ Haut ...