Neues zum malignen Melanom
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Auch wenn beim diesjährigen virtuellen ESMO-Meeting keine der Studien aus der Dermatoonkologie zur Präsentation in den Presidential-Symposien ausgewählt wurde, gab es doch einige spannende Studien, die in den Oral und Poster Sessions präsentiert wurden. In diesem Bericht haben wir zwei Studien zusammengefasst: zum einen ein Update zum Einsatz von Nivolumab beim Melanom in der CheckMate-238-Studie und zum anderen die Ergebnisse der Phase-II-Studie LEAP-004, die die Kombination von Pembrolizumab und Lenvatinib beim Melanom untersuchte.
4-Jahres-Daten bestätigen Nivolumab als adjuvante Standardtherapie
Die Phase-III-Studie CheckMate 238 zeigte die Überlegenheit von Nivolumab gegenüber dem aktiven Komparator Ipilimumab als adjuvante Therapie bei Melanompatienten in den Stadien IIIB–C und IV. Beim ESMO Virtual Congress 2020 wurden nun 4-Jahres-Daten präsentiert.
In der placebokontrollierten CheckMate-238-Studie erhielten insgesamt 906 Hochrisiko-Melanompatienten nach kompletter Resektion randomisiert Nivolumab (3mg/kg, i.v., q2w) plus Ipilimumab-Placebo oder Ipilimumab (10mg/kg, i.v., 4 Dosen q3w, dann q12w) plus Nivolumab-Placebo für eine maximale Dauer von einem Jahr. Der primäre Endpunkt war das verlängerte rezidivfreie Überleben (RFS) unter Nivolumab im Vergleich zu Ipilimumab.
Mit minimal 4 Jahren Nachbeobachtungszeit betrug das mediane RFS 52,4 Monate unter Nivolumab versus 24,1 Monate unter Ipilimumab (HR: 0,71; 95% CI: 0,60–0,86; p=0,0003) (Abb. 1). Nach 36 Monaten waren 58% versus 44% und nach 48 Monaten 52% versus 41% der Patienten unter Nivolumab versus Ipilimumab ohne Rezidiv. Aufgegliedert nach Tumorstadium zeigte sich eine Risikoreduktion für Patienten im Stadium IIIB–C von 29% (HR: 0,71; 95% CI: 0,58–0,88) und im Stadium IV von 26% (HR: 0,74; 95% CI: 0,49–1,11). Im Nivolumab-Arm betrug das mediane RFS für Stadium IIIB–C 52,4 Monate und für Stadium IV 47,4 Monate. Patienten mit In-transit-Metastasen ohne Lymphknotenbefall hatten mit adjuvanter Nivolumab-Therapie eine Risikoreduktion von 27% (HR: 0,73; 95% CI: 0,47–1,12) mit einem medianen RFS von 46,8 Monaten. Bei Patienten mit BRAF-mutierten Tumoren war der Median noch nicht erreicht, bei BRAF-Wildtyp betrug das mediane RFS 46,8 Monate. Die RFS-Risikoreduktion lag in diesen Subgruppen bei 21% (HR: 0,79; 95% CI: 0,60–1,05) bzw. 31% (HR: 0,69; 95% CI: 0,53–0,91).
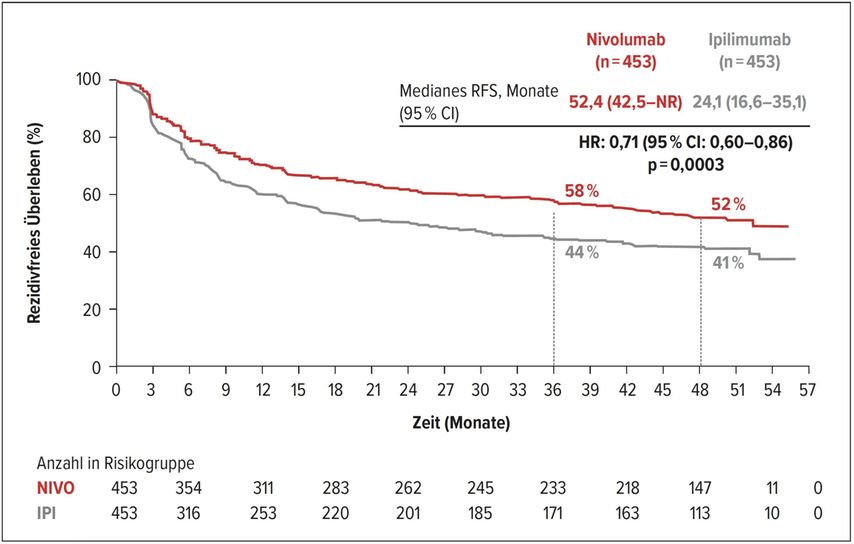
Abb. 1: Rezidivfreies Überleben (RFS) in der Studie CheckMate 238 unter Nivolumab im Vergleich zu Ipilimumab nach minimal 4 Jahren Nachbeobachtungszeit (nach Weber J et al.)1
Als explorativer Endpunkt wurde das fernmetastasenfreie Überleben (DMFS) von Patienten im Stadium IIIB–C untersucht und eine 21%ige Risikoreduktion bei Behandlung mit Nivolumab gegenüber Ipilimumab gesehen (HR: 0,79; 95% CI: 0,63–0,99). Das Gesamtüberleben (OS), ein sekundärer Endpunkt, war nicht verschieden zwischen den Nivolumab- und Ipilimumab-Studienarmen, allerdings waren bei Auswertung erst 211 OS-Ereignisse insgesamt eingetreten. Zudem zeigte sich in der Analyse der Folgetherapien eine Mehrzahl an Patienten, die nach Progress Ipilimumab, Nivolumab plus Ipilimumab oder Nivolumab erhalten hatten, was einem Cross-over-Effekt gleichkam. Ein Update der Nebenwirkungen zeigte spät auftretende Nebenwirkungen bei 4% der Patienten im Nivolumab-Arm und 5,5% der Patienten im Ipilimumab-Arm. Von Grad 3–4 wurden Nebenwirkungen bei 0,7% bzw. 1,5% der Patienten beider Studienarme beobachtet.
Fazit: Auch mit einer Nachbeobachtungszeit von minimal 4 Jahren zeigt sich der kontinuierliche Effekt der adjuvanten Nivolumab-Therapie mit einem Vorteil bezüglich des RFS und des DMFS gegenüber Ipilimumab. Das Gesamtüberleben war nicht verschieden mit 4-Jahres-OS-Raten von 78% versus 77%. Es wurden keine neuen Sicherheitssignale beobachtet.
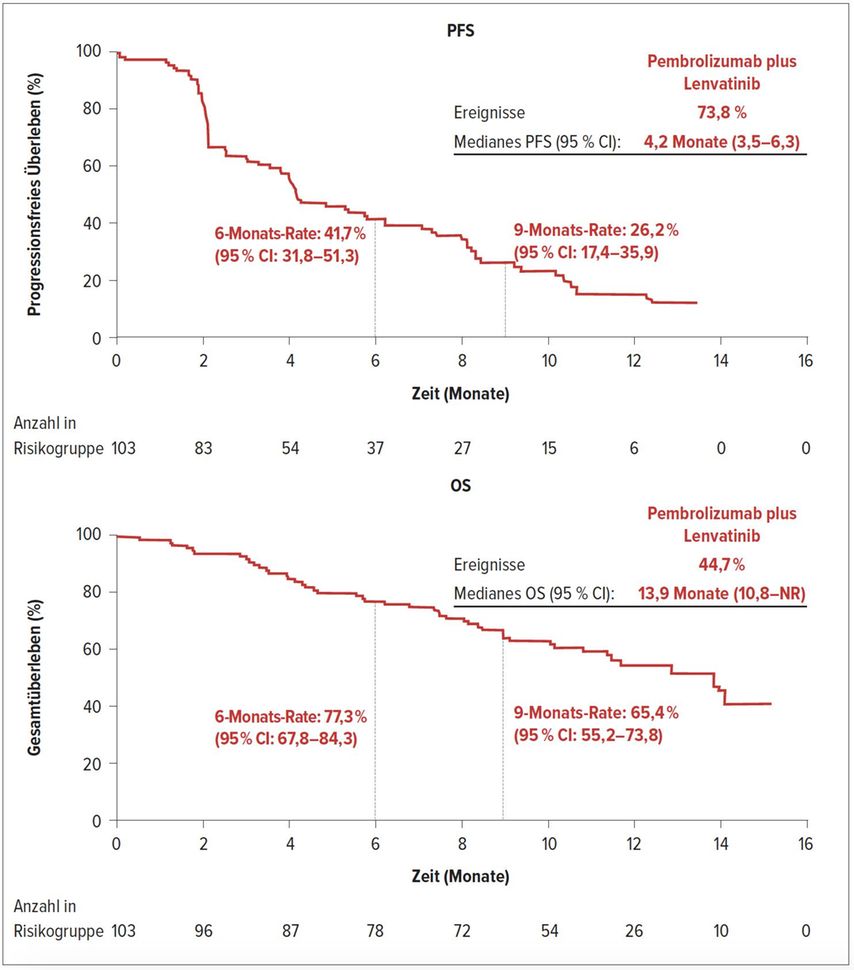
Abb. 2: Progressionsfreies Überleben (oben) und Gesamtüberleben (unten) in der Studie LEAP-004 unter Pembrolizumab plus Lenvatinib (nach Arance A et al.)2
Immuntherapie plus TKI vielversprechend bei intensiv vorbehandelten Patienten
Um die Wirksamkeit der Anti-PD-1-Immuntherapie zu verbessern, ist die Kombination mit einem Tyrosinkinaseinhibitor (TKI) eine rationale Option, wie in der einarmigen Phase-II-Studie LEAP-004 mit Pembrolizumab und Lenvatinib gezeigt wurde.
In derLEAP-004-Studie wurde Pembrolizumab (200mg, i.v., q3w) plus Lenvatinib (20mg, p.o., qd) bei Melanompatienten mit bestätigtem Progress unter oder innerhalb von 12 Wochen nach einer Anti-PD-(L)1-haltigen (Kombinations-)-Therapie geprüft. Die Kombinationstherapie wurde bis zum Progress oder inakzeptablen Nebenwirkungen gegeben. Es wurden 103 Patienten in einem medianen Alter von 63 Jahren eingeschlossen. Die Studienteilnehmer wiesen bei Studieneinschluss eine insgesamt schlechte Prognose auf. 55,3% der Patienten hatten einen erhöhten LDH-Wert, bei 20,4% betrug der LDH mehr als das Doppelte des Normwerts. Bei 14,6% der Patienten lagen Hirnmetastasen vor. 61,2% der Patienten hatten bereits ≥2 Therapien und 19,5% ≥4 Therapielinien erhalten. Eine BRAFV600-Mutation lag bei 36,9% der Patienten vor und 64,1% der Tumoren waren PD-L1-positiv.
Im Ergebnis wurde bei 21,4% der Patienten ein Ansprechen (primärer Endpunkt) beobachtet, 65,0% der Patienten zeigten eine Krankheitskontrolle. Mit einer medianen Nachbeobachtungszeit von 12 Monaten betrug die Dauer des Ansprechens median 6,3 Monate. Nach 6 Monaten waren noch 72,6% der Patienten mit Ansprechen in anhaltender Remission. Patienten, die im Vorfeld der Studie eine kombinierte Anti-CTLA4/Anti-PD-(L)1-Therapie erhalten hatten, zeigten ein Ansprechen in 31,0% und eine Krankheitskontrolle in 62,1% der Fälle. Das progressionsfreie Überleben (PFS) betrug median 4,2 Monate mit einer 6-Monats-Rate von 41,7% und einer 9-Monats-Rate von 26,2%. Bezüglich des Gesamtüberlebens (OS) wurde ein Median von 13,9 Monaten beobachtet, mit 6- und 9-Monats-OS-Raten von 77,3% bzw. 65,4%. Klinisch relevante Nebenwirkungen wurden bei 18,4% der Patienten gesehen. 7,8% der Patienten brachen die Therapie aufgrund von Nebenwirkungen ab.
Fazit: Die Kombination von Lenvatinib plus Pembrolizumab zeigte eine vielversprechende Antitumoraktivität bei Patienten mit fortgeschrittenem Melanom und bestätigtem Progress unter einem PD-(L)1-Inhibitor als Monotherapie oder in Kombination mit einem Anti-CTLA4-Antikörper. Die Ergebnisse weisen Lenvatinib plus Pembrolizumab als potenzielle Therapieoption für dieses Patientenkollektiv mit schlechter Prognoseaus.
Pembrolizumab als Monotherapie in der Adjuvanz bei Tumorstadium IIIA–C
Am ESMO-KOngress wurden auch die finalen Ergebnisse des fernmetastasenfreien Überlebens (DMFS) unter deradjuvanten Monotherapie mit Pembrolizumab bei Melanompatienten im Stadium III präsentiert. Die doppelblinde Phase-III-Studie EORTC1325-MG/KEYNOTE 054 untersuchte Pembrolizumab (200mg, q3w) im Vergleich zu Placebo bei 1019 Hochrisikopatienten mit reseziertem Melanom für die Dauer von einem Jahr. Danach wurde die Studie entblindet und Patienten konnten bei Krankheitsrückfall aus dem Placebo-arm in den Pembrolizumab-Arm wechseln oder bei Rezidiv >6 Monate nach Beendigung der Pembrolizumab-Therapie erneut Pembrolizumab erhalten. Beim ESMO-Meeting wurden die finalen Ergebnisse bezüglich des sekundären Endpunkts fernmetastasenfreies Überleben mit einer medianen Nachbeobachtungszeit von 3,5 Jahren präsentiert. Durch die Pembrolizumab-Gabe konnte das Risiko für Fernmetastasen um 40% reduziert werden (HR: 0,60; 95% CI 0,49–0,73; p<0,001). Die 42-Monats-DMFS-Rate betrug 65,3% unter Pembrolizumab versus 49,4% im Placeboarm. Innerhalb der Subgruppe der Patienten mit einer BRAF-Mutation wurde eine Risikoreduktion um 47% beobachtet (HR: 0,53), was mit dem Therapieerfolg mit zielgerichteten Therapien in der COMBI-AD-Studie vergleichbar war (HR: 0,55).
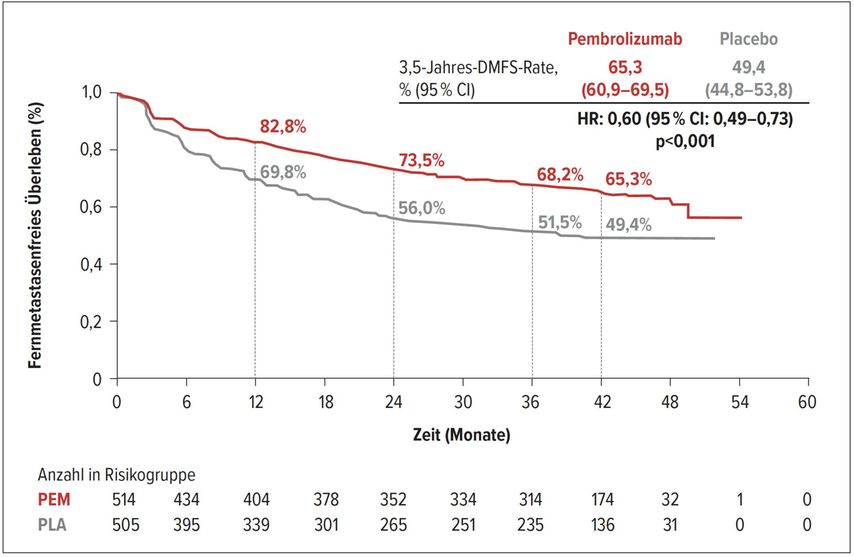
Abb. 3: Fernmetastasenfreies Überleben (DMFS) in der Studie EORTC1325-MG/KEYNOTE 054 (nach Eggermont AM et al.)3
Bericht:
Dr. Ine Schmale
Quelle:
Virtueller Jahreskongress der European Society for Medical Oncology (ESMO), 19.–21. September 2020
Literatur:
1 Weber J et al.: Adjuvant nivolumab vs ipilimumab in resected stage III/IV melanoma: 4-year recurrence-free and overall survival results from CheckMate 238. ESMO Virtual Congress 2020, Abstr. #1076O2 Arance Fernandez AM et al.: Lenvatinib plus pembrolizumab for advanced melanoma that progressed on a PD-1 or PD-L1 inhibitor: Initial results of LEAP-004. ESMO Virtual Congress 2020, Abstr. #LBA443Eggermont AM et al.: Pembrolizumab versus placebo after complete resection of high-risk stage III melanoma: Final results regarding distant metastasis-free survival from the EORTC 1325-MG/Keynote 054 double-blinded phase III trial. ESMO 2020, Abstr. #LBA46
Das könnte Sie auch interessieren:
«Was wir brauchen, ist Aufklärung auf allen Ebenen»
Aufgrund der Seltenheit des hereditären Angioödems (HAE) dauert es oft lange, bis Betroffene eine korrekte Diagnose erhalten. Die Schweizer HAE-Vereinigung setzt sich seit fast 25 Jahren ...
«Wir reden in der Medizin zu wenig über Sex»
Wer im Kontext von Haut und Sexualität primär an sexuell übertragbare Infektionen (STI) denkt, könnte überrascht werden. Denn das Thema Sexualität ist gesundheitlich aus ganz ...
Die menschliche Haut in der modernen Kunst
Dr. Ralph Ubl, Professor für neuere Kunstgeschichte an der Universität Basel, stellte sich der schwierigen Herausforderung, einem Raum voller erwartungsvoller Dermatologen das Organ Haut ...