Fallbericht: Tinea im Fokus
Autorinnen:
Dr.med. Intan Pramono
Cand.med. Nadja Telgenbüscher
Dr.med. C. Bettina Rümmelein
Hautwerk AG
Maneggstrasse 17, 8041 Zürich
E-Mail: klinik@hautwerk.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Behandlung von Tinea-corporis-Infektionen durch Trichophyton verrucosum und Trichophyton tonsurans erweist sich zunehmend als komplex und langwierig, da konventionelle Behandlungsstrategien vermehrt versagen. Dieser Fallbericht eines 8-jährigen Patienten illustriert die Schwierigkeiten, die durch diese Erreger entstehen, und verdeutlicht den dringenden Bedarf neuer Therapieansätze.
Keypoints
-
Die epidemiologische Relevanz von T.verrucosum und T.tonsurans nimmt zu. Umweltfaktoren und saisonale Trends sollten bei der Diagnose und Prävention berücksichtigt werden.
-
Im Falle von T.tonsurans ist die Übertragung durch asymptomatische Träger ein bedeutendes Risiko.
-
T.verrucosum wird hauptsächlich durch den Kontakt mit Rindern übertragen. Eine sorgfältige Anamnese bezüglich tierischer Kontakte und die Identifikation infizierter Tiere sind entscheidend.
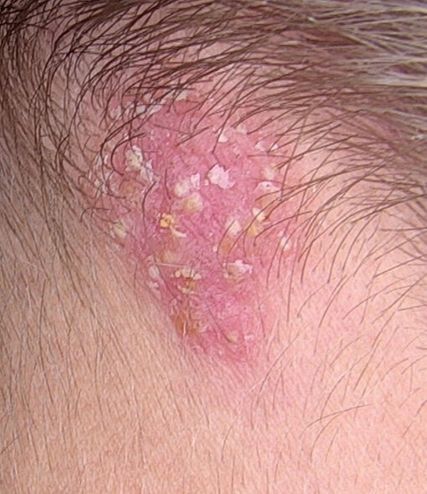
Abb. 2: Zwei Wochen nach Erstvorstellung nach topischer Anwendung von Mycoster® (Ciclopirox)
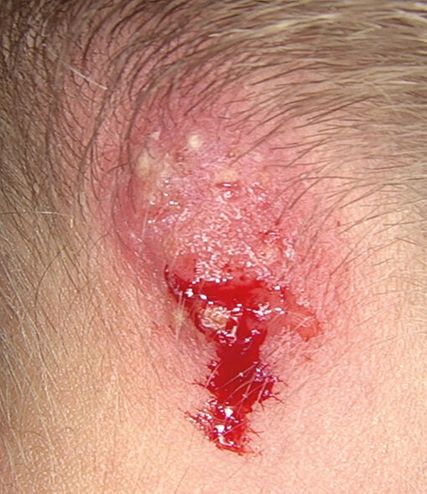
Abb. 3: Eine Woche später nach topischer Anwendung von Imacort® (Clotrimazol/Prednisolonacetat)
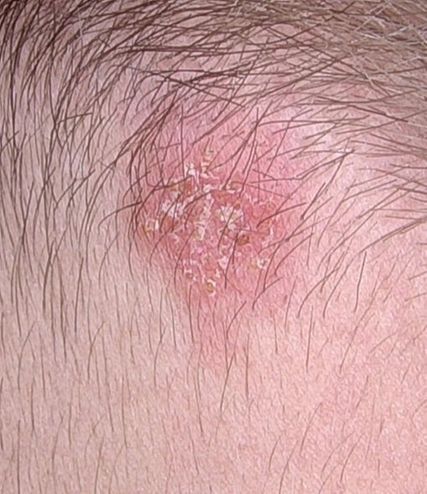
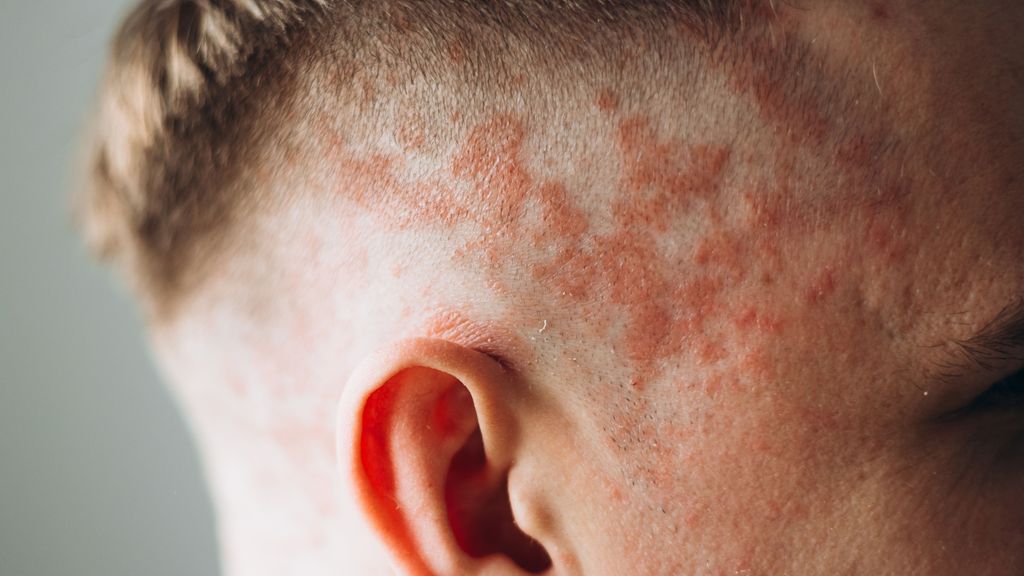
Wir berichten über einen 8-jährigen bislang gesunden, immunkompetenten Patienten ohne Vorerkrankungen oder Dauermedikation, der in Begleitung seiner Eltern unsere dermatologische Sprechstunde aufsuchte. Der Patient präsentierte eine ausgedehnte, erythematöse Dermatitis im Nackenbereich, begleitet von diskreten Pusteln sowie einer zentral schuppenden, erythematösen Plaque entlang des Haaransatzes (Abb. 1). Pruritus, Schmerzen und eine Allgemeinzustandsminderung wurden allesamt verneint. Anamnestisch trat die Symptomatik nach einem Urlaub in Rumänien sowie einem Aufenthalt am Sihlsee auf. Bereits vor der Vorstellung hatten die Eltern eine selbstinitiierte topische Therapie mit Fucicort® (Fusidinsäure) und Elocom® (Mometasonfuroat) eingeleitet, welche jedoch ohne klinisch relevante Verbesserung geblieben war.
Auf Grundlage der dermatologischen Untersuchung wurde die Verdachtsdiagnose einer Tinea corporis gestellt. Zur Diagnosesicherung erfolgte die Entnahme von Hautschuppen zur molekularen Diagnostik mittels Polymerase-Kettenreaktion (PCR). Zudem erfolgte die Etablierung einer topischen antimykotischen Therapie mit Mycoster® (Ciclopirox 10 mg/g). Die PCR-Analyse ergab den Nachweis von Trichophyton verrucosum sowie Fusarium solani. Aufgrund der zoonotischen Natur von Trichophyton verrucosum wurde den Eltern geraten, die im Haushalt befindlichen Haustiere auf mögliche Infektionen hin untersuchen und behandeln zu lassen. Retrospektiv ergab sich als wahrscheinliche Infektionsquelle der Kontakt zu Buckelrindern während des Rumänienaufenthaltes des Patienten, da diese Tiere vermutlich nicht geimpft waren und somit wohl als Überträger der Infektion fungierten.
Im Rahmen der Wiedervorstellung zwei Wochen später dokumentierten wir eine Verschlechterung des klinischen Bildes (Abb. 2). Die betroffenen Areale hatten sich erheblich vergrössert und zeigten eine zunehmende Exsudation sowie entzündliche Induration. Besonders auffällig war die Läsion im okzipitalen Bereich, die erhabene Papeln sowie punktuelle Blutungen aufwies. Angesichts des fehlenden Ansprechens auf die initiale Ciclopirox-Therapie erfolgte ein Therapiewechsel auf Imacort® (Clotrimazol/Prednisolonacetat). Bei weiterer Verschlechterung des Befundes und fehlendem Therapieansprechen erfolgte angesichts der allgemein bekannten Resistenzproblematik eine Resistenztestung der nachgewiesenen Dermatophyten (Abb. 3). Zeitgleich erfolgte die Einleitung einer systemischen Therapie mit Terbinafin Mepha® (125mg täglich), ergänzt durch die fortgesetzte lokale Anwendung von Mycoster®-Creme und Sebiprox®-Shampoo (Ciclopirox).
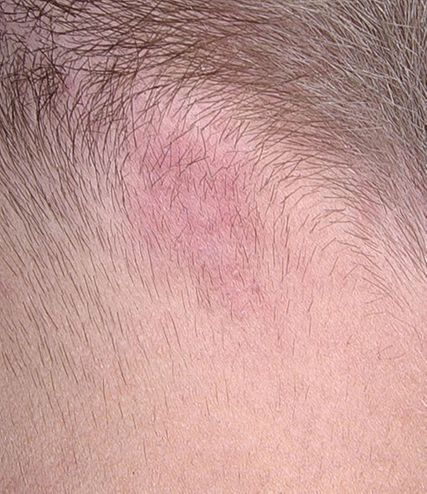
Unter der systemischen Terbinafin-Therapie zeigte sich bereits nach einer Woche eine deutliche klinische Besserung mit beginnender Rückbildung der Hautläsionen. Die systemische Therapie wurde für insgesamt sieben Wochen fortgeführt, da nach zunächst zügigem Ansprechen einzelne nummuläre Läsionen persistierten. Zwei Monate nach Behandlungsbeginn konnte eine vollständige Abheilung aller Läsionen dokumentiert werden (Abb. 4).
Trichophyton verrucosum
Trichophyton verrucosum ist ein dermatophytischer Pilz, der als Erreger der sogenannten Kälberflechte bekannt ist. Es handelt sich um eine Zoonose, wobei meist Rinder das Hauptreservoir darstellen. In selteneren Fällen können jedoch auch andere Nutztiere, Katzen oder Hunde als Überträger fungieren.1 Eine indirekte Übertragung durch den Kontakt mit sporenhaltigen Gegenständen in Ställen oder Futterstellen ist ebenfalls möglich.2–4
Die Prävalenz von T.-verrucosum-Infektionen ist in ländlichen Gebieten signifikant höher als in städtischen Regionen. Dies korreliert mit der erhöhten Inzidenz der Tinea corporis und Tinea barbae in Regionen mit intensiver Rinderhaltung, wobei häufig Landwirte und Tierärzte, die regelmässig mit infizierten Tieren oder deren Umgebung in Kontakt kommen, betroffen sind. Eine Studie wies im Raum Leipzig eine Prävalenz von rund 24% an von Kälberflechte betroffenen Rindern nach. In etwa der Hälfte der Infektionsfälle gaben Landwirte an, dass sie keine sichtbaren Läsionen an den infizierten Tieren bemerkt oder erkannt hätten. Dies stellt ein erhöhtes unbemerktes Risiko für die Übertragung dar. Ein weiteres Risiko stellt die fehlende Immunisierung von Kälbern in der Viehhaltung dar, da sowohl Kälber als auch Rinder als direkte Infektionsquellen fungieren können. Ein saisonaler Anstieg der Fälle im Winter wird ebenfalls beobachtet, da Rinder in dieser Zeit enger zusammengehalten werden und die menschliche Haut durch kaltes Wetter sowie mechanische Reizung anfälliger für Infektionen ist. In der Schweiz ist etwa 1% der Dermatophytosen auf eine Infektion mit T.verrucosum zurückzuführen, wobei in den letzten Jahren ein kontinuierlicher Anstieg der Infektionen beobachtet wurde.3,5–7
Die Pathogenese der T.-verrucosum-Infektion beginnt mit der Exposition gegenüber dem Pilz, der sich auf die Hautoberfläche des Menschen überträgt. Die Inkubationszeit kann variieren, wobei typischerweise Symptome innerhalb von zwei bis vier Wochen nach dem Kontakt auftreten.6 Die Pilzsporen dringen in die obersten Hautschichten ein und induzieren eine entzündliche Reaktion, die sich klinisch als Tinea corporis oder Tinea barbae manifestiert. T.verrucosum ist bekannt für seine Fähigkeit, eine ausgeprägte entzündliche Reaktion zu induzieren, die oft mit pustulösen und krustigen Läsionen einhergeht. Diese klinischen Manifestationen sind besonders bei Tinea barbae ausgeprägt, bei welcher tiefsitzende, pustulöse Läsionen im Bartbereich auftreten können.8
Trichophyton tonsurans
Neben Trichophyton verrucosum stellt Trichophyton tonsurans ein weiteres «emerging pathogen» dar. Im Gegensatz zu Ersterem handelt es sich bei T.tonsurans um einen rein anthropophilen Erreger, der durch direkten menschlichen Kontakt oder durch die Nutzung kontaminierter Objekte übertragen wird. Bereits ein kurzzeitiger Kontakt kann eine Infektion initiieren. In urbanen Umgebungen ist die Übertragung von T. tonsurans besonders weit verbreitet. Zu den häufigsten Infektionsquellen zählen kontaminierte Bürsten, Kämme und Scheren in Barbershops und Friseursalons. Bei geringfügigen Hautverletzungen, die beim Rasieren oder Haareschneiden mit verunreinigten Geräten entstehen, kann der Pilz in die Epidermis eindringen und dort Infektionen hervorrufen. Darüber hinaus sind Gemeinschaftseinrichtungen wie Pflegeheime, Schulen sowie das häusliche Umfeld potenzielle Übertragungsorte, wo der Erreger über gemeinsam genutzte Gegenstände verbreitet werden kann. Eine direkte Übertragung erfolgt indes typischerweise in Kontaktsportarten, dann häufig als Tinea corporis gladiatorum bzw. Ringerpilz bezeichnet. Ebenfalls besteht die Möglichkeit einer Übertragung durch asymptomatische Träger, was die Kontrolle der Infektionen zusätzlich erschwert.9
T.tonsurans ist ein weltweit verbreiteter Dermatophyt, der eine besonders hohe Prävalenz in Grossbritannien und den Vereinigten Staaten aufweist. Laut einer Studie von Foster et al. sind in den USA 95% der Fälle von Tinea capitis auf T.tonsurans zurückzuführen.10 Hierbei scheinen afroamerikanische Kinder überproportional betroffen zu sein. Diese stellen in den meisten veröffentlichten Studien mindestens 90% der Fälle dar, wobei bei bis zu 15% asymptomatischer afroamerikanischer Schulkinder der Erreger auf der Kopfhaut nachgewiesen wurde.11
In West- und Mitteleuropa spielte T.tonsurans bis vor Kurzem eine untergeordnete Rolle. Jedoch wird seit einigen Jahren ein weltweiter Anstieg an durch T.tonsurans verursachten Dermatomykosen beobachtet. So dokumentierte eine Studie von Pilz et al. im Grossraum München einen Anstieg des Anteils von T.tonsurans an den Dermatophyteninfektionen von 2,1% im Jahr 2019 auf 20,7% im Jahr 2022.12
Tinea corporis und Tinea capitis sind die beiden häufigsten klinischen Erscheinungsformen einer Infektion mit T.tonsurans. Im Gegensatz zu Dermatophytosen, die durch andere Dermatophyten verursacht werden, sind die klinischen Merkmale einer T.-tonsurans-Infektion anfangs unauffällig und werden häufig übersehen. Die durch T.tonsurans verursachte Tinea corporis manifestiert sich häufig als kleine, rosafarbene, schuppige Plaques mit oft nur 1–2cm Durchmesser, welche keine zentrale Abheilung zeigen, was die Unterscheidung von Ekzemen erschwert.13
Diagnostik
Trichophyton verrucosum und Trichophyton tonsurans weisen signifikante Unterschiede in ihrer epidemiologischen Relevanz und klinischen Präsentation auf. Dies unterstreicht die Notwendigkeit einer differenzierten Diagnostik, wobei der Nachweis eine diagnostische Herausforderung darstellen kann.
Die klinische Diagnostik beginnt mit der sorgfältigen Erhebung der Anamnese und der Bewertung der charakteristischen Symptome. Zur mikroskopischen Diagnostik werden im Anschluss randständige Schuppen sowie epiliertes Haar entnommen. Konventionelle Nativpräparate, die mit Kaliumhydroxid (KOH) behandelt werden, erlauben eine rasche Diagnose einer Dermatophyteninfektion, weisen jedoch lediglich eine Sensitivität von 40–68% auf. Diese kann durch die Verwendung von Blankophor und den Einsatz der Fluoreszenzmikroskopie begrenzt gesteigert werden. Die Pilzkultur, die ebenfalls eine eingeschränkte Sensitivität aufweist, erfordert eine Inkubationszeit von drei bis fünf Wochen, um die in ihrer Wachstumsrate langsamen Erreger zu isolieren. Im Gegensatz zu kulturellen Methoden bietet der molekularbiologische Nachweis mittels Polymerase-Kettenreaktion (PCR) wesentliche Vorteile. Diese Technik zeichnet sich durch eine höhere Sensitivität aus und ermöglicht eine schnellere Diagnosestellung. Die Durchführung einer Hautbiopsie kann unter Einsatz spezifischer Färbetechniken auch wertvolle diagnostische Informationen liefern. Jüngste Fortschritte ermöglichen zudem den direkten Nachweis von DNA in formalinfixierten und paraffineingebetteten Hautgewebeschnitten durch Sequenzierung der internen transkribierten Spacerregion (ITS) der Pilz-DNA. Diese Methode bietet nicht nur eine hohe Spezifität, sondern liefert auch zeitnah Ergebnisse, was ihren Stellenwert in der modernen Diagnostik unterstreicht.14
Therapieansätze und Prophylaxe
Die Behandlung von Dermatophytosen, die durch Trichophyton verrucosum und Trichophyton tonsurans verursacht werden, erfordert einen an die Schwere der Erkrankung angepassten Therapieansatz. Die lokalisierte oder oberflächliche Tinea corporis spricht in der Regel gut auf topische Antimykotika an, die ein- oder zweimal täglich für eine Dauer von zwei bis vier Wochen auf die Läsionen und mindestens 2cm darüber hinaus aufgetragen werden. Zu den häufig verwendeten topischen Antimykotika zählen Azole (z.B. Econazol, Ketoconazol, Miconazol, Clotrimazol), Allylamine (z.B. Terbinafin), Benzylamine (Butenafin), Ciclopirox und Tolnaftat.15
Für schwerwiegendere oder ausgedehntere Infektionen ist hingegen häufig eine systemische Therapie indiziert. Hierbei stellt bei Infektionen mit T.verrucosum und T.tonsurans die systemische Therapie mit einmal täglich Terbinafin 250mg die erste Wahl in der Schweiz dar (bei Kindern gewichtsadaptiert), während in anderen Teilen der Welt, insbesondere in den USA, bei Infektionen mit T.tonsurans primär Griseofulvin eingesetzt wird. Als alternative Behandlungsmöglichkeit kommt Itraconazol zum Einsatz. Fluconazol hat sich ebenso als wirksam erwiesen, sollte jedoch aufgrund seiner geringeren Effektivität als Third-Line-Therapie eingeordnet werden. Die empfohlene Therapiedauer mit oralen Antimykotika beträgt in der Regel zwei bis vier Wochen. Für Tinea capitis ist tendenziell eine längere Behandlungsdauer erforderlich, die mindestens vier Wochen betragen sollte, um einen umfassenden Therapieerfolg zu gewährleisten. Zudem ist die ergänzende lokale Therapie mit ciclopiroxolaminhaltigen Lösungen, Cremes oder Shampoos ratsam.16,17
Aufgrund der hohen Übertragungsrate spielen im Falle von T.tonsurans asymptomatische Träger innerhalb des Haushalts oder der Gemeinschaftseinrichtung eine wesentliche Rolle bei der Verbreitung der Infektion. Aus diesem Grund sind präventive Hygienemassnahmen und die konsequente Therapie entscheidend. Viele Experten empfehlen Haushaltsmitgliedern eine präventive empirische Lokaltherapie mittels zweimal wöchentlicher Anwendung von Ketoconazol-Shampoos.18
Im Falle von T.verrucosum ist zudem die Identifizierung der Infektionsquelle von erheblicher Bedeutung, welche unter anderem die gründliche Desinfektion der Ställe und Geräte sowie die Therapie infizierter Tiere einschliesst. Darüber hinaus bietet die Impfung der Tiere mit einer Lebendvakzine eine wertvolle präventive Massnahme, die sowohl zur Vorbeugung als auch zur Verkürzung der Krankheitsdauer bei den Tieren beiträgt. Studien belegen, dass eine flächendeckende Immunisierung die Prävalenz von Kälberflechte signifikant senken kann.19
Resistenzen
Die Zunahme antifungal resistenter Dermatophyten stellt eine erhebliche Herausforderung in der klinischen Praxis dar. Der unangemessene Gebrauch von Antimykotika führt zur Selektion therapieresistenter Pathogene. Dabei tragen die Verfügbarkeit von rezeptfrei erhältlichen Antimykotika, die Nichteinhaltung der Therapie durch Patienten, Kombinationstherapien, die Antimykotika und topische Steroide enthalten, sowie Veränderungen in Zusammenhang mit Reisen und Migration zum globalen Anstieg der antifungalen Resistenz bei. Längere Exposition gegenüber subinhibitorischen Konzentrationen von Antimykotika wird zusätzlich als ein möglicher Faktor angesehen.
Waren bis vor einigen Jahren lediglich sporadisch Fälle von Terbinafin-resistenten (TerR) Trichophyton-spp.-Isolaten bekannt, kam es in den letzten Jahren regelrecht zu einem Ausbruch an Terbinafin-resistenten Tineafällen, welche vor allem auf den Erreger Trichophyton indotineae aus Indien zurückzuführen waren. Die molekulare Grundlage dieses TerR-Phänotyps ist mit verschiedenen Punktmutationen im Gen assoziiert, das für das Enzym Squalenepoxidase (SQLE) kodiert. Dieses nimmt eine entscheidende Rolle im Ergosterol-Biosyntheseweg ein.20 Terbinafin-Resistenzen bei T.verrucosum und T.tonsurans sind aktuell selten. So wurden in einer japanischen Untersuchung von 237 T.-tonsurans-Isolaten zwischen 2000 und 2020 keine resistenten Stämme gefunden.21 Diese Ergebnisse deuten darauf hin, dass Terbinafin weiterhin wirksam zur Kontrolle der Epidemie von T.tonsurans und T.verrucosum eingesetzt werden kann. Da das Auftreten von Terbinafin-resistenten Dermatophyten jedoch generell beobachtet wird, sollte bei ausbleibender klinischer Besserung stets an eine Terbinafin-Resistenz gedacht werden. Eine In-vitro-Resistenztestung sowie eine Punktmutationsanalyse des Gens der Squalenepoxidase ist in solchen Fällen in Erwägung zu ziehen.22
In den letzten Jahren haben darüber hinaus auch die Anzahl der azolresistenten klinischen Isolate aus dem Trichophyton-Genus sowie die Gruppe infizierter Patienten zugenommen, die nicht auf die initiale Therapie ansprachen. Bisher wurden jedoch nur Einzelfälle dokumentiert, die durch den anthropophilen Dermatophyten T.rubrum verursacht wurden, in welchem eine Unempfindlichkeit gegenüber azolhaltigen Behandlungen festgestellt wurde. Bei zoophilen Dermatophyten, insbesondere bei T.verrucosum, wurden bislang keine azolresistenten Phänotypen nachgewiesen.23
Zusammenfassend lässt sich festhalten, dass der Anstieg von Tineainfektionen durch Trichophyton verrucosum und Trichophyton tonsurans eine erhöhte Aufmerksamkeit in der dermatologischen Praxis erfordert. Effektive Therapieansätze, präventive Massnahmen sowie die Berücksichtigung möglicher Resistenzen sind entscheidend, um die Behandlungsergebnisse zu optimieren und die Ausbreitung dieser Erreger einzudämmen.
Literatur:
1 Gedek B: Pilzkrankheiten der Haustiere. In: Rolle M, Mayr A (Hg.): Medizinische Mikrobiologie, Infektions- und Seuchenlehre. Enke Verlag, 2007. 584-606 2 Roman C et al.: Six cases of infection due to Trichophyton verrucosum. Mycoses 2001; 44: 334-7 3 Guebeli A et al.: A rare case of cutaneous Trichophyton verrucosum of the forearm in a 51-year-old cattle farmer. J Hand Surg Am 2021; 46(12): 1128.e1-4 4 Blömer RH et al.: Tinea capitis profunda durch Trichophyton verrucosum mit abszedierender Superinfektion durch cMRSA bei einem Kleinkind. Hautarzt 2012; 63: 648-52 5 Courtellemont L et al.: Epidemiology of Trichophyton verrucosum infection in Rennes University Hospital, France: a 12-year retrospective study. Med Mycol 2017; 55(7): 720-4 6 Łagowski D et al.: In search of the source of dermatophytosis: epidemiological analysis of Trichophyton verrucosum infection in llamas and the breeder (case report). Zoonoses Public Health 2019; 66(8): 982-9 7 Bartosch T et al.: MALDI-TOF MS analysis of bovine and zoonotic Trichophyton verrucosum isolates reveals a distinct peak and cluster formation of a subgroup with Trichophyton benhamiae. Med Mycol 2018; 56: 602-9 8 O’Gorman SM et al.: An uncommon dermatophyte infection: two cases of cutaneous infection with Trichophyton verrucosum. Clin Exp Dermatol 2015; 40: 395-8 9 Schiessl J et al.: Trichophyton tonsurans – ein Emerging-Pathogen im Ringsport in Deutschland. Hautarzt 2021; 72(10): 878-91 10 Foster KW et al.: Epidemiologic surveillance of cutaneous fungal infection in the United States from 1999 to 2002. J Am Acad Dermatol 2004; 50(5): 748-52 11 Sharma V et al.: Do hair care practices affect the acquisition of tinea capitis? A case-control study. Arch Pediatr Adolesc Med 2001; 155(7): 818-21 12 Pilz JF et al.: Increasing incidence of Trichophyton tonsurans in Munich - a single-centre observation. Mycoses 2023; 66(5): 441-7 13 Hiruma J et al.: Trichophyton tonsurans infection in Japan: epidemiology, clinical features, diagnosis and infection control. J Dermatol 2015; 42(3): 245-9 14 Nenoff P, Krüger C: Dermatophyten-Infektionen der Haut, Haare und Nägel – ein Update. Aktuelle Derm 2012; 38: 432-41 15 Bhatia A et al.: Efficacy of oral terbinafine versus itraconazole in treatment of dermatophytic infection of skin - a prospective, randomized comparative study. Indian J Pharmacol 2019; 51(2): 116-9 16 Chen X et al.: Systemic antifungal therapy for tinea capitis in children. Cochrane Database Syst Rev 2016; 2016(5): CD004685 17 Galili E et al.: Tinea capitis caused by Trichophyton tonsurans among adults: clinical characteristics and treatment response. Mycoses 2023; 66(2): 144-9 18 Greer DL: Successful treatment of tinea capitis with 2% ketoconazole shampoo. Int J Dermatol 2000; 39(4): 302-4 19 Schumny U et al.: Berufliche Infektion mit Trichophyton verrucosum bei einem Rinderzüchter. Hautarzt 2020; 71: 899-902 20 Moreno-Sabater A et al.: Terbinafine resistance in dermatophytes: a French multicenter prospective study. J Fungi (Basel) 2022; 8(3): 220 21 Futatsuya T et al.: Genotyping of Trichophyton tonsurans strains isolated between 2016 and 2020, and terbinafine susceptibility of the species in Japan. J Dermatol 2022; 49(7): 691-6 22 Appelt L et al.: Terbinafin-resistente Dermatophytosen und Onychomykose durch Trichophyton rubrum. Hautarzt 2021; 72(10): 868-77 23 Gnat S et al.: Modulation of ERG gene expression in fluconazole-resistant human and animal isolates of Trichophyton verrucosum. Braz J Microbiol 2021; 52(4): 2439-46
Das könnte Sie auch interessieren:
«Was wir brauchen, ist Aufklärung auf allen Ebenen»
Aufgrund der Seltenheit des hereditären Angioödems (HAE) dauert es oft lange, bis Betroffene eine korrekte Diagnose erhalten. Die Schweizer HAE-Vereinigung setzt sich seit fast 25 Jahren ...
«Wir reden in der Medizin zu wenig über Sex»
Wer im Kontext von Haut und Sexualität primär an sexuell übertragbare Infektionen (STI) denkt, könnte überrascht werden. Denn das Thema Sexualität ist gesundheitlich aus ganz ...
Die menschliche Haut in der modernen Kunst
Dr. Ralph Ubl, Professor für neuere Kunstgeschichte an der Universität Basel, stellte sich der schwierigen Herausforderung, einem Raum voller erwartungsvoller Dermatologen das Organ Haut ...