Der Nutzen und die Limiten der Therapie mit mesenchymalen Stammzellen
Autoren:
PD Dr. med. Riccardo Schweizer
PD Dr. med. Holger J. Klein
Prof. Dr. med. Jan A. Plock
Klinik für Plastische Chirurgie und Handchirurgie
Kantonsspital Aarau
Korrespondierender Autor:
PD Dr. med. Riccardo Schweizer
E-Mail: riccardo.schweizer@gmail.com
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Neue Perspektiven in der Transplantationsmedizin, speziell in der «vascularized composite allotransplantation»: Aus Fettgewebe isolierte Stammzellen könnten einen bedeutenden Beitrag zur Verbesserung der Ergebnisse nach Eingriffen wie Hand- oder Gesichtstransplantation leisten.
Keypoints
-
Innovativer Ansatz für Transplantationen: Stammzellen aus Fettgewebe bieten eine vielversprechende Möglichkeit, Transplantatabstossungen zu verhindern oder zu behandeln und die Langzeitergebnisse zu verbessern.
-
Weniger Nebenwirkungen: Durch die Kombination von Stammzellen mit niedrigeren Dosen von Immunsuppressiva könnten Nebenwirkungen wie Nierenschäden, hormonelle Störungen und Krebsrisiken reduziert werden.
-
Fettstammzellen haben viele positive Eigenschaften, die in der Transplantation nützlich sein können (Immunmodulation, Schutz der Blutgefässe, Entzündungshemmung) und können sowohl vom Spender als auch vom Empfänger in grosser Zahl isoliert und potenziell auch für die spätere Anwendung eingefroren und kultiviert werden.
Denn sogenannte «adipose-derived mesenchymal stem cells» (ASC) zeigen vielversprechende Eigenschaften: Sie können unter anderem Entzündungsprozesse regulieren, Blutgefässe schützen und das Immunsystem modulieren. Aktuelle experimentelle Studien zeigen, wie diese Zellen einerseits präventiv die Abstossung von transplantiertem Gewebe verhindern und langfristige Toleranz ohne Immunsuppressiva fördern, andererseits aber auch in der Therapie einer bereits begonnenen Abstossung behilflich sein können.
Einführung
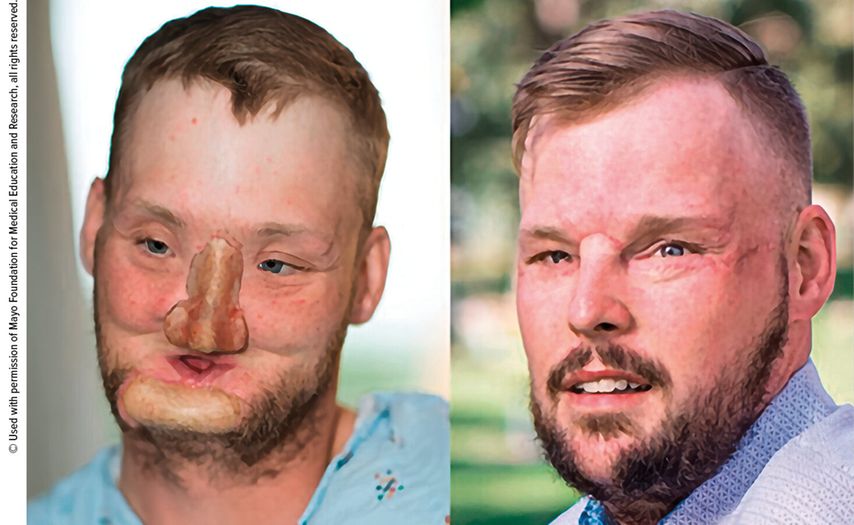
In der Welt der rekonstruktiven Chirurgie bietet die «vascularized composite allotransplantation» (VCA) eine Behandlungsoption, wenn traditionelle Rekonstruktionsmethoden an ihre Grenzen stossen. Bei der VCA werden komplexe Gewebekomposite, bestehend aus verschiedenen Gewebearten wie Haut, Muskeln, Nerven und Gefässen, transplantiert, um beispielsweise eine Hand oder ein Gesicht funktionell und ästhetisch wiederherzustellen. Weltweit wurden bereits mehrere Hundert solcher Eingriffe erfolgreich durchgeführt. Abbildung 1 zeigt ein Beispiel der ersten Gesichtstransplantation an der Mayo Clinic. Diese hochkomplexen Operationen erfordern jedoch eine präzise Indikationsstellung, sorgfältige Planung und ein erfahrenes, interdisziplinäres Team, das auf diesem Gebiet spezialisiert ist.1,2
Abb. 1: Eindrucksvolles ästhetisches und funktionelles Beispiel eines Gesicht-transplantierten Patienten nach einer komplexen traumatischen Verletzung in suizidaler Absicht (Patient Andy Sandess, operiert durch Dr. med. Samir Mardini und Team an der Mayo Clinic)
Auch wenn die Ergebnisse oft beeindruckend sind, haben sie eine Schattenseite: die Notwendigkeit einer lebenslangen medikamentösen Immunsuppression. Verschiedene Kombinationen von Medikamenten wie z.B. Calcineurin-Inhibitoren (Tacrolimus, Sirolimus), Cyclosporin A und Glukokortikoide schützen das transplantierte Gewebe zwar vor einer Abstossung, verursachen jedoch langfristig schwerwiegende Nebenwirkungen wie Nierenschäden, ein erhöhtes Krebsrisiko und hormonelle Störungen inkl. Diabetes.1
Gibt es eine Möglichkeit, die Vorteile von Transplantationen ohne Nebenwirkungen dieser toxischen Medikamente zu nutzen? Die Antwort könnte zumindest teils in den aus Fett gewonnenen mesenchymalen Stammzellen (ASC) liegen.
Ein neuer Ansatz im Kampf gegen Abstossungen
Mesenchymale Stammzellen, z.B. aus Fettgewebe gewonnen, stehen aufgrund ihrer breiten therapeutischen Fähigkeit im wissenschaftlichen Rampenlicht. Sie können etwa ein überaktives Immunsystem modulieren, die Wundheilung unterstützen, Narben und Gewebestruktur positiv beeinflussen und die Angiogenese sowie die Nervenregeneration fördern.3,4
Aber warum Fettzellen? Neben ihrer hohen Anzahl und der einfachen Isolierung (z.B. durch Liposuktion) sind aus Fett gewonnene Stammzellen vielseitig und können leicht sowohl von Spendern bei der Transplantatentnahme bzw. Transplantation als auch vom Empfänger gewonnen werden. Einmal entnommene Stammzellen können eingefroren und für den späteren Gebrauch aufbewahrt werden, was ein grundsätzlich praktischer Vorteil für den klinischen Einsatz ist.5,6
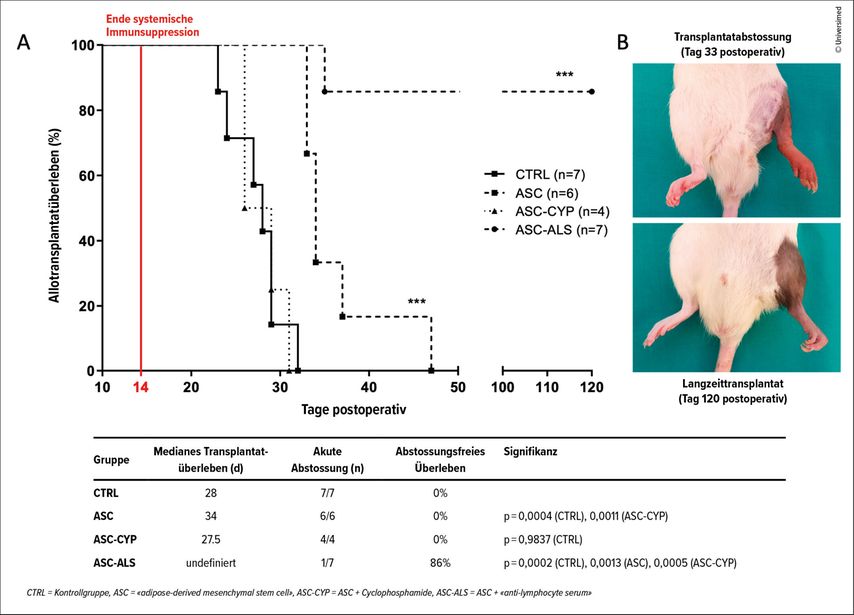
Während diese Zellen aus Fett oder Knochenmark von unserer und weiteren Gruppen bereits zur Prävention der Abstossung bei VCA und Toleranzentwicklung erfolgreich im Tiermodell getestet wurden (Abb.2),7–11 ging es in der aktuellen Studie um eine andere Frage: Können diese Stammzellen eine Abstossung behandeln, wenn sie bereits begonnen hat?
Abb. 2: In einer früheren Studie zeigten wir, wie mehrere intravenöse Gaben von ASC kombiniert mit dem Medikament Belatacept (CTLA-4-Antikörper) und nur kurzer immunsuppressiver Medikation langfristig die Transplantate vor akuter und chronischer Abstossung schützen können (Gruppe ASC-ALS, modifiziert nach Schweizer R et al. 2020)7
Stammzellen zur Behandlung der aktiven Abstossung
In der aktuellen Studie untersuchten wir in einem etablierten Tiermodell, ob ASC auch die akute Abstossung von transplantierten Hinterläufen von Ratten verlangsamen oder gar stoppen können – also in jener Phase, in der das Immunsystem das transplantierte Gewebe bereits aktiv angreift. Ausserdem untersuchten wir, inwiefern die Stammzellen die Blutgefässe im transplantierten Gewebe schützen können, da diese im Rahmen der chronischen und akuten Abstossung meist mitbeschädigt werden.12
Die Studie testete zwei Methoden der ASC-Verabreichung: direkt in das transplantierte Gewebe (lokale Applikation) oder über die Blutbahn (systemische Applikation). Die Versuchstiere wurden in Gruppen eingeteilt – einige erhielten Stammzellentherapie (2,5 Millionen Zellen an Tag 1 und 3 ab klinisch manifester Abstossung, d.h. Schwellung und Rötung), andere die traditionelle medikamentöse Therapie mit Tacrolimus und Dexamethason (als Goldstandard). Eine Kontrollgruppe erhielt keine zusätzliche Behandlung. Im Folgenden werden die Hauptergebnisse aus unserer experimentellen Studie beschrieben.
Verlangsamung der Abstossung
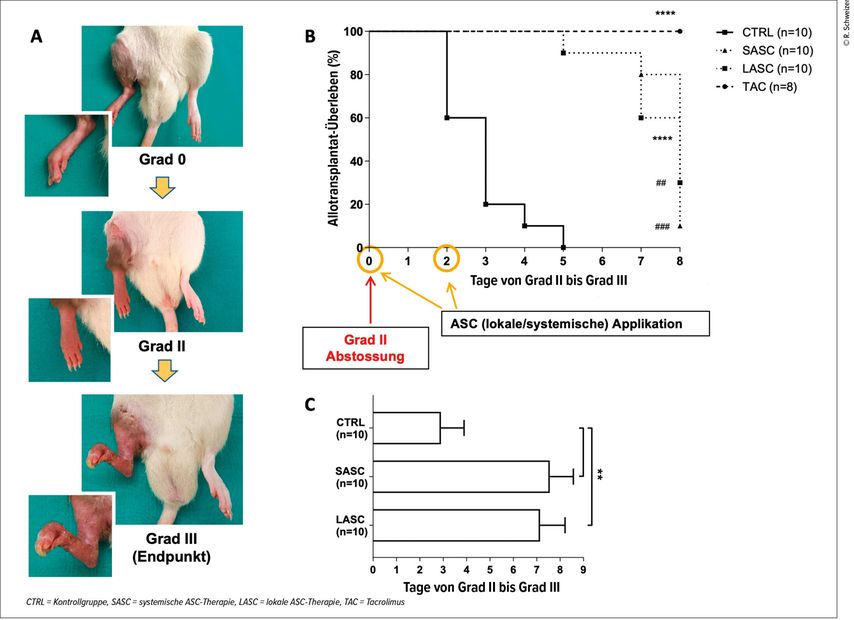
Die Stammzellen konnten die bereits initiierte Transplantatabstossung nicht vollständig stoppen, aber sie schwächten und verzögerten sie signifikant. Tiere, die mit ASC behandelt wurden, benötigten 7–8 Tage, um von einer mässigen (Grad II) zu einer schweren Abstossung (Grad III) zu gelangen, verglichen mit nur 2–3 Tagen in der unbehandelten Kontrollgruppe. Dennoch schnitt die Kontrollgruppe mit medikamentöser Standardtherapie erwartungsgemäss deutlich besser ab, da diese Therapie die Abstossung vollständig unterdrückte (Abb.3).
Abb. 3: Verschiedene Stadien der Abstossung: Grad 0 = normales postoperatives Ergebnis, Grad II = manifeste mässige Abstossung, Grad III = schwere Abstossung mit Epidermolyse und Nekrosen am Transplantat (Endpunkt) (A). Die Grafiken zeigen eine signifikante Verlangsamung der Abstossung unter ASC-Therapie (LASC/SASC) im Vergleich zu den Kontrollen ohne Therapie (CTRL), jedoch keine Remission (wie hingegen in der medikamentösen Gruppe TAC) (B–C) (nach Schweizer R et al. 2025)12
Modulation des Immunsystems
Während einer Abstossung setzt der Körper entzündungsfördernde Moleküle wie z.B. IL-1, IL-6 und IL-18 frei, die den Angriff des Immunsystems auf das Transplantat initiieren und verstärken können. Sowohl die lokale als auch die systemische ASC-Therapie reduzierten signifikant die systemische Ausschüttung einiger dieser proinflammatorischen Moleküle fast auf Normalwerte, während sie gleichzeitig die Konzentration von entzündungshemmenden Molekülen wie IL-4 und TSG-6 erhöhten.
Schutz der Blutgefässe des Transplantates während der akuten Abstossung
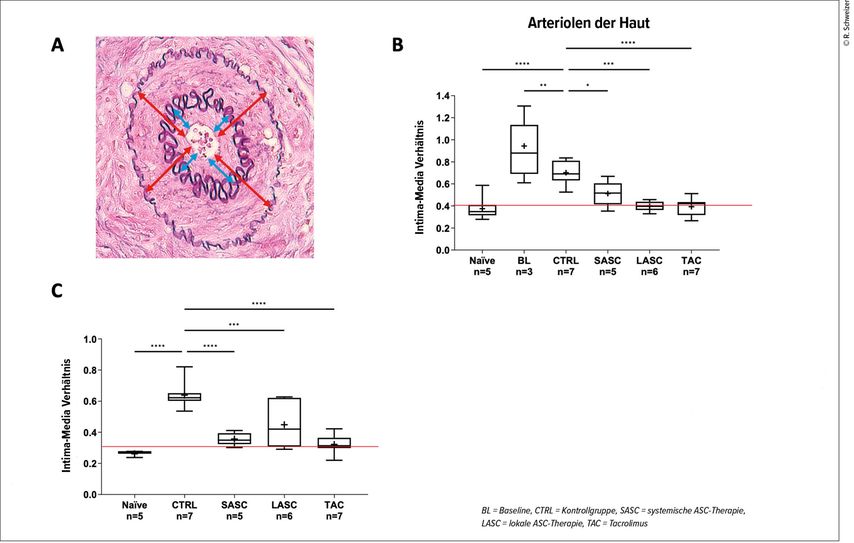
Eine der langfristigen Gefahren der chronischen Abstossung ist die Schädigung der Blutgefässe, die durch eine Intimaproliferation wegen mangelnder Durchblutung langsam, aber stetig bis zum Transplantatversagen okkludieren.13,14 Weniger bekannt bzw. untersucht waren bislang die Gefässveränderungen und -schäden während der akuten Abstossung.8 In unserer Studie zeigten wir, dass bereits während der ersten akuten Abstossung eine intimale Proliferation der Gefässe auftritt. Im frühen Stadium der Abstossung war diese sogar signifikant ausgeprägter als am Endpunkt. Dies ist vermutlich auf die entzündlich veränderte, aber zunächst noch intakte Gefässwand zurückzuführen (Endothelialitis), die im Verlauf der fortschreitenden Abstossung schliesslich geschädigt wird. Die Tiere zeigten nach ASC-Therapie am Endpunkt eine deutlich verringerte intimale Proliferation in Arteriolen von Haut und Muskelgewebe im Vergleich zu den Kontrollen ohne Therapie, ähnlich wie bei der medikamentösen Therapie. Dieser Schutz war jedoch in kleineren Gefässen – wie denen der Haut und Muskeln – deutlicher als in grösseren Arterien (Abb.4).
Abb. 4: Die Gefässwanddicke wurde in den verschiedenen Geweben des Transplantates gemessen und ein Intima-Media-Verhältnis als Indikator für die intimale Proliferation errechnet (A). Sowohl in Arteriolen der Haut (B) als auch der Muskeln (C) konnte eine signifikant reduzierte intimale Proliferation in den ASC-Gruppen gezeigt werden (nach Schweizer R et al. 2025)12
Gezielte Wirkung
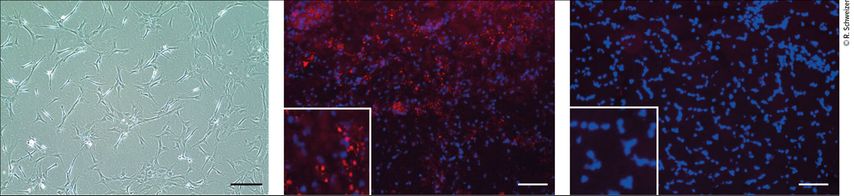
Verschiedene Studien haben bereits gezeigt, dass systemisch verabreichte mesenchymale Stammzellen entweder direkt zum «Ort des Geschehens» migrieren und dort aktiv wirken können oder indirekt über die Freisetzung von Botenstoffen wie Zytokinen und Chemokinen das Immunsystem modulieren können.4,15 In unserer Studie konnten wir am Endpunkt PKH-26-markierte Zellen (Abb.5, rot) im Gewebe des Grafts nachweisen – auch bei den systemisch mit ASC behandelten Tieren. Dies belegt ein erfolgreiches «Homing» der Zellen an den Ort, an dem sie benötigt werden.
Abb. 5: Kultivierte mesenchymale Stammzellen aus dem Fett (ASC) von Spenderratten (links), PKH-26-markierte ASC (rot) in Transplantatbiopsien der mit ASC behandelten Ratten (Mitte) und Kontrollen ohne Behandlung (rechts) (nach Schweizer R et al. 2025)12
Was bedeutet das für Transplantationspatienten?
Unsere Studie zeigt, dass aus Fett gewonnene Stammzellen – nicht nur in VCA – in Zukunft eine wichtige Rolle bei der Behandlung von Transplantatabstossungen spielen können. Auch wenn sie derzeit die traditionellen Medikamente nicht zu ersetzen vermögen, zeigen sie grosses Potenzial als ergänzende Therapie. Durch die Kombination von Stammzellen mit niedrigeren Dosen von Immunsuppressiva profitieren Patienten gesundheitlich aufgrund geringerer Nebenwirkungen. Gleichzeitig wird das transplantierte Gewebe, insbesondere die Gefässe, während Episoden der akuten Abstossung geschützt.
Schlussfolgerung
Trotz der vielversprechenden Ergebnisse gibt es Luft nach oben. In dieser «Proof of concept»-Studie konnte die Stammzellverabreichung allein die mittelgradige Abstossung nicht vollständig rückgängig machen. Es sollte untersucht werden, inwiefern höhere Dosen, häufigere Verabreichungen oder die Kombination von Stammzellen mit anderen Therapien ihre Wirksamkeit verbessern können. Darüber hinaus könnte die Vorbehandlung der Zellen, um ihre Widerstandsfähigkeit in entzündlichen Umgebungen zu erhöhen (sogenanntes «preconditioning»), eine vielversprechende Strategie darstellen. Ein weiterer Ansatz wäre die Kombination verschiedener Zelltypen, beispielsweise mit regulatorischen T-Zellen, die Immunreaktionen gezielt unterdrücken. Solche synergistischen Ansätze könnten sowohl bei akuten als auch bei chronischen Transplantatabstossungen zu deutlich verbesserten Ergebnissen führen.
Literatur:
1 Longo B et al.: 18 years of face transplantation: adverse outcomes and challenges. J Plast Reconstr Aesthet Surg 2023; 87: 187-99 2 Kollar B et al.: Innovations in reconstructive microsurgery: reconstructive transplantation. J Plast Reconstr Aesthet Surg 2018; 118: 800-6 3 Parekkadan B, Milwid JM: Mesenchymal stem cells as therapeutics. Annu rev biomedical eng 2010; 12: 87-117 4 Yagi H et al.: Mesenchymal stem cells: mechanisms of immunomodulation and homing. Cell transplant 2010; 19: 667-79 5 Schweizer R et al.: Evaluation of porcine versus human mesenchymal stromal cells from three distinct donor locations for cytotherapy. Front Immunol 2020; 11: 826 6 Schweizer R et al.: Premise and promise of mesenchymal stem cell-based therapies in clinical vascularized composite allotransplantation. Current opinion in organ transplantation 2015; 20: 608-14 7 Schweizer R et al.: Adipose-derived stromal cell therapy combined with a short course nonmyeloablative conditioning promotes long-term graft tolerance in vascularized composite allotransplantation. Am J Transplant 2020; 20(5): 1272-84 8 Plock JA et al.: The influence of timing and frequency of adipose-derived mesenchymal stem cell therapy on immunomodulation outcomes after vascularized composite allotransplantation. Transplant 2017; 101: e1-11 9 Plock JA et al.: Adipose- and bone marrow-derived mesenchymal stem cells prolong graft survival in vascularized composite allotransplantation. Transplant 2015; 99: 1765-73 10 Kuo YR et al.: Mesenchymal stem cells as immunomodulators in a vascularized composite allotransplantation. Clin dev immunol 2012; 854846 11 Kuo YR et al.: Modulation of immune response and T-cell regulation by donor adipose-derived stem cells in a rodent hind-limb allotransplant model. Plast Reconstr Surg 2011; 128: 661e-72 12 Schweizer R et al.: Donor adipose-derived stromal cells are vasoprotectant but unable to revert acute rejection in rodent vascularized composite allotransplants. Front Immunol 2025; 16:1581599 13 Pober JS et al.: Cardiac allograft vasculopathy: current review and future research directions. Cardiovasc Res 2021; 117: 2624-38 14 Kollar B et al.: The significance of vascular alterations in acute and chronic rejection for vascularized composite allotransplantation. J vasc res 2019; 56: 163-80 15 Karp JM, Teo GS: Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell 2009; 4: 206-16
Das könnte Sie auch interessieren:
Unilaterales nävoides Teleangiektasie-Syndrom
Der folgende Fallbericht beleuchtet das seltene unilaterale nävoide Teleangiektasie-Syndrom im Kontext hormoneller Veränderungen während der Schwangerschaft. Anhand einer Patientin ...
Gezielte Diagnostik, bessere Therapie: gründliche Anamnese als Grundlage
Was rät man Eltern von Neugeborenen, wie sie eine atopische Dermatitis (AD) bei ihrem Baby verhindern können? Wann macht eine komponentenbasierte Allergiediagnostik Sinn? Wie lassen sich ...
Die menschliche Haut in der modernen Kunst
Dr. Ralph Ubl, Professor für neuere Kunstgeschichte an der Universität Basel, stellte sich der schwierigen Herausforderung, einem Raum voller erwartungsvoller Dermatologen das Organ Haut ...