CAR, TRUCK et la nouvelle génération de thérapies par lymphocytes T
Auteur·es:
Dre Astrid Holzinger
Dr Markus Barden
Prof. Dr Hinrich Abken
Leibniz-Institut für Immuntherapie,
Abteilung Gen-Immuntherapie, Regensburg
Correspondance:
E-mail: hinrich.abken@ukr.de
Les lymphocytes T à récepteur antigénique chimérique (CAR, chimeric antigen receptor) sont des cellules immunitaires reprogrammées de manière synthétique («living drugs») avec des fonctions effectrices pour le traitement ciblé du cancer, des maladies auto-immunes et des inflammations chroniques. Alors que les cellules CAR-T sont actuellement utilisées avec succès dans le traitement des néoplasies hématologiques, la prochaine génération de CAR utilise en outre des cytokines et leurs signaux pour renforcer la réponse des lymphocytes T contre les tumeurs solides et recruter d’autres cellules immunitaires.
Keypoints
-
La thérapie par cellules CAR-T est utilisée dans le traitement des leucémies et des lymphomes.
-
L’environnement immunosuppressif des tumeurs solides supprime les cellules CAR-T, ce qui a empêché jusqu’à présent des succès thérapeutiques majeurs.
-
L’efficacité des cellules CAR-T contre les tumeurs solides doit être augmentée par l’intégration d’un signal de cytokine.
Où en sommes-nous dans le domaine de la thérapie par cellules CAR-T?
La thérapie par cellules CAR-T repose sur le concept que les propres lymphocytes T des patient·es sont dirigés spécifiquement contre des structures cibles définies sur les cellules tumorales afin d’éliminer les tumeurs avec succès. L’activation des fonctions effectrices médiée par CAR après la liaison du lymphocyte T aux structures cibles joue ici un rôle décisif. Les cellules CAR-T sont utilisées avec succès dans le traitement des cancers hématologiques, avec parfois des rémissions de longue durée et la persistance des cellules CAR-T pendant plus de dix ans.1
Six produits commerciaux à base de cellules CAR-T sont actuellement autorisés dans l’UE,2 certains sont déjà utilisés dans le traitement de deuxième ligne.3 L’European Society for Blood and Bone Marrow Transplantation (EBMT) a enregistré 10000 patient·es traité·es par cellules CAR-T en Europe,4 et le nombre total de patient·es traité·es par cellules CAR-T dans le monde est plusieurs fois supérieur.
Les cellules CAR-T sont classées par l’Agence européenne des médicaments (EMA) comme médicaments de thérapie innovante («advanced therapy medicinal products», ATMP) et, en tant que «living drugs», ne suivent pas les concepts classiques de pharmacodynamie et de pharmacocinétique.5 Contrairement aux médicaments classiques, les cellules CAR-T ne représentent pas une substance chimiquement définie, mais une population de cellules hétérogènes ayant la capacité de migrer dans les tissus et de proliférer, de libérer des substances immunomodulatrices et d’exercer des fonctions effectrices après liaison à la structure cible et activation médiée par CAR.
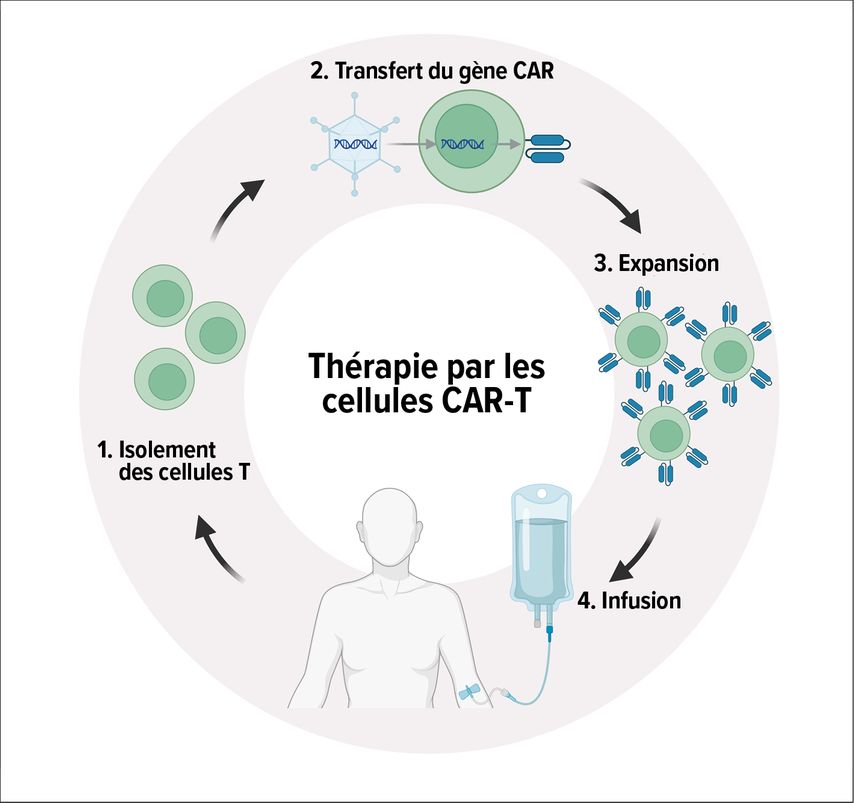
La production de cellules CAR-T s’effectue ex vivo par «ingénierie génétique»; l’ARN ou l’ADN codant pour le CAR est transféré dans les lymphocytes T à l’aide de vecteurs viraux ou non viraux et le CAR est exprimé à la surface des lymphocytes T. Les cellules CAR-T produites individuellement sont amplifiées et réinjectées aux patient·es après une lymphodéplétion («préconditionnement») (Fig.1). Des développements récents visent à fabriquer des produits allogéniques à base de cellules CAR-T pouvant être produits à l’avance pour un grand nombre de patient·es (cellules CAR-T «off-the-shelf»).
Fig. 1: Production des cellules CAR-T:les cellules T du patient sont prélevées par leucaphérèse, génétiquement modifiées ex vivo pour exprimer le CAR, puis amplifiées de manière à ce qu’une quantité suffisante de cellules CAR-T soient disponibles pour être réinjectées au patient
Les CAR sont des récepteurs transmembranaires synthétiques et modulaires qui combinent des composants d’anticorps en tant que structure de liaison et du récepteur des lymphocytes T (TCR, T cell receptor) physiologique en tant que structure de signalisation dans un «récepteur antigénique chimérique».
Dans la première génération de CAR, un anticorps à chaîne unique («single chain fragment of variable regions», scFv) est lié comme domaine de liaison à la chaîne CD3ζ intracellulaire du TCR comme domaine de signalisation. La reconnaissance médiée par anticorps, indépendante du complexe majeur d’histocompatibilité (CMH), est un avantage des CAR, car de nombreuses cellules tumorales échappent à la reconnaissance des lymphocytes T en raison de la perte de la présentation antigénique médiée par le CMH.
La deuxième génération de CAR comprend, outre la chaîne CD3ζ, un domaine de signalisation de costimulation, généralement CD28 ou 4-1BB. La costimulation est essentielle au maintien de la réponse des lymphocytes T, améliore la persistance des cellules CAR-T et est essentielle pour obtenir des rémissions tumorales durables. Il a été démontré que la costimulation de CD28 affecte le métabolisme du glucose et convertit les lymphocytes T en un phénotype «mémoire effectrice», tandis que la costimulation de 4-1BB stimule la chaîne respiratoire mitochondriale et induit un phénotype «mémoire centrale».6 Les produits de cellules CAR-T actuellement approuvés sont des CAR de deuxième génération. La troisième génération de CAR comprend deux domaines de costimulation.
Malgré tout le succès rencontré en hémato-oncologie, la situation est plus complexe dans le traitement des tumeurs solides, car les cellules tumorales sont intégrées dans un ensemble compact de cellules («stroma») aux propriétés immunosuppressives qui suppriment activement l’attaque par les cellules CAR-T. Cette situation exige une conception de CAR améliorée et une pharmacologie optimisée pour que la thérapie par cellules CAR-T des tumeurs solides soit un succès.7
Actuellement, plusieurs déficits des cellules CAR-T sont discutés, entre autres la durée trop courte de l’activation des lymphocytes T. Les lymphocytes T régulent physiologiquement leur activation dans le cadre d’un processus autolimité par l’interaction de CD30 avec le ligand de CD30 (CD30L), ce qui empêche une réponse immunitaire excessive. Pour obtenir une activation soutenue des cellules CAR-T, l’interaction CD30/CD30L peut être bloquée, par exemple en ajoutant un domaine bloquant CD30 dans le CAR. De telles cellules CAR-T montrent une activité prolongée contre les tumeurs solides dans des modèles précliniques.8
Les cytokines: des outils pour améliorer le traitement des tumeurssolides
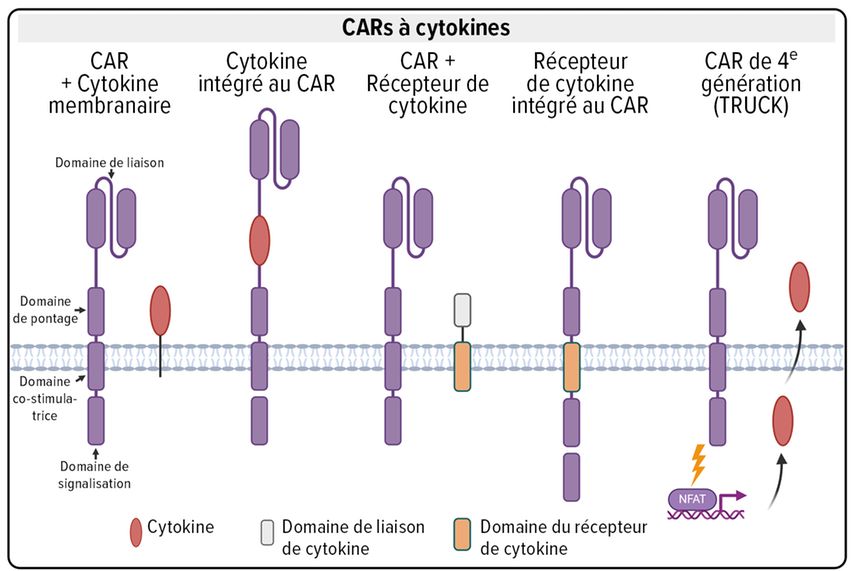
Certes, le CAR de deuxième génération fournit le signal primaire et de costimulation, mais selon le «paradigme des trois signaux» de l’activation des lymphocytes T, il manque le signal de la cytokine comme troisième signal. À l’aide de la biologie structurelle et des possibilités de l’ingénierie moléculaire, différents concepts ont été développés pour intégrer la cytokine dans le CAR (Fig. 2). En principe, il est possible d’ancrer la cytokine dans la membrane cellulaire de la cellule CAR-T à l’aide d’un pont flexible, de sorte que la cytokine puisse se lier au récepteur correspondant. De plus, l’IL-18 ancrée peut être liée, par exemple, au récepteur Toll-like intracellulaire 4 (TLR4) et au CD40 constitutivement actif dans une protéine transmembranaire hybride qui médiatise l’activation de plusieurs voies de signalisation et augmente ainsi les fonctions effectrices de la cellule CAR-T.9
Fig. 2: Aperçu des cytokines-CAR: les cytokines-CAR reposent sur le concept d’un CAR de deuxième génération renforcé par un signal de cytokine supplémentaire. Structurellement, il existe plusieurs possibilités: l’ancrage de la cytokine dans la membrane cellulaire ou dans la partie extracellulaire du CAR, l’ancrage du domaine de signalisation d’un récepteur de cytokine dans la membrane cellulaire ou dans la partie intracellulaire du CAR, ainsi que la libération induite de la cytokine après l’activation du CAR (TRUCK)
Les cytokines peuvent aussi être intégrées dans la partie extracellulaire du CAR afin de limiter en grande partie son activité à la cellule CAR-T. Un exemple est l’intégration de l’IL-12 dans le CAR qui, en plus de la spécificité tumorale, induit une fonctionnalité similaire à celle de la cellule NK dans le lymphocyte T grâce au domaine de liaison.10
Un autre concept est basé sur un récepteur de cytokines hybride, dans lequel le domaine de liaison extracellulaire et le domaine de signalisation intracellulaire proviennent de récepteurs différents. Dans un récepteur «switch», la liaison d’une cytokine inhibitrice peut induire une voie de signalisation activatrice ou inversement.11 Alternativement, le domaine récepteur de cytokines intracellulaire peut être intégré dans la partie intracellulaire du CAR. Il en résulte la difficulté à positionner le domaine de signalisation de manière à ce que le recrutement des différentes molécules de signalisation soit encore garanti dans la construction hybride.
Il est possible que les cellules CAR-T seules ne suffisent pas à éliminer complètement les tumeurs solides et qu’il faille l’aide d’autres cellules immunitaires pour reconnaître les cellules tumorales qui sont devenues invisibles pour les cellules CAR-T en raison de la perte d’antigènes. La quatrième génération de CAR, appelée TRUCK («T cells redirected for unrestricted cytokine killing»), peut activer d’autres cellules immunitaires par la libération inductible d’une cytokine ou même d’une autre protéine pharmaceutiquement active dans le tissu cible.12
La production de la cytokine transgénique est liée à un facteur de transcription qui est mis à disposition dans le lymphocyte T après l’activation de CAR et donc dans la tumeur; dès que la cellule CAR-T quitte le tissu tumoral, l’activation de CAR et donc la production de la cytokine prennent fin. La plupart des cytokines exercent des fonctions pléiotropes et agissent sur plusieurs cellules, ce qui augmente le risque d’effets secondaires en cas d’administration systémique et limite donc la dose. Grâce à la libération induite par CAR, les TRUCK évitent d’éventuels effets secondaires systémiques. Un CAR spécifique de GD2 avec libération inductible d’IL-18 pour le traitement des tumeurs solides GD2-positives est actuellement en phase d’essai clinique (EU CT 2022-501725-21-00).13
Dans l’ensemble, les différentes constructions d’une cytokine-CAR permettent une action locale des cytokines et une régulation fine de la réponse des cellules CAR-T. De plus, la réponse antitumorale endogène peut être modulée durablement par le signal de la cytokine afin d’augmenter l’efficacité des cellules CAR-T et, en fin de compte, de permettre le traitement des tumeurs solides.
Littérature:
1 Melenhorst JJ et al.: Decade-long leukaemia remissions with persistence of CD4+ CAR T cells. Nature 2022; 602(7897): 503-9 2 Bellino S et al.: Cell-based medicinal products approved in the European Union: current evidence and perspectives. Front Pharmacol 2023; 14: 1200808 3 Westin J, Sehn LH: CAR T cells as a second-line therapy for large B-cell lymphoma: a paradigm shift? Blood 2022; 139(18): 2737-46 4 EBMT: The EBMT reaches major milestone: 10,000 CAR-T treated patients registered in its registry. Online unter https://www.ebmt.org/ebmt/news/ebmt-reaches-major-milestone-10000-car-t-treated-patients-registered-its-registry 5 Holzinger A, Abken H: Treatment with living drugs: pharmaceutical aspects of CAR T cells. Pharmacology 2022; 107(9-10): 446-63 6 Kawalekar OU et al.: Distinct signaling of coreceptors regulates specific metabolism pathways and impacts memory development in CAR T cells. Immunity 2016; 44(2): 380-90 7 Rojas-Quintero J et al.: Car T cells in solid tumors: overcoming obstacles. Int J Mol Sci 2024; 25(8): 4170 8 Hombach AA et al.: Blocking CD30 on T cells by a dual specific CAR for CD30 and colon cancer antigens improves the CAR T cell response against CD30− tumors. Mol Ther 2019; 27: 1825-35 9 Blokon-Kogan D et al.: Membrane anchored IL-18 linked to constitutively active TLR4 and CD40 improves human T cell antitumor capacities for adoptive cell therapy. J Immunotherap Cancer 2022; 10: e001544 10 Hombach A et al.: IL12 integrated into the CAR exodomain converts CD8+ T cells to poly-functional NK-like cells with superior killing of antigen-loss tumors. Mol Ther 2022; 30(2): 593-605 11 Mohammed S et al.: Improving chimeric antigen receptor-modified T cell function by reversing the immunosuppressive tumor microenvironment of pancreatic cancer. Mol Ther 2017; 25(1): 249-58 12 Chmielewski M et al.: Of CARs and TRUCKs: chimeric antigen receptor (CAR) T cells engineered with an inducible cytokine to modulate the tumor stroma. Immunol Rev 2014; 257(1): 83-90 13 Fischer-Riepe L et al.: Preclinical development of CAR T cells with antigen-inducible IL18 enforcement to treat GD2-positive solid cancers. Clin Cancer Res 2024; 30(16): 3564-577
Das könnte Sie auch interessieren:
La réadaptation oncologique ambulatoire en Suisse: où en est-on et quels sont les enjeux futurs?
La réadaptation oncologique ambulatoire représente une étape essentielle dans le parcours de soin. Outre redonner un élan aux personnes touchées par la maladie, elle apporte des ...
Smarter medicine – une contribution à la transition écologique de la médecine
Lors du congrès de printemps de la SSMIG, des expert·es des Hôpitaux universitaires de Genève (HUG) ont présenté les projets «Choosing greenly» et «smarter medicine soins intensifs», qui ...
Maladies respiratoires chroniqueset changement climatique
La hausse globale des températures et l’augmentation des vagues de chaleur ont un impact négatif sur la qualité de l’air, en particulier dans les villes. Véritables portes d’entrée, les ...