Mise à jour concernant les traitements biologiques en cas d’asthme
Compte-rendu:
Mag. Andrea Fallent
Rédactrice
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Le recours à des anticorps monoclonaux ciblés est un élément important de l’escalade thérapeutique en cas d’asthme sévère. Mais ils ne «marchent» pas chez tous les patients. Au cours de son exposé, le Prof. Guy Brussele nous a donné un aperçu de l’immunologie, des phénotypes ainsi que des cibles des biologiques dans l’asthme de type 2 en se basant sur les avancées issues de publications récentes.
Le Prof. Guy Brussele de l’Hôpital universitaire de Gand en Belgique a abordé directement son exposé avec les deux questions figurant dans le titre de celui-ci: «Avons-nous besoin d’autant de biologiques en cas d’asthme?» La réponse est: «Oui, parce que l’asthme est très hétérogène.» Et: «Qu’est-ce qui nous manque?» Réponse: «Des anticorps ciblés en particulier pour l’asthme de type 2 low.»
G. Brussele a décrit les mécanismes immunologiques des anticorps (Ac) monoclonaux disponibles à ce jour et leur corrélation avec les différents phénotypes inflammatoires ainsi que les différentes classes d’Ac destinées au traitement de l’asthme sévère.
Définition de l’asthme sévère
On parle d’asthme sévère lorsque les symptômes persistent ou que des exacerbations toujours plus sévères surviennent malgré un traitement optimal par inhalation selon le palier 4 des directives de GINA et une bonne observance du patient. L’asthme sévère est un syndrome hétérogène présentant plusieurs phénotypes cliniques, qui se différencient surtout par l’âge de survenue de l’asthme («early onset» ou «adult onset»), la présence d’allergies et d’autres maladies concomitantes, la fréquence des exacerbations, la réponse au traitement et le pronostic. L’asthme sévère est aussi considéré comme hétérogène sur le plan biologique – avec différents types d’inflammation au niveau des voies aériennes, définis par la prédominance des granulocytes dans les expectorations ou dans les échantillons de biopsie bronchique, et fréquemment identifiés avec des biomarqueurs dans le sang ou l’air expiré.1
Asthme de type 2 high et de type 2 low
L’inflammation éosinophilique, caractérisée par un nombre accru d’éosinophiles dans le sang et/ou des taux élevés de FeNO est le signe distinctif de l’asthme de type 2 (T2) high. L’inflammation de type 2 est médiée par des cellules «T helper» de type2 (Th2) et des «innate lymphoid cells» (ILC2). Les cellules produisent les cytokines clés, l’IL-4, l’IL-5 ainsi que l’IL-13, qui sont étroitement liées à la pathogénèse de l’hyperréactivité et de l’obstruction bronchiques. En pratique, il est donc important de distinguer l’asthme «early onset» de l’asthme «adult onset» ainsi que l’asthme T2 high de l’asthme T2 low.
Les Ac monoclonaux disponibles à ce jour font preuve d’une grande efficacité pour diminuer les exacerbations et les symptômes en cas d’asthme T2 high. «L’exception est le tézépélumab, un Ac anti-TSLP qui a également montré une certaine efficacité en cas d’asthme T2 low», a expliqué G. Brussele. Le mécanisme d’action spécifique de la préparation exige donc une phénotypisation basée sur les biomarqueurs, avant le début du traitement.
L’asthme de type 2 low constitue un phénotype important et fréquent, qui est sous-tendu par différents mécanismes pathobiologiques encore trop peu étudiés; il englobe l’asthme neutrophile et l’asthme paucigranulocytaire. Les patients concernés ne répondent que de manière insuffisante aux corticostéroïdes (inhalés ou oraux).
Traitement par anticorps pour l’asthme de T2 high
En traitement complémentaire en cas d’asthme sévère non contrôlé, nous disposons actuellement de six Ac. L’omalizumab se positionne comme l’unique Ac dirigé contre l’immunglobuline E (anti-IgE) et par conséquent, il est instauré pour le traitement de l’asthme sévère allergique. Les autres font office de traitement additionnel en cas d’asthme éosinophilique sévère: le mépolizumab, le reslizumab, le benralizumab et le dupilumab bloquent les interleukines et leurs récepteurs, le tézépélumab désactive la cytokine épithéliale/alarmine TSLP. G.Brusselle a exposé une sélection des données actuelles concernant les cibles des Ac, divisés en trois classes de principes actifs.
Anticorps anti-IL-4 et anti-IL-5
Les Ac de ce groupe mènent tous à une réduction du nombre d’éosinophiles et par conséquent à des améliorations cliniques patentes chez les patients présentant un asthme éosinophilique sévère. Trois biologiques ciblent la voie de signalisation IL-5 éosinophile: le mépolizumab et le reslizumab, qui sont dirigés contre l’IL-5 elle-même, et le benralizumab, qui bloque le récepteur de l’IL-5. Le dupilumab se lie au récepteur de l’IL-4. G. Brussele s’est concentré sur les résultats récents d’études menées avec le mépolizumab et le dupilumab.
Mépolizumab
Dans l’étude MENSA en 2014, l’Ac anti-IL-5 mépolizumab a pu réduire de manière significative le taux d’exacerbation en cas d’asthme éosinophilique sévère et a permis une amélioration importante de la qualité de vie.2
L’étude COMET, dont les résultats ont été présentés au congrès ERS, a étudié les questions clés suivantes: «Combien de temps faut-il poursuivre le traitement par mépolizumab?» et «Quelles sont les conséquences des pauses thérapeutiques».3 Au cours de cette étude, des patients ayant été traités pendant au moins trois ans par mépolizumab, ont été randomisés en deux groupes: les uns continuaient de recevoir du mépolizumab SC toutes les quatre semaines, tandis que les autres recevaient un placebo. Le critère primaire d’évaluation de l’étude était la première exacerbation cliniquement significative. Le résultat parle de lui-même: le groupe placebo a montré des exacerbations significativement plus précoces, une aggravation du contrôle de l’asthme et un nombre d’éosinophiles plus élevé.3
Dupilumab
Le dupilumab, l’Ac monoclonal de l’IL-4R, inhibe la voie de signalisation de l’IL-4 et de l’IL-13 et a d’abord été autorisé dans le cadre de la dermatite atopique modérée à sévère. Dans l’étude de Castro et al. en 2018, des patients présentant un asthme modéré à sévère non contrôlé ont montré, en cas d’utilisation de dupilumab, une réduction de 55% des taux d’exacerbations, par rapport au placebo. La différence avec le groupe placebo n’était toutefois pas significative chez les patients dont le nombre d’éosinophiles sanguins était bas (<150/μl) et dont la FeNO était inférieure à 25ppb, donc chez les patients présentant un asthme de type 2 low.4
Bacharier et al. ont étudié l’efficacité du dupilumab chez 408 enfants âgés de six à onze ans, présentant un asthme de type 2 modéré à sévère non contrôlé, sur une période de 52 semaines. Par rapport au placebo, le dupilumab a réduit le taux d’exacerbations sévères de manière significative et a induit une amélioration de la fonction pulmonaire et du contrôle de l’asthme ainsi qu’une réduction des glucocorticoïdes systémiques. La fréquence des effets indésirables pendant la durée de l’étude était similaire pour tous les groupes de l’étude. Chez un sujet, le traitement a dû être interrompu en raison d’une éosinophilie cliniquement symptomatique.5
Inhibition de l’axe IL-23/IL-17
Bien que les Ac inhibant les IgE, l’IL-4, l’IL13 ou l’IL-5 constituent déjà un arsenal de puissants biologiques disponibles pour traiter des patients souffrant d’un asthme modéré à sévère de type 2, un besoin réel de nouveaux principes actifs persiste.
L’IL-23 est associée à une inflammation des voies respiratoires, médiée par les cellules Th2 et Th17. Chez les patients asthmatiques, des taux sériques élevés d’IL-23 sont associés à une plus grande altération de la fonction pulmonaire. On ignore si le fait de cibler l’IL-23 dans le traitement améliore le contrôle de l’asthme et réduit l’inflammation des voies respiratoires.
Risankizumab
Le risankizumab, l’Ac monoclonal anti-IL-23p19, n’a apporté aucun bénéfice aux patients présentant un asthme sévère dans une étude de phase IIa, contrairement à l’efficacité clinique marquée en cas de psoriasis et de maladie de Crohn. Il n’est pas parvenu à raccourcir l’intervalle jusqu’à une première aggravation clinique. En lieu et place, l’asthme s’est aggravé sous risankizumab significativement plus rapidement et plus fréquemment que sous le placebo.6 Bien que l’IL-23 soit décrite comme jouant un rôle aussi bien dans l’inflammation à éosinophiles qu’à neutrophiles, le traitement par risankizumab n’avait pas d’effet sur le nombre de cellules présentes dans les expectorations. En revanche, le taux sérique de β-défensine, un peptide antimicrobien important, avait tendance à diminuer. En outre, des indices sont apparus en faveur d’une baisse de l’immunité des voies aériennes médiée par les cellules T cytotoxiques et T killer naturels.6
Anticorps anti-alarmine
Il existe un autre groupe de biologiques, les Ac anti-alarmine, qui sont dirigés contre l’alarmine épithéliale TSLP (lymphopoïétine stromale thymique) ou contre l’IL-33 ou le récepteur de l’IL-33. La TSLP est libérée par les cellules épithéliales en réponse à des stimuli pro-inflammatoires et est liée à la fois à l’expression de la cytokine T2 et à la sévérité de la maladie dans le cas de l’asthme. Dans la cascade inflammatoire, l’alarmine se situe avant l’IL-5, l’IL-4 et l’IL-13; c’est la raison pour laquelle le blocage de la TSLP possède en théorie un potentiel d’effets plus vastes que ceux des biologiques discutés jusqu’ici.
Tézépélumab
L’année dernière, les résultats de l’étude NAVIGATOR de phase 3, menée avec le tézépélumab, l’Ac monoclonal anti-TSLP, chez des adultes présentant un asthme sévère non contrôlé ont été publiés. Parmi les critères d’inclusion, on comptait deux exacerbations sévères ou plus dans les douze mois précédents et un traitement par au moins un corticostéroïde inhalé (CSI) à dose modérée ainsi qu’un traitement de fond supplémentaire.7
Dans l’ensemble, le traitement par tézépélumab a induit une amélioration très rapide de la fonction pulmonaire qui s’est maintenue sur toute la durée de l’étude de 52 semaines, ainsi qu’une diminution du taux d’exacerbation de 56% par rapport au placebo. Le tézépélumab a réduit le nombre d’éosinophiles et le taux de FeNO, a diminué de manière continue les IgE totaux et a freiné l’hyperréactivité. «Il n’est pas surprenant d’observer que les réductions ont été les plus importantes chez les sujets présentant les signaux T2 les plus puissants, un nombre d’éosinophiles dans le sang supérieur et des taux de FeNO plus importants. Chez les sujets présentant une éosinophilie sanguine <150cellules/μl, l’avantage était encore considérable en présence d’une FeNO ≥25ppb», a relevé G. Brusselle. Le nombre et le type d’événements indésirables étaient comparables dans les deux groupes.7
Algorithme pour le traitement de l’asthme sévère non contrôlé
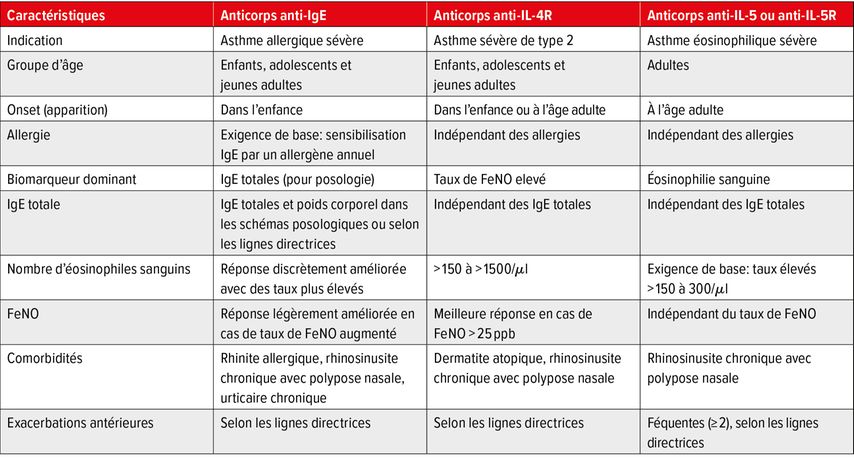
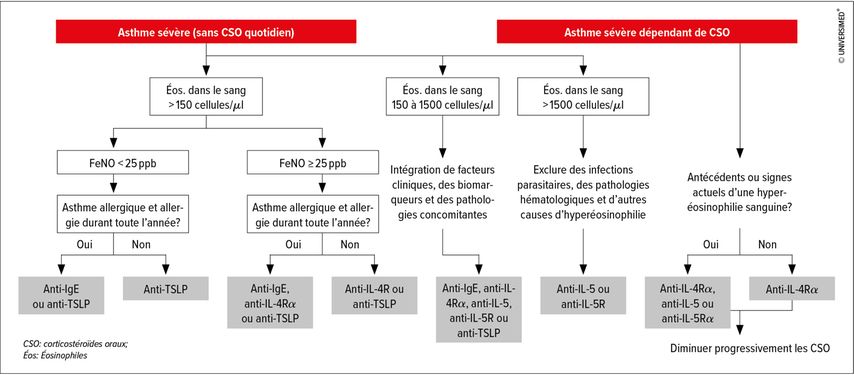
En l’absence de données provenant d’études randomisées contrôlées permettant de comparer l’efficacité et la sécurité à long terme des Ac monoclonaux autorisés, il nous manque de solides connaissances pour la prise de décision clinique. Avant d’instaurer un traitement par biologiques dans le cas d’un asthme sévère, il convient de rassembler certaines données: nombre d’exacerbations au cours de l’année écoulée, prise de glucocorticoïdes oraux, biomarqueurs (éosinophiles, FeNO, IgE sériques), VEMS, contrôle de l’asthme, pathologies concomitantes et qualité de vie (Tab. 1). Finalement, G. Brusselle a présenté un algorithme destiné au traitement de l’asthme sévère non contrôlé tiré de sa publication actuelle (Fig. 1).
Tab. 1: Critères de sélection pour le traitement de l’asthme sévère par des anticorps monoclonaux sur la base des caractéristiques du patient (modifié d’après Brussele et Koppelman)1
Fig. 1: Algorithme destiné au traitement de l’asthme sévère non contrôlé (modifié d’après Brussele et Koppelman)1
Source:
«Biologics in asthma: do we need so many and who do we miss?» Exposé du Prof. Guy Brussele, Gand, dans le cadre du congrès de l’ERS (Pre-Congress Content), 22 août 2022
Littérature:
1 Brussele G, Koppelman G: N Engl J Med 2022; 386: 157-71 2 Ortega HG et al.: N Engl J Med 2014; 371: 1198-207 3 Moore WC et al: Eur Respir J 2022; 59: 2100396 4 Castro et al.: N Engl J Med 2018; 378: 2486-96 5 Bacharier LB et al.: N Engl J Med 2021; 385: 2230-40 6 Brightling CE et al.: N Engl J Med 2021; 385: 669-79 7 Menzies-Gow A et al.: N Engl J Med 2021; 384: 1800-9
Das könnte Sie auch interessieren:
Les conjugués anticorps-médicament ont le vent en poupe
Actuellement, de nombreux conjugués anticorps-médicament sont en cours d’évaluation dans le cancer du poumon. Qu’ils soient utilisés seuls ou en combinaison avec d’autres thérapies ...
Effets sur la santé ainsi que risques liés au travail posté et de nuit
Le travail posté et de nuit entraîne un risque accru de multiples problèmes de santé en raison de la perte de sommeil et de la désynchronisation circadienne. Il s’agit notamment de ...
Les défis des interfaces interdisciplinaires
Face à un éventail croissant d’options ciblées et immunothérapeutiques, les tests moléculaires sont de plus en plus au centre de l’attention dans les tumeurs gastro-intestinales. Des ...