Traitement à long terme de la maladie de Basedow
Auteur·es:
Dre méd. Ilaria Giordani
Prof. Dr méd. Gerasimos Skyiotis
Service d’endocrinologie, diabétologie et métabolisme
Hôtel des Patients
CHUV, Lausanne
E-mail: ilaria.giordani@chuv.ch
E-mail: gerasimos.sykiotis@chuv.ch
La maladie de Basedow est la forme la plus fréquente d’hyperthyroïdie, notamment chez les personnes plus jeunes. Les recommandations européennes actuelles préconisent un traitement médicamenteux comme traitement initial, pour une durée limitée à 12–18 mois. Un traitement définitif tel qu’une chirurgie ou un traitement par iode radioactif est proposé lors d’une récidive ou en cas de contre-indication aux antithyroïdiens. Toutefois, des données plus récentes montrent qu’un traitement par antithyroïdiens au long cours est associé à une réduction du risque de récidive, sans augmentation des effets indésirables.
Keypoints
-
Le traitement de la maladie de Basedow en Europe prévoit habituellement un traitement médicamenteux en première intention, et un traitement définitif en cas de persistance ou récidive de la maladie.
-
Le traitement par antithyroïdiens à long terme est une option dans le contexte du traitement de la maladie de Basedow, notamment lors d’une contre-indication ou d’un refus de traitement définitif.
-
Les effets indésirables sévères des antithyroïdiens sont rares et semblent être limités aux premiers mois de traitement.
La maladie de Basedow («Graves’ disease» en anglais) est une maladie auto-immune de la thyroïde qui se manifeste comme hyperthyroïdie secondaire à la production d’auto-anticorps se liant au récepteur de la TSH avec un effet activateur. Comme dans plusieurs autres maladies auto-immunes, la cause n’est pas claire et semble être liée à une combinaison de facteurs génétiques et environnementaux.
Le diagnostic est basé sur la présence d’anticorps anti-récepteurs de la TSH (TRAK, ou TRAb en anglais), associés à une hyperthyroïdie et un goitre diffus et hypervasculaire à l’ultrason. La scintigraphie thyroïdienne montre typiquement une hypercaptation diffuse de la thyroïde, mais souvent n’est pas nécessaire pour confirmer le diagnostic. Il existe également des manifestations extra-thyroïdiennes possibles, notamment l’orbitopathie dysthyroïdienne et l’acropachie.
Traitement de la maladie de Basedow
Trois possibilités thérapeutiques sont actuellement proposées: un traitement freinateur avec médicaments antithyroïdiens de synthèse, un traitement par iode radioactif ou une thyroïdectomie totale. Le traitement par antithyroïdiens est l’option la plus utilisée en Europe comme traitement initial, tandis que le traitement par iode radioactif a historiquement été le traitement de choix aux États-Unis.
Traitement par antithyroïdiens
Le traitement par antithyroïdiens peut restaurer une euthyroïdie et faciliter ainsi une rémission durable de la maladie chez plusieurs patients; en revanche, la thyroïdectomie totale et la radiothérapie métabolique à l’iode 131 provoquent normalement une hypothyroïdie. Le principal désavantage d’un traitement par antithyroïdiens est le risque de récidive après discontinuation du traitement, estimé entre 30 et 70% selon les études.1 On reconnait des facteurs qui sont associés à une plus haute probabilité de récidive, notamment le sexe masculin, l’âge <40 ans, le tabac, une hyperthyroïdie sévère, le titre élevé des anticorps anti-TSHR, le volume thyroïdien augmenté et la présence d’orbitopathie.2,3
Deux types d’antithyroïdiens existent: les imidazoles (carbimazole et méthimazole) et les thiouraciles (propylthiouracile et benzylthyouracile). Ils inhibent la synthèse des hormones thyroïdiennes enbloquant l’action de l’enzyme thyroperoxydase. Le propylthiouracile inhibe également la monodéiodase type 1 et diminue ainsi la conversion périphérique de T4 en T3.
En Suisse, où le méthimazole n’est pas disponible, l’antithyroïdien le plus utilisé est le carbimazole (Néo-Mercazole®). Il s’agit d’un précurseur du méthimazole qui est rapidement converti en méthimazole; 10mg de carbimazole équivalent à 6mg de méthimazole.
Le mécanisme par lequel les antithyroïdiens contribuent à la rémission de l’auto-immunité n’est pas complètement compris, mais l’hypothèse principale est la présence d’un effet immuno-modulateur.4,5
Traitement chirurgical
Le traitement chirurgical prévoit une thyroïdectomie totale, actuellement préférée à une thyroïdectomie subtotale, au vu des risques de récidive avec cette dernière (8% contre presque 0% pour une thyroïdectomie totale),6 ainsi que de la probabilité élevée de développer une hypothyroïdie (environ 50% des patients). Suite à une thyroïdectomie, les TRAK diminuent rapidement pendant les 9 premiers mois postopératoires, ils restent toutefois détectables chez 18% des patients après 3 ans.7
Radiothérapie métabolique
La radiothérapie métabolique prévoit l’administration d’une gélule d’iode 131 avec une activité préfixée empiriquement ou calculée selon le volume de la glande et le taux de fixation de l’iode 123 (cette pratique, qui est mandatée par les autorités de santé, nécessite un examen diagnostique préalable). Avec des pourcentages variables selon les études, la plupart des patients évoluent vers une hypothyroïdie, une minorité restent euthyroïdiens, et certains doivent recevoir une deuxième (voire troisième) dose de radioiode en raison d’une hyperthyroïdie persistante. Trois ans après le traitement par iode radioactif, jusqu’à 60% des patients ont des anticorps anti-TSHR détectables.7 Quelques études ont observé que la persistance de taux élevés d’anticorps anti-TSHR est associée à un risque de récidive et d’orbitopathie. Il faut également prendre en considération la possibilité d’une péjoration ou développement d’une orbitopathie suite au traitement par iode radioactif. Ainsi, la présence d’une orbitopathie modérée ou sévère contre-indique généralement le choix de ce traitement.
Recommandations actuelles
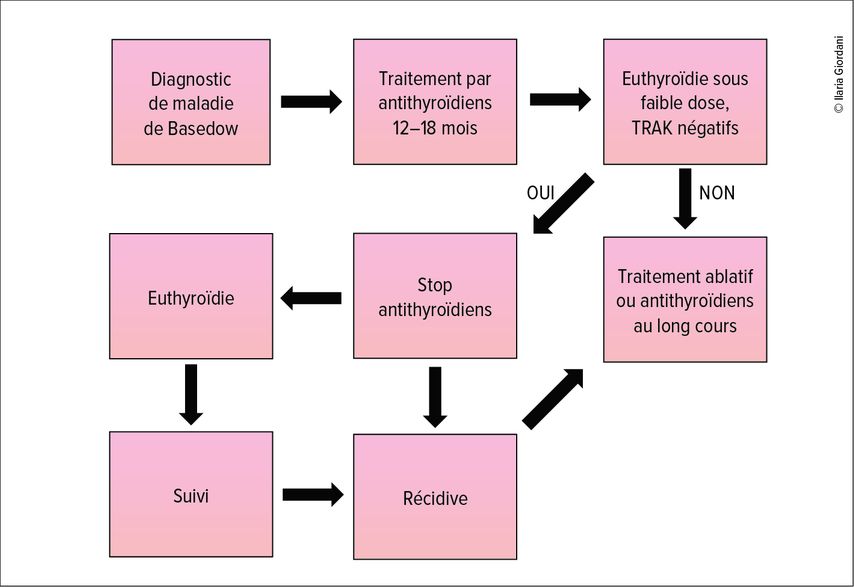
Les recommandations européennes en vigueur (Fig. 1), datant de 2018, préconisent un traitement par antithyroïdiens pendant 12 à 18 mois, stoppé à condition que le taux de la TSH soit dans la norme et que les anticorps anti-TSHR soient négatifs. Un traitement au-delà de 12 à 18 mois peut être pris en considération en alternative au traitement par iode radioactif ou à la chirurgie, en cas de persistance d’hyperthyroïdie.8
Fig. 1: Recommandations européennes pour le traitement par antithyroïdiens de la maladie de Basedow (selon Kahaly et al., 2018)8
Ces recommandations sont basées sur plusieurs études dans les années 1990. Ces études montrent qu’il n’y a pas de bénéfice en termes de taux de rémission à continuer le traitement par antithyroïdiens au-delà des 18 mois.9 Cependant, aucune étude n’a concerné une durée de traitement de plus de 42 mois.
Comme mentionné ci-dessus, le taux de rémission après une cure initiale par antithyroïdiens est approximativement de 30% à 70% selon les études. Malgré la présence de plusieurs facteurs pronostiques, la réponse au traitement dans les cas individuels est difficilement prévisible avant le traitement. La réponse aux anti-thyroïdiens et l’évolution des TRAK pendant le traitement peuvent aider à reconnaître les patients plus à risque de récidive.
Un traitement définitif (chirurgie ou iode radioactif) est indiqué si les TRAK restent positifs après le traitement par antithyroïdiens ou en cas de récidive après la suspension de ces derniers. Une deuxième cure d’antithyroïdiens peut être proposée en cas de récidive. Quelques études ont démontré une modeste diminution du taux de récidive avec une deuxième, troisième ou quatrième cure.10,11
Traitement par antithyroïdiens au long cours
Actuellement, de plus en plus de données suggèrent la possibilité d’un traitement sur le long terme (et dans certains cas, à vie) avec les antithyroïdiens de synthèse.
En 2015, Villagelin et al., ont démontré l’efficacité d’un traitement par méthimazole chez des patients avec maladie de Basedow récidivante après une première cure d’antithyroïdiens. Le traitement par méthimazole à faible dose (2,5–7,5mg/j) pendant 60 mois était associé à des taux d’euthyroïdie plus élevés par rapport aux patients traités à l’iode radioactif, ainsi qu’à des meilleurs résultats au niveau de l’orbitopathie.12
Une étude rétrospective en Corée a montré que la durée du traitement par antithyroïdiens est directement corrélée aux taux de rémission après l’arrêt du traitement, avec un taux de récidive de 19% pour les patients traités pendant >6 ans.13 Cette étude confirme les résultats d’une méta-analyse de 2017 qui a démontré un taux de rémission de 16% pour chaque année de traitement.14
Le traitement médical présente également des risques: hormis les effets indésirables mineurs (éruptions cutanées, arthralgie), il existe un risque de complications sévères et potentiellement létales, comme l’agranulocytose ou une hépatite, vasculite ou pancréatite médicamenteuse. Les effets indésirables se produisent habituellement pendant les 3 à 6 premiers mois de traitement et ils semblent être associés à des doses plus élevées.15
Une revue de littérature de 2019 a analysé la fréquence des effets indésirables des antithyroïdiens chez les patients avec un traitement sur le long terme par méthimazole (1660 patients, durée moyenne de traitement entre 2,3 et 14,2 ans).16 Les auteurs ont conclu que les effets indésirables mineurs étaient plutôt fréquents (entre 2% et 36% selon les études), les plus habituels étant les réactions cutanées, les perturbations des tests hépatiques, la leucocytopénie et les arthralgies. Néanmoins, seulement 14 patients ont présenté des effets indésirables sévères, notamment une agranulocytose (n=7), une hépatite (n=5), une glomérulonéphrite (n=1) et une vasculite (n=1). D’ailleurs, sur les 1660 patients inclus dans l’étude, seulement 5 patients ont présenté des effets indésirables après la première année de traitement.
Une étude danoise récente sur le traitement à long terme par méthimazole des patients avec maladie de Basedow avec un suivi de 48 mois confirme la sécurité du traitement. Environ 10% des patients ont présenté des effets indésirables (pour la plupart des réactions cutanées), dont 75% dans les 6 premiers mois de traitement. Aucun effet indésirable n’a été décrit chez les patients qui ont continué le traitement avec une dose de 5mg/j de méthimazole après 24 mois.17
Une autre étude prospective a confirmé le bénéfice de poursuivre le traitement par antithyroïdiens au-delà de la durée recommandée, chez des patients avec maladie de Basedow en euthyroïdie sous faible dose de méthimazole (2,5–5mg/j).18
La cohorte avec le suivi le plus long est une cohorte de patients avec maladie de Basedow sous traitement par méthimazole pour une durée moyenne de 14,2 ans décrite par Azizi en 2021.19 Parmi les 32 patients qui ont interrompu le traitement, seulement 19% ont eu une récidive de l’hyperthyroïdie. Le groupe de 27 patients qui a poursuivi le traitement jusqu’à 24 ans de suivi avait des valeurs de TSH non supprimées, des doses de méthimazole de 2,8mg/j, des TRAK négatifs et aucun effet indésirable rapporté après 24 mois de traitement.
Goitre multinodulaire toxique et antithyroïdiens au long cours
Fig. 2: Le traitement sur le long terme de l’hyperthyroïdie par antithyroïdiens est efficace et avec des effets indésirables limités. Il peut être considéré comme une alternative parfaitement valable dans le contexte du traitement de la maladie de Basedow, et potentiellement aussi du goitre multinodulaire toxique
En ce qui concerne le goitre multinodulaire toxique, le traitement définitif (thyroïdectomie ou thérapie par iode radioactif) est habituellement préféré au traitement par antithyroïdiens puisque l’hyperthyroïdie récidive à l’arrêt du traitement par antithyroïdiens chez 95% des patients.20 Il existe très peu d’études sur le traitement à long terme de l’hyperthyroïdie dans le contexte d’un goitre multinodulaire toxique. Une étude randomisée et contrôlée publiée en 2019 a comparé l’efficacité et la sécurité du traitement par méthimazole sur le long terme au traitement par iode radioactif chez des patients avec goitre multinodulaire toxique. Les auteurs ont démontré que le traitement au long cours avec méthimazole permet d’atteindre l’euthyroïdie chez 89% des patients, avec une dose moyenne de 5mg/j à partir de la deuxième année de traitement.21 Comme pour la maladie de Basedow, les rares effets indésirables se sont produits lors des trois premiers mois de traitement, et aucun patient n’a développé de réaction secondaire entre le 4e et le 100e mois de suivi.
Conclusion
Le traitement sur le long terme de l’hyperthyroïdie est efficace, avec des effets indésirables limités, et il peut être considéré comme une alternative parfaitement valable dans le contexte du traitement de la maladie de Basedow, et potentiellement aussi du goitre multinodulaire toxique. Plus spécifiquement, l’administration prolongée d’une faible dose de carbimazole ou méthimazole peut constituer une alternative à un traitement définitif, en particulier chez les patients pour qui une chirurgie ou un traitement par iode radioactif sont contre-indiqués, ou qui refusent un traitement définitif.
Littérature:
1 Mohlin E et al.: Long-term prognosis after medical treatment of Graves‘ disease in a northern Swedish population 2000-2010. Eur J Endocrinol 2014; 170: 419-27 2 Shi H et al.: Risk factors for the relapse of Graves‘ disease treated with antithyroid drugs: a systematic review and meta-analysis. Clin Ther 2020; 42: 662-75.e4 3 Struja T et al.: Can we predict relapse in Graves‘ disease? Results from a systematic review and meta-analysis. Eur J Endocrinol 2017; 176: 87-97 4 Laurberg P: Remission of Graves‘ disease during anti-thyroid drug therapy. Time to reconsider the mechanism? Eur J Endocrinol 2006; 155: 783-6 5 Volpe R: The immunomodulatory effects of anti-thyroid drugs are mediated via actions on thyroid cells, affecting thyrocyte-immunocyte signalling: a review. Curr Pharm Des 2001; 7: 451-60 6 Guo Z et al.: Total thyroidectomy vs bilateral subtotal thyroidectomy in patients with Graves‘ diseases: a meta-analysis of randomized clinical trials. Clin Endocrinol 2013; 79: 739-46 7 Kautbally S et al.: Greater efficacy of total thyroidectomy versus radioiodine therapy on hyperthyroidism and thyroid-stimulating iImmunoglobulin levels in patients with Graves‘ disease previously treated with antithyroid drugs. Eur Thyroid J 2012; 1: 122-8 8 Kahaly GJ et al.: 2018 European Thyroid Association guideline for the management of Graves’ hyperthyroidism. Eur Thyroid J 2018; 7: 167-86 9 Burch HB, Cooper DS: Anniversary review: Antithyroid drug therapy: 70 years later. Eur J Endocrinol 2018; 179: R261-74 10 Kim YA et al.: The second antithyroid drug treatment is effective in relapsed Graves‘ disease patients: a median 11-year follow-up study. Thyroid 2017; 27: 491-6 11 Liu X et al.: A second course of antithyroid drug therapy for recurrent Graves‘ disease: an experience in endocrine practice. Eur J Endocrinol 2015; 172: 321-6 12 Villagelin D et al.: Outcomes in relapsed Graves‘ disease patients following radioiodine or prolonged low dose of methimazole treatment. Thyroid 2015; 25: 1282-90 13 Park SY et al.: The longer the antithyroid drug is used, the lower the relapse rate in Graves‘ disease: a retrospective multicenter cohort study in Korea. Endocrine 2021; 74: 120-7 14 Azizi F, Malboosbaf R: Long-term antithyroid drug treatment: a systematic review and meta-analysis. Thyroid 2017; 27: 1223-31 15 Otsuka F et al.: Hepatotoxicity and cutaneous reactions after antithyroid drug administration. Clin Endocrinol 2012; 77: 310-5 16 Azizi F, Malboosbaf R: Safety of long-term antithyroid drug treatment? A systematic review. J Endocrinol Invest 2019; 42: 1273-83 17 Karmisholt J et al.: Long-term methimazole therapy in Graves‘ hyperthyroidism and adverse reactions: a Danish multicenter study. Eur Thyroid J 2022; 11: e22003 18 Lertwattanarak R et al.: Benefits of long-term continuation of low-dose methimazole therapy in the prevention of recurrent hyperthyroidism in Graves‘ hyperthyroid patients: a randomized prospective controlled study. Int J Endocrinol 2022; 2022: 1705740 19 Azizi F et al.: Control of Graves‘ hyperthyroidism with very long-term methimazole treatment: a clinical trial. BMC Endocr Disord 2021; 21: 16 20 van Soestbergen MJ et al.: Recurrence of hyperthyroidism in multinodular goiter after long-term drug therapy: a comparison with Graves‘ disease. J Endocrinol Invest. 1992; 15: 797-800 21 Azizi F et al.: Treatment of toxic multinodular goiter: comparison of radioiodine and long-term methimazole treatment. Thyroid 2019; 29: 625-30
Das könnte Sie auch interessieren:
Biomarqueurs hématologiques des infections – qu’est-ce qui est pertinent etdans quel cas?
Le dosage de différents biomarqueurs joue un rôle important dans le dépistage des infections fongiques invasives. L’évaluation d’un biomarqueur positif en cas d’infections fongiques ...
«Grâce à la Young Oncology Academy, j’ai pu me constituer un réseau»
La Young Oncology Academy (Academy) du Swiss Cancer Institute est un programme de promotion et de mentorat pour les jeunes oncologues. Le programme s’adresse aux médecins-assistants qui ...
«Ce serait bien d’établir un lien»
Le cancer du poumon de Michael Emmenegger-Müller a changé sa vie, mais pas sa motivation à s’engager pour les autres. Il a fondé l’organisation «Leben mit Lungenkrebs» (Vivre avec le ...